Sản phẩm PCR được thu nhận bằng phương pháp thôi gel, tinh chế bằng QIAquick PCR Purification Kit sau đó giải trình tự bằng máy giải trình tự gen ABI 3500. Sau khi giải trình tự, các chương trình phần mềm chuyên dụng như Blast, BioEdit, MEGA6.0... đã được sử dụng để phân tích, đánh giá mức độ tương đồng và xây dựng cây phả hệ dựa trên trình tự vùng gen E của chủng gốc BV-MSV-0210 và chủng sản xuất BV-WSV-0310. Kết quả cho thấy, gen mã hóa kháng nguyên E có độ dài 1500 bp, tỷ lệ G/C là 52%, mã hóa cho một protein có độ dài 500 axit amin. Thông tin về trình tự nucleotide và protein gen E được nêu trong hình 3.5. và 3.6.
Độ dài và trình tự các nucleotide và protein của gen mã hóa kháng nguyên E của chủng gốc, chủng sản xuất và chủng tham chiếu là hoàn toàn giống nhau. Các chủng này có sự tương đồng 100% cả về nucleotide và axit amin. Tuy nhiên, khi so sánh trình tự nucleotode và axit amin của chủng gốc và chủng sản xuất với trình tự gen mã hóa kháng nguyên E của các chủng vi rút VNNB phân lập ở Việt Nam thì tỷ lệ phần trăm tương đồng rất khác nhau (Bảng 3.6).
Bảng 3.6. Tỷ lệ tương đồng về nucleotide và protein gen mã hóa kháng nguyên E của chủng gốc (BV-MSV-0210) và chủng sản xuất (BV-WSV-0310) so với trình tự vùng gen E của các chủng virút VNNB phân lập ở Việt Nam trong các năm khác nhau và từ các vật chủ khác nhau
Số đăng ký trong GenBank | Năm phân lập | Vật chủ | Genotype | Tỷ lệ tương đồng (%) của MSV, WSV so với các chủng VNNB phân lập ở VN từ 1964-2014 | ||
Nucleotide | Protein | |||||
1 | LC000631 | 1964 | Người | GIII | 97,45 | 98,31 |
2 | AY376461 | 1986 | Người | 96,40 | 99,00 | |
3 | AY376463 | 1989 | Người | 96,73 | 99,20 | |
4 | HQ009263 | 2004 | Người | 97,53 | 97,20 | |
5 | LC000634 | 2007 | Người | GI | 87,45 | 96,73 |
6 | KP876007 | 2014 | Người | 86,67 | 97,04 | |
7 | AY376464 | 2001 | Lợn | GI | 88,33 | 98,40 |
8 | AY376465 | 2002 | Lợn | 88,27 | 98,40 | |
9 | HQ009265 | 2005 | Lợn | 87,47 | 98,00 | |
10 | JEU70420 | 1979 | Muỗi | GIII | 99,00 | 98,06 |
11 | AB933311 | 1994 | Muỗi | GI | 88,05 | 98,22 |
12 | AY376468 | 2002 | Muỗi | 88,33 | 98,40 | |
13 | JN574431 | 2005 | Muỗi | 87,80 | 98,04 | |
14 | LC000635 | 2010 | Muỗi | 87,54 | 96,77 | |
15 | LC000637 | 2011 | Muỗi | 86,05 | 94,55 |
Có thể bạn quan tâm!
-
 Trang Thiết Bị, Vật Tư Tiêu Hao Sử Dụng Trong Nghiên Cứu
Trang Thiết Bị, Vật Tư Tiêu Hao Sử Dụng Trong Nghiên Cứu -
 Thông Tin Về Trình Tự Vùng Gen E Của Các Chủng Vi Rút Vnnb Phân Lập Ở Việt Nam Trong Các Năm Khác Nhau Và Từ Các Vật Chủ Khác Nhau Sử Dụng Trong
Thông Tin Về Trình Tự Vùng Gen E Của Các Chủng Vi Rút Vnnb Phân Lập Ở Việt Nam Trong Các Năm Khác Nhau Và Từ Các Vật Chủ Khác Nhau Sử Dụng Trong -
 Tính Ổn Định Về Hiệu Giá Và Di Truyền Của Chủng Beijing-1
Tính Ổn Định Về Hiệu Giá Và Di Truyền Của Chủng Beijing-1 -
 Kết Quả Đánh Giá Cảm Quan, Tỷ Trọng Và Vô Trùng Của 10 Lô Vắc Xin Jecevax
Kết Quả Đánh Giá Cảm Quan, Tỷ Trọng Và Vô Trùng Của 10 Lô Vắc Xin Jecevax -
 Sự Tương Đồng Kháng Nguyên Của Chủng Sản Xuất Vắc Xin Vnnb So Với Các Chủng Viêm Não Nhật Bản Lưu Hành Tại Việt Nam
Sự Tương Đồng Kháng Nguyên Của Chủng Sản Xuất Vắc Xin Vnnb So Với Các Chủng Viêm Não Nhật Bản Lưu Hành Tại Việt Nam -
 Tính An Toàn Và Tính Sinh Miễn Dịch Của Jecevax Sản Xuất Từ Chủng Bv- Wsv-0310 Ở Quy Mô Phòng Thí Nghiệm
Tính An Toàn Và Tính Sinh Miễn Dịch Của Jecevax Sản Xuất Từ Chủng Bv- Wsv-0310 Ở Quy Mô Phòng Thí Nghiệm
Xem toàn bộ 178 trang tài liệu này.
So sánh trình tự nucleotide và trình tự protein gen E của chủng sản xuất, chủng gốc với các chủng virút VNNB phân lập ở Việt Nam, đặc biệt các chủng phân lập từ người, kết quả cho thấy, tỷ lệ này dao động từ 86,67 đến 97,53% đối với nucleotide và 97,2 đến 99,20% đối với protein. Trên người hay muỗi hay lợn, các chủng thuộc genotype III (GIII) sự tương đồng nucleotide và protein đều >95% và cao hơn hẳn các chủng thuộc genotype I (GI) (sự tương đồng nucleotide chỉ 86-88,3% nhưng sự tương đồng protein đều >94%). Vậy liệu các epitope có tính quyết định đối với đáp ứng miễn dịch sinh kháng thể trung hòa virút có thay đổi hay không?
c. Kết quả xác định các vị trí epitope của protein E của chủng sản xuất
Chúng tôi đã dịch mã các chủng trong nghiên cứu và kiểm tra các vị trí epitope (yếu tố quyết định kháng nguyên, đoạn protein kết hợp trực tiếp với kháng thể) và các axit amin quyết định tính kháng nguyên thuộc epitope theo kết quả nghiên cứu của Luca và cộng sự. Kết quả được nêu trong bảng 3.7.
Bảng 3.7. Vị trí các epitope và vị trí của các axit amin quyết định tính kháng nguyên thuộc epitope protein E của chủng sản xuất (BV-WSV-0310), chủng tham chiếu (Beijing-1 Kanonji), chủng vi rút VNNB phân lập ở người năm 2014 và chủng vắc xin SA14-14-2.
Domain II-vòng nối protein E | Khớp nối Domain I-II | Khe bên Domain I | Khe bên của Domain III | |||||||||
Vị trí epitope trung hòa | 104 | 106 | 107 | 52 | 126 | 136 | 275 | 179 | 337 | 360 | 302 | 387 |
AA của chủng SA14-14-2 (Luca et al.) | G | G | L | Q | I | K | S | K | I | F | G | R |
AA của BV- WSV-3010 | G | G | L | Q | I | K | S | K | I | F | G | R |
AA của 2014_KP876007 _Human_ProE | G | G | L | Q | I | K | S | K | I | F | G | R |
AA của chủng Kanonji | G | G | L | Q | I | K | S | K | I | F | G | R |
Kết quả ở bảng 3.7 cho thấy, các epitope thuộc gen mã hóa kháng nguyên E ở chủng sản xuất, chủng tham chiếu, chủng vắc xin SA14-14-2 và chủng virút VNNB phân lập từ người ở Việt Nam năm 2014 đều không thay đổi.
Bảng 3.8. Tính ổn định hiệu giá chủng gốcBV-MSV-0210 và chủng sản xuất BV- WSV-0310 khi bảo quản trong nitrogen lỏng
Hiệu giá virus trên tế bào (log PFU/ml) | ||
Lô chủng BV-MSV-0210 | Lô chủng sản xuất BV-WSV-0310 | |
Năm 2010(thời điểm 0) | 7,94 | 7,59 |
Sau 3 năm | / | 7,57 |
Sau 4 năm | / | 7,57 |
Sau 6 năm | 7,87 | 7,58 |
Sau 8 năm | 7,92 | 7,54 |
Sau 9 năm | / | 7,56 |
Sau 10 năm (năm 2020) | 7,89 | 7,53 |
Ghi chú: “/” là không làm.
Ngoài ra chủng còn được giám sát trong suốt quá trình bảo quản, sử dụng, cất giữ từ 2010 đến nay (2020) qua bảng 3.8.
Kết quả nghiên cứu tại bảng 3.8 cho thấy, sau sản xuất và bảo quản trong nitrogen lỏng, hiệu giá chủng gốc BV-MSV-0210 và chủng sản xuất BV-WSV-0310 gần như không có sự thay đổi sau sản xuất đến năm 2020,10 năm sau bảo quản trong nitrogen lỏng.Chủng gốc BV-MSV-0210 hiệu giá luôn cao hơn chủng sản xuất BV- WSV-0310 từ 0,3-0,4 log và giao động giữa các lần thử nghiệm của cả 2 lô chủng chỉ giảm tối đa chỉ từ 0,06 - 0,07 log(bảng 3.8).
Bảng 3.9. Hiệu giá chủng sản xuất BV-WSV-0310 khi bảo quản ở -20oC
Hiệu giá vi rút trên tế bào (log PFU/ml) | |
Thời điểm sau sản xuất | 7,94 |
1 tháng | 7,33 |
3 tháng | 6,03 |
6 tháng | 5,28 |
Kết quả nghiên cứu tại bảng 3.9 cho thấy, hiệu giá vi rút khi bảo quản chủng ở -20oC. Sau 1 tháng giảm 0,61 log; sau 3 tháng giảm 1,91 log (về sát giới hạn tiêu chuẩn cho phép của chủng WSV dự kiến là ≥ 6,0 log), và sau 6 tháng thì giảm sâu rõ rệt (2,66 log) và thấp hơn tiêu chuẩn cho phép (bảng 3.9).
Bảng 3.10. Hiệu giá chủng sản xuất BV-WSV-0310 khi bảo quản ở 2-8oC
Hiệu giá virút trên tế bào (log PFU/ml) | |
Thời điểm sau sản xuất | 7,94 |
1ngày | 6,77 |
3 ngày | 6,48 |
5 ngày | 5,55 |
7 ngày | 5,42 |
Kết quả nghiên cứu cho thấy, hiệu giá chủng BV-WSV-0310bảo quản ở 2-8oC sau 1 ngày giảm 1,17 log; sau 3 ngày giảm 1,46 log vẫn đạt so với tiêu chuẩn (≥ 6,0 log). Nhưng sau 5-7 ngày thì giảm sâu rõ rệt, 2,39-2,52 log và thấp hơn tiêu chuẩn cho phép (bảng 3.10).
3.1.1.4. Kết quả đánh giá một số chỉ số chất lượng khác của chủng gốc BV-MSV- 0210và chủng sản xuất BV-WSV-0310
Kết quả nghiên cứu tại bảng 3.11 cho thấy, chủng gốc (BV-MSV-0210) và chủng sản xuất (BV-WSV-0310) được kiểm tra vô trùng bằng phương pháp cấy trực tiếp vào môi trường FTM và môi trường Thiolycolate. Sau 14 ngày nuôi cấy huyền dịch chủng, 100% các ống môi trường FTM và Thioglycolate được cấy chủng gốc và chủng sản xuất không có sự phát triển của vi nấm và vi khuẩn (bảng 3.11).
Bảng 3.11. Kết quả thử nghiệm vô trùng
Tiêu chuẩn | Tỷ lệ đạt yêu cầu | ||||
BV-MSV-0210 | BV-WSV-0310 | ||||
N | % | N | % | ||
Môi trường FTM | Không phát hiện vi nấm sau 14 ngày | 10 | 100 | 10 | 100 |
Môi trường Thioglicolate | Không phát hiện vi khuẩn sau 14 ngày | 10 | 100 | 10 | 100 |
Bảng 3.12. Kết quả kiểm tra Mycoplasma chủng gốc và chủng sản xuất
Tiêu chuẩn | Tỷ lệ đạt yêu cầu | ||||
BV-MSV-0210 | BV-WSV-0310 | ||||
N | % | N | % | ||
Môi trường lỏng I | Không phát hiện Mycoplasma sau 21 ngày | 2 | 100 | 2 | 100 |
Môi trường lỏng II | Không phát hiện Mycoplasma sau 21 ngày | 2 | 100 | 2 | 100 |
Môi trường thạch đặc | Không phát hiện Mycoplasma sau 21 ngày | 2 | 100 | 2 | 100 |
Chủng gốc (BV-MSV-0210) và chủng sản xuất (BV-WSV-0310) được kiểm tra Mycoplasmaphương pháp cấy trực tiếp lên môi trường chọn lọc. Sau 21 ngày nuôi cấy huyền dịch chủng, 100% các ống môi trưởng lỏng I, môi trường lỏng II và môi trường thạch không phát hiện sự phát triển của Mycoplasma (bảng 3.12).
Bảng 3.13. Kết quả kiểm tra vi rút ngoại lai trên động vật thử nghiệm của chủng gốc và chủng sản xuất
Tiêu chuẩn | Tỷ lệ đạt yêu cầu | ||||
BV-MSV-0210 | BV-WSV-0310 | ||||
N | % | N | % | ||
Chuột nhắt trắng tiêm não 0,03 ml/con | Không có chuột chết, 100% chuột sống khỏe mạnh, không có dấu hiệu bệnh lý trong 21 ngày | 20 | 100 | 20 | 100 |
Chuột nhắt trắng tiêm phúc mạc 0,5 ml/con | 10 | 100 | 10 | 100 | |
Chuột nhắt ổ tiêm não 0,01 ml/con | Không có chuột chết, 100% chuột sống khỏe mạnh, không có dấu hiệu bệnh lý trong 14 ngày | 20 | 100 | 20 | 100 |
Chuột nhắt ổ tiêm phúc mạc 0,1 ml/con | 10 | 100 | 10 | 100 | |
Chuột lang tiêm phúc mạc 5 ml/con | Không có chuột chết, 100% chuột sống khỏe mạnh, không có dấu hiệu bệnh lý trong 42 ngày | 5 | 100 | 5 | 100 |
Kết quả thử nghiệm vi rút ngoại lai của chủng gốc (BV-MSV-0210) và chủng sản xuất (BV-WSV-0310) trên động vật thí nghiệm bằng phương pháp trung hòa huyền dịch chủng với kháng thể và sau đó tiêm cho động vật thí nghiệm.
Kết quả 3 nhóm thử nghiệm cho thấy 100% chuột sống, khỏe mạnh không có dấu hiệu bệnh lý trong suốt quá trình theo dõi sau tiêm(bảng 3.13).
Bảng 3.14. Kết quả kiểm tra vi rút ngoại lai trên tế bào của chủng gốc và chủng sản xuất
Tiêu chuẩn | Tỷ lệ đạt yêu cầu | ||||
BV-MSV-0210 | BV-WSV-0310 | ||||
N | % | N | % | ||
MRC5 | Không có hủy hoại tế bào (CPE), không có vi rút hấp phụ hồng cầu, không có vi rút ngưng kết hồng cầu trong mẫu thử sau 14 ngày | 5 | 100 | 5 | 100 |
Vero | 5 | 100 | 5 | 100 | |
BHK21 | 5 | 100 | 5 | 100 | |
Bảng 3.14 kết quả thử nghiệm vi rút ngoại lai của chủng gốc (BV-MSV-0210) và chủng sản xuất (BV-WSV-0310) trên 3 loại tế bào MRC5, Vero, BHK21. Các loại tế bào sau khi được gây nhiễm bằng huyền dịch trung hòa chủng gốc và chủng sản xuất với kháng thể đặc hiệu, kết quả cho thấy không có hình ảnh hủy hoại tế bào (CPE), không có vi rút hấp phụ hồng cầu, không có vi rút ngưng kết hồng cầu trên tất cả các loại tế bào thử nghiệm sau 14 ngày theo dõi (bảng 3.14).
3.1.2. Tính an toàn và sinh miễn dịch bảo vệ của chủng trên các lô vắc xin thành phẩm sản xuất từ chủng BV-WSV-0310 ở quy mô phòng thí nghiệm
Tính an toàn và tính sinh miễn dịch là 2 yếu tố quyết định đồng thời về chất lượng của một loại vắc xin. Nếu loạt vắc xin chỉ an toàn mà không đủ sinh miễn dịch hoặc ngược lại đáp ứng miễn dịch cao nhưng các thử nghiệm an toàn không đạt thì loạt vắc xin đó không được cấp phép xuất xưởng. Là sản phẩm dùng cho người và không phải cho 1 cá thể mà cho hàng loạt người trong cộng đồng, đặc biệt là trẻ em. Vì vậy, phải đảm bảo an toàn tuyệt đối, trong phạm vi đề tài này chúng tôi đánh giá sự ổn định về tính an toàn và tính sinh miễn dịch bảo vệ ổn định của chủng sản xuất BV-WSV-0310 trên các lô vắc xin thành phẩm ở quy mô phòng thí nghiệm.
3.1.2.1. Đánh giá an toàn trên động vật thí nghiệm của vắc xin JECEVAX
Kết quả thử nghiệm an toàn chung của 10 lô vắc xin VNNB JECEVAX trên động vật thí nghiệm. Sau 7 ngày theo dõi, chuột nhắt và chuột lang được tiêm vắc xin
đều tăng cân, không có các dấu hiệu bệnh lý bất thường. Nhóm chuột nhắt sau 7 ngày tiêm vắc xin tỷ lệ tăng trọng lượng cơ thể dao động trong khoảng 119,1 – 151,1%. Nhóm chuột lang sau 7 ngày tiêm vắc xin tỷ lệ tăng trọng lượng cơ thể dao động trong khoảng 105,0 – 121,0% (bảng 3.15)
Bảng 3.15. Kết quả kiểm tra an toàn chung trên chuột nhắt và chuột lang thí nghiệm của 10 lô vắc xin JECEVAX
Chuột nhắt | Chuột lang | |||
N | % tăng TL | N | % tăng TL | |
J-VC0110 | 5 | 142,0 | 2 | 105,0 |
J-VC0210 | 5 | 139,7 | 2 | 114,3 |
J-VC0310 | 5 | 149,5 | 2 | 121,0 |
J-VC010313 | 5 | 133,0 | 2 | 105,7 |
J-VC020713 | 5 | 151,1 | 2 | 107,6 |
J-VC030713 | 5 | 118,3 | 2 | 110,6 |
J-VC040713 | 5 | 110,0 | 2 | 108,4 |
J-VC031114 | 5 | 123,3 | 2 | 105,3 |
J-VC010416 | 5 | 135,0 | 2 | 109,1 |
J-VC010818 | 5 | 119,1 | 2 | 113,2 |
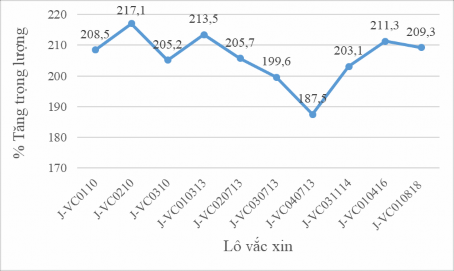
Hình 3. 7. Kết quả kiểm tra an toàn đặc hiệu trên nhắt của 10 lô vắc xin JECEVAX
Trên hình 3.7 cho thấy tỷ lệ % tăng trọng lượng của chuột nhắt trong thử nghiệm kiểm tra an toàn đặc hiệu của 10 lô vắc xin JECEVAX. Tỷ lệ tăng trọng lượng của chuột nhắt sau 14 ngày tiêm vắc xin dao động trong khoảng 187,5 – 217,1%. Toàn bộ chuột được thử nghiệm an toàn đặc hiệu không thấy có các dấu hiệu bệnh lý đặc hiệu do độc tính của vi rút VNNB như biểu hiện bệnh lý về thần kinh, não (liệt, mù, chết) (hình 3.7).
Bảng 3.16. Kết quả kiểm tra chất gây sốt trên thỏ của 10 lô vắc xin JECEVAX
Tiêu chuẩn | Thỏ thử nghiệm | ||
N | Tổng nhiệt độ tăng 3h sau tiêm (oC) | ||
J-VC0110 | Tổng nhiệt độ tăng của 3 thỏ thí nghiệm 3h sau tiêm ≤ 1,3oC | 3 | 0,8 |
J-VC0210 | 3 | 0,4 | |
J-VC0310 | 3 | 0,4 | |
J-VC010313 | 3 | 0,7 | |
J-VC020713 | 3 | 0,4 | |
J-VC030713 | 3 | 0,2 | |
J-VC040713 | 3 | 0,7 | |
J-VC031114 | 3 | 0,4 | |
J-VC010416 | 3 | 1,2 | |
J-VC010818 | 3 | 0,1 |
Kết quả nghiên cứu đánh giá chỉ tiêu chất gây sốt của vắc xin VNNB JECEVAX cho thấy, toàn bộ các nhóm thỏ thử nghiệm đều đạt yêu cầu. Tổng số nhiệt độ thân nhiệt của 3 thỏ thử nghiệm trong mỗi lô vắc xin có tổng số nhiệt độ thân nhiệt tăng đều dưới 1,3oC. Nhiệt độ tăng thân nhiệt 3h sau tiêm của các nhóm thỏ thử nghiệm dao động trong khoảng 0,1 – 0,8oC. Kết quả này cho thấy 100% các mẫu vắc xin của 10 lô vắc xin JECEVAX đều đạt yêu cầu tiêu chuẩn chất gây sốt (bảng 3.16).
3.1.2.2. Đánh giá tính chất lý – hóa của vắc xin JECEVAX
Các lô vắc xin VNNB JECEVAX thành phẩm được kiểm tra các tiêu chuẩn cảm quan, vô trùng, tỷ trọng. Các lọ vắc xin được kiểm định cho thấy 10 lô vắc xin JECEVAX đều đạt yêu cầu về vô trùng và cảm quan. Tỷ trọng của dung dịch vắc xin đo được dao động trong khoảng 1,12 – 1,14 g/ml, đạt tiêu chuẩn tỷ trọng của vắc xin theo TCCS của nhà sản xuất (bảng 3.17).






