3.1.2.1. Khảo sát một số thành phần cơ bản của nguyên liệu
Kết quả phân tích một số chỉ tiêu hóa lý trong hai loại nguyên liệu được thể hiện ở bảng 3.1
Bảng 3.1. Phân tích một số thành phần hóa học trong rễ mật nhân tại Gia Lai và Quảng Nam
ĐVT | Quảng Nam | Gia Lai | |
Protein | % | 3,53 | 5,94 |
Tro tổng | % | 0,02 | 0,03 |
Xenlulose | % | 32 | 44 |
Lipid | % | 4,13 | 4,53 |
Zn | mg/kg | 5,48 | 6,10 |
Cu | mg/kg | 1,60 | 4,29 |
Pb | mg/kg | Không phát hiện <0,05 | Không phát hiện <0,05 |
Hg | mg/kg | Không phát hiện <0,005 | Không phát hiện <0,005 |
Cd | mg/kg | Không phát hiện <0,05 | Không phát hiện <0,05 |
Có thể bạn quan tâm!
-
 Phương Pháp Phân Lập, Xác Định Cấu Trúc Hóa Học Của Các Hợp Chất Từ Rễ Cây Mật Nhân
Phương Pháp Phân Lập, Xác Định Cấu Trúc Hóa Học Của Các Hợp Chất Từ Rễ Cây Mật Nhân -
 Sơ Đồ Tạo Cao Chiết N-Henxane Và Cao Chiết Ethyl Acetate
Sơ Đồ Tạo Cao Chiết N-Henxane Và Cao Chiết Ethyl Acetate -
 Bố Trí Thí Nghiệm Khảo Sát Yếu Tố Thời Gian Chiết
Bố Trí Thí Nghiệm Khảo Sát Yếu Tố Thời Gian Chiết -
 Kết Quả Phân Lập, Định Danh Các Hợp Chất Không Thuộc Nhóm Alkaloid
Kết Quả Phân Lập, Định Danh Các Hợp Chất Không Thuộc Nhóm Alkaloid -
 Xây Dựng Quy Trình Chiết Rễ Cây Mật Nhân Bằng Phương Pháp Chưng Ninh Hồi Lưu Trong Dung Môi Ethanol 80 %
Xây Dựng Quy Trình Chiết Rễ Cây Mật Nhân Bằng Phương Pháp Chưng Ninh Hồi Lưu Trong Dung Môi Ethanol 80 % -
 Kết Quả Thử Hoạt Tính Sinh Học Của Dịch Chiết Rễ Cây Mật Nhân
Kết Quả Thử Hoạt Tính Sinh Học Của Dịch Chiết Rễ Cây Mật Nhân
Xem toàn bộ 151 trang tài liệu này.
Nhận xét: Kết quả phân tích ở bảng 3.1 cho thấy, một số thành phần cơ bản trong nguyên liệu rễ cây mật nhân ở vùng núi Quảng Nam và Gia Lai tương đối giống nhau và về mặt dinh dưỡng, chúng đều có giá trị tương đương như thành phần của một số loại rau củ thông dụng đối với con người.
3.1.2.2. Khảo sát khả năng gây độc tế bào ung thư
Kết quả khảo sát (sàng lọc) khả năng gây độc tế bào ung thư in vitro đối với dịch chiết ethanol 80 % của hai loại nguyên liệu được thể hiện ở bảng 3.2 và bảng 3.3.
Kết quả chi tiết được trình bày tại phụ lục 4.
Bảng 3.2. Khả năng gây độc tế bào ung thư của dịch chiết ethanol 80 % rễ cây mật nhân tại huyện Ia Grai, tỉnh Gia Lai
Nồng độ (µg/mL) | LU-1 | LNCaP | MCF7 | Hep-G2 |
100 | 91,66 | 86,35 | 100,49 | 94,17 |
20 | 16,81 | 23,68 | 10,62 | 15,38 |
4 | 3,83 | 14,43 | 2,92 | 8,91 |
0,8 | -1,65 | -9,75 | -4,32 | -6,23 |
IC50 | 55,20±6,4 | 44,36±4,17 | 58,56±4,92 | 53,69±5,63 |
Nồng độ (µg/mL) | Ellipticine | |||
LU-1 | LNCaP | MCF7 | Hep-G2 | |
IC50 | 0,46±0,02 | 0,34±0,02 | 0,41±0,03 | 0,38±0,04 |
Bảng 3.3. Khả năng gây độc tế bào ung thư của dịch chiết ethanol 80 % rễ cây mật nhân tại huyện Phước Sơn, tỉnh Quảng Nam
Nồng độ (µg/mL) | LU-1 | LNCaP | MCF7 | Hep-G2 |
100 | 64,52 | 66,79 | 68,27 | 71,84 |
20 | 21,26 | 25,09 | 27,72 | 30,37 |
4 | 12,86 | 19,81 | 16,29 | 15,16 |
0,8 | 9,55 | 11,13 | 13,09 | 8,38 |
IC50 | 72,35±7,16 | 64,69±7,05 | 60,86±2,40 | 51,50±3,41 |
Nồng độ (µg/mL) | Ellipticine | |||
LU-1 | LNCaP | MCF7 | Hep-G2 | |
IC50 | 0,42±0,06 | 0,36±0,05 | 0,39±0,02 | 0,38±0,02 |
Nhận xét: Từ kết quả của bảng 3.2 và 3.3 nêu trên cho thấy, dịch chiết ethanol 80
% của rễ cây mật nhân của cả hai vùng nguyên liệu đều có khả năng gây độc tế bào ung thư với các dòng đã khảo sát, tuy nhiên, một số giá trị IC50 trong bảng 3.2 nhỏ hơn trong bảng 3.3, có nghĩa là, khả năng kháng độc tế bào ung thư trên một số dòng tế bào của dịch chiết ethanol 80 % rễ cây mật nhân tại huyện Ia Grai, tỉnh Gia Lai có tốt hơn so với dịch chiết ethanol 80 % rễ cây mật nhân tại huyện Phước Sơn, tỉnh Quảng Nam.
3.1.2.3. Khảo sát hoạt tính kháng oxy hóa bằng phương pháp thông qua khả năng dập tắt gốc tự do DPPH
Khả năng kháng oxy hóa được đánh giá thông qua khả năng dập tắt gốc tự do DPPH DPPH radical scavenging activity , điều này thể hiện qua sự thay đổi màu của dung dịch DPPH sau khi bổ sung dịch chiết rễ mât nhân ở những nồng độ khác nhau (50 µg/mL; 25 µg/mL; 12,5 µg/mL; 6,25 µg/mL; 3,125 µg/mL trên 2 mẫu: Mẫu 1 là mẫu đối chứng vitamin C, mẫu 2 là dịch chiết rễ mật nhân Gia Lai, mẫu 3 là dịch chiết rễ mật nhân Quảng Nam, kết quả thể hiện qua hình 3.1.

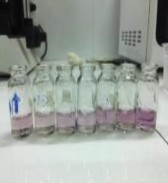

Hình 3.1. Sự thay đổi màu DPPH theo nồng độ
100.00
90.00
80.00
70.00
60.00
50.00
40.00
30.00
20.00
10.00
0.00
0.000
10.000
20.000
30.000
Nồng độ µg/ml
40.000
50.000
60.000
VITAMIN C GIA LAI QN
%DPPH
Kết quả khảo sát khả năng bắt gốc tự do DPPH của vitamin C và hai mẫu dịch chiết được trình bày ở hình 3.2 và đường xu hướng của khả năng bắt gốc tự do DPPH của vitamin C, dịch chiết rễ mật nhân Gia Lai và dịch chiết rễ mật nhân Quảng Nam thể hiện ở hình 3.3.
120.00
100.00
y = 54.451x + 8.4644
R² = 0.966
80.00
60.00
40.00
y = 16.411x + 1.4595
R² = 0.9698
20.00
y = 17.043x - 0.0067
R² = 0.9739
0.00
0
0.2
0.4
0.6
0.8
1
1.2
1.4
1.6
1.8
Log nồng độ
VITAMIN C
GIA LAI
QN Linear (VITAMIN C) Linear (GIA LAI) Linear (QN)
%DPPH
Hình 3.2. Khả năng bắt gốc tự do DPPH của vitamin C, dịch chiết rễ mật nhân Gia Lai và dịch chiết rễ mật nhân Quảng Nam
Hình 3.3. Đường xu hướng của khả năng bắt gốc tự do DPPH của vitamin C, dịch chiết rễ mật nhân Gia Lai và dịch chiết rễ mật nhân Quảng Nam.
Kết quả thể hiện ở hình 3.2 và hình 3.3 cho thấy, khả năng bắt gốc tự do DPPH của dịch chiết rễ mật nhân và vitamin C tăng theo sự tăng nồng độ. Trong khoảng nồng độ thấp (0 - 15 μg/mL), khi tăng nồng độ dịch chiết rễ mật nhân thì khả năng bắt gốc tự do DPPH tăng mạnh, nếu tiếp tục tăng nồng độ rễ mật nhân thì khả năng bắt
gốc tự do DPPH tăng nhẹ.
Từ đồ thị ở hình 3.3, tính toán giá trị IC50 của mẫu dịch chiết và vitamin C (IC50 là nồng độ phần trăm khi chất đó thể hiện hoạt tính kháng 50 %), kết quả được thể hiện ở bảng 3.4.
Bảng 3.4. Giá trị IC50 của dịch chiết rễ mật nhân và vitamin C
IC50 (µg/mL) | |
Dịch chiết rễ mật nhân Quảng Nam | 907,4082 |
Dịch chiết rễ mật nhân Gia Lai | 859,3081 |
Vitamin C | 5,791712 |
Nhận xét: Từ kết quả của bảng 3.4 cho thấy, dịch chiết rễ cây mật nhân ở cả hai vùng Quảng Nam và Gia Lai thể hiện tính oxy hóa rất yếu, tuy nhiên, các nội dung trình bày trên cũng cho thấy khả năng kháng oxy hóa của dịch chiết rễ cây mật nhân Gia Lai tốt hơn Quảng Nam.
Tiểu kết mục 3.1:
Thành phần cơ bản trong nguyên liệu rễ cây mật nhân ở vùng núi Quảng Nam và Gia Lai tương đối giống nhau. Dịch chiết rễ cây mật nhân ở cả hai vùng Quảng Nam và Gia Lai đều thể hiện hoạt tính kháng độc tế bào ung thư trên một số dòng và thể hiện khả năng kháng oxy hóa, trong đó, dịch chiết rễ cây mật nhân ở Gia Lai có khả năng hoạt tính kháng độc tế bào ung thư và kháng oxy hóa lớn hơn dịch chiết rễ cây mật nhân ở Quảng Nam. Bên cạnh đó, trong quá trình khảo sát thực tế, nhận thấy, cây mật nhân mọc tự nhiên ở v ng đồi núi ở tỉnh Gia Lai rất nhiều và gần như được khai thác quanh năm, do đó, để thuận lợi trong việc thu nhận nguyên liệu ứng dụng vào sản xuất thực phẩm sau này, tôi lựa chọn rễ cây mật nhân tại vùng này cho toàn bộ những nghiên cứu tiếp theo.
Với định hướng vùng nguyên liệu đã được chọn, chúng tôi tiếp tục thu nhận mẫu rễ cây mật nhân tại vùng núi huyện Ia Grai – tỉnh Gia Lai với số lượng lớn phục vụ cho toàn bộ quá trình nghiên cứu tiếp theo, bao gồm: Phân lập, xác định thành phần hóa học của nguyên liệu nhằm đánh giá chất lượng, làm cơ sở cho việc xây dựng quy trình chiết tách và khảo sát hoạt tính sinh học cũng như ứng dụng trong sản xuất thực phẩm bảo vệ sức khỏe.
Các hợp chất thuộc nhóm alkaloid được chiết bằng phương pháp chưng ninh hồi
lưu với dung môi phân cực mạnh là nước. Các hợp chất khác được chiết bằng phương pháp Soxhlet với dung môi ít phân cực là n-hexane [4] [8].
3.2. Kết quả phân lập và xác định cấu trúc hóa học
3.2.1. Kết quả phân lập, xác định cấu trúc các hợp chất nhóm alkaloid
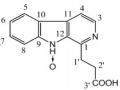
Chất 1: β-carboline-1-propionic acid
Dữ liệu phổ 1H-NMR và 13C-NMR của chất 1 được thể hiện ở bảng 3.5 và phổ
1H-13C (DMSO), phổ MS được thể hiện ở phụ lục 5.
Bảng 3.5. Số liệu phổ 1H- và 13C-NMR của chất 1
Chất 1 | β-carboline-1-propionic acid (DMSO-d6) [89] | |||
δH (ppm, J/Hz) | δC/ppm | δH (ppm, J/Hz) | δC/ppm | |
1 | 140,35 | 140,4 | ||
2 | 112,79 | |||
3 | 8,23 (1H, d, J = 5,5) | 137,30 | 8,23 (1H, d, J = 5,4) | 137,4 |
4 | 7,94 (1H, d, J = 5,5) | 112,79 | 7,94 (1H, d, J = 5,4) | 112,9 |
5 | 8,19 (d, J = 8,0) | 119,17 | 8,19 (1H, dd, J = 7,8; 1,2) | 121,7 |
6 | 7,23 (1H, dd, J = 8,0; 1,5) | 127,80 | 7,23 (1H, ddd, J = 7,8; 6,9; 0,9) | 127,9 |
7 | 7,59 (1H, d, J = 8,0) | 121,61 | 7,53 (1H, ddd, J = 8,1; 6,9; 1,2) | 121,0 |
8 | 7,53 (1H, ddd, J = 7,0, 6.8, 1.0) | 111,91 | 7,60 (1H, dd, J = 8,1; 0,9) | 112,0 |
9 | 144,04 | 144,1 | ||
10 | 127,01 | 127,1 | ||
11 | 119.01 | 119,2 | ||
12 | 133,99 | 134,0 | ||
1’ | 2,87 (2H, t, J = 7,5) | 31,31 | 2,87 (2H, t, J = 7,5) | 31,3 |
2’ | 3,35 (2H, t, J = 7,5) | 28,04 | 3,34 (2H, t, J = 7,5) | 28,1 |
3’ | 174,10 | 174,2 |
Chất 1 được phân lập dưới dạng tinh thể màu trắng. Phổ khối ESI-MS cho pic
ion phân tử tại m/z = 238.8 [M-H]-, kết hợp số liệu phổ 1H và 13C được công thức phân tử dự đoán là C14H12N2O2. Trên phổ proton cho thấy tín hiệu của 2 nhóm methylen tại δH 2,87 (2H, t, J = 7,5 Hz ; δH 3,35 (2H, t, J = 7,5 Hz) cùng với các tín hiệu doublet có tương tác ortho tại δH 8,23 (1H, d, J = 5,5) và 7,94 (1H, d, J = 5,5 Hz , đặc trưng cho các proton dị vòng thơm H-3 và H-4. Ngoài ra trên phổ proton còn cho thấy tín hiệu của 4 proton vòng thơm H-5, H-6, H-7 và H-8 tại δH 8,19 (1H, d, J = 7,5, H-5), 7,59 (1H, d, J = 8,0, H-6), 7,23 (1H, dd, J = 8,0; 1,5, H-7) và 7,53 (1H, ddd, J = 7,5; 1.5,
1.0, H-8).
Phổ 13C NMR cho tín hiệu của 14 carbon trong đó có 1 cacboxylic acid tại δC 174.10, 6 carbon methin vòng thơm tại δC 140,35; 127,80; 121,61; 119,17; 112,79 và
111.91, 5 carbon bậc 4 vòng thơm tại δC 144,04, 140,35; 133,99, 127,03, 120,99 cùng với tín hiệu của hai carbon methylene tại δC 31.31 và 28.04. Các số liệu phổ 1H-, 13C- NMR cho thấy chất 1 có cấu trúc của một đơn vị propionic acid và β-carboline.
Kết hợp các dữ liệu phổ 1H-, 13C-NMR và MS của chất 1 và so sánh với tài liệu tham khảo cho thấy các dữ liệu phổ hoàn toàn phù hợp với dữ liệu phổ của acid β- carboline-1-propionic, do vậy, chất 1 được xác định là β-carboline-1-propionic acid [89].
Theo tra cứu tài liệu nhận thấy, hợp chất này lần đầu tiên được phân lập từ rễ cây mật nhân tại miền Trung – Tây Nguyên.
Chất 2: 9,10-dimethoxycanthin-6-one
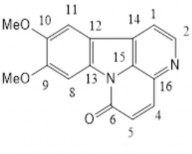
Dữ liệu phổ 1H-NMR và 13C-NMR của chất 2 được thể hiện ở bảng 3.6 và phổ
1H-13C (DMSO), phổ MS được thể hiện ở phụ lục 5.
Bảng 3.6. Số liệu phổ 1H- và 13C-NMR của chất 2
Chất 2 | 9,10-dimethoxy-canthin-6-one (CDCl3) [90] | |||
δH (ppm, J/Hz) | δC/ppm | δH (ppm, J/Hz) | δC/ppm | |
1 | 7,85(1H, d, J = 5,0) | 115,56 | 7,80(1H, d, J = 4,9) | 115,5 |
2 | 8,77(1H, brs) | 145,83 | 8,76(1H, d, J = 5,4) | 145,7 |
3 | ||||
4 | 8,00(1H, d, J = 10,0) | 139,71 | 7,97(1H, d, J = 9,8) | 139,6 |
5 | 6,95(1H, d, J = 9.5) | 128,63 | 6,93(1H, d, J = 9,8) | 128,6 |
6 | 159,63 | 159,6 | ||
7 | ||||
8 | 8,22 (1H, s) | 100,36 | 8,17 (1H, s) | 100,3 |
9 | 152,35 | 152,3 | ||
10 | 148,08 | 148,0 | ||
11 | 7,49 (1H, s) | 104,18 | 7,43 (1H, s) | 104,0 |
12 | 116,46 | 116,4 | ||
13 | 134,67 | 134,6 | ||
14 | 130,68 | 130,6 | ||
15 | 131,90 | 131,9 | ||
16 | 135,80 | 135,7 | ||
OMe-9 | 4,08 (3H, s) | 56,62 | 4,08 (3H, s) | 56,6 |
OMe-10 | 4,04 (3H, s) | 56,46 | 4,03 (3H, s) | 56,4 |
Chất 2 thu được ở dạng tinh thể màu vàng. Phổ khối ESI-MS của chất 2 cho pic ion phân tử tại m/z = 280.9 [M+H]+, kết hợp số liệu phổ 1H và 13C được công thức phân tử dự đoán là C16H12N2O3. Phổ 1H NMR của chất 2 cho các tín hiệu của 2 nhóm methoxy tại δH 4,08 3H, s và 4,04 3H, s ; phía trường thấp có 4 proton của 2 cặp tín hiệu doublet ở δH 8,77; 7,85 (J = 5,0 Hz); 8,02; 6,96 (J = 10,0 Hz đặc trưng cho sự có mặt của vòng pyridin và lactam trong phân tử của chất 2.
Phổ 13C NMR cho các tín hiệu của 2 carbon methoxy tại δC 56.62, 56.46; 6 carbon methyl vòng thơm, bảy carbon bậc bốn vòng thơm, c ng với tín hiệu đặc trưng của nhóm carbonyl của amit tại δC 159,63.
Kết hợp các dữ liệu phổ cho thấy chất 2 là một alkaloid canthin-6-one. Hai
nhóm methoxy được xác định là ở vị trí C-9 và C-10 của chất 2 dựa vào hai tín hiệu singlet tại δH 8,22 (1H, s, H-8) và 7,49 (1H, s, H-11) trên phổ 1H-NMR.
Từ các số liệu trên, kết hợp so sánh với tài liệu tham khảo cho ph p xác định cấu trúc của chất 2 là 9,10-dimethoxycanthin-6-one. Chất này có hoạt tính độc tế bào
khá mạnh đối với dòng tế bào Fibrosarcoma HT-1080 ở người với nồng độ tác dụng IC50 = 5,0 μM [5] [90].
Chất 3: Infractine
Dữ liệu phổ 1H-NMR và 13C-NMR của chất 3 được thể hiện ở bảng 3.7 và phổ
1H-13C (DMSO), phổ MS được thể hiện ở phụ lục 5.
Bảng 3.7. Số liệu phổ 1H- và 13C-NMR của chất 3
Chất 3 | Methyl β-carboline-1-propionate hoặc Infractin [91] CDCl3 | |||
δH (ppm, J/Hz) | δC/ppm | δH (ppm, J/Hz) | δC/ppm | |
1 | 142.62 | 140,6 | ||
2 | ||||
3 | 8,22 (1H, d, J = 5,5) | 138.25 | 8,38 (1H, d, J = 5.4) | 138,6 |
4 | 7,95 (1H, d, J = 5,0) | 114.41 | 7,85 (1H, d, J = 5,4) | 113,2 |
5 | 8,17 (dt, J = 8,0; 0.5) | 120.79 | 8,12 (1H, d, J = 7,8) | 120,0 |
6 | 7,62 (1H, dt, J = 8,0; 0.5) | 129.50 | 7,57 (1H, m) | 128,2 |
7 | 7,27 (1H, dd, J = 7,0; 1,0) | 122.62 | 7,30 (1H, m) | 122,0 |
8 | 7,56 (1H, dd, J = 7,0; 1,0) | 112.89 | 7,57 (1H, m) | 111,8 |
9 | 144.94 | 143,9 | ||
10 | 122.65 | 121,7 | ||
11 | 130.32 | 129,0 | ||
12 | 135.91 | 134,7 | ||
1’ | 2,94 (2H, t, J = 7,5) | 33.44 | 2,98 (2H, t, J = 6,5) | 32,5 |
2’ | 3,47 (2H, t, J = 7,5) | 29.49 | 3,44 (2H, t, J = 6,5) | 28,7 |
3’ | 175.00 | 174,9 | ||
COOCH3 | 3.67 (s, 3H) | 49.85 | 3,64 (s) | 51,8 |
NH | 9,04 (1H, brs) |