Chất 3 được phân lập dưới dạng tinh thể màu trắng. Phổ khối ESI-MS cho pic ion phân tử tại m/z = 254.9 [M+H]+, kết hợp số liệu phổ 1H và 13C được công thức phân tử dự đoán là C15H14N2O2. Phân tích phổ 1H và 13C NMR cho thấy chất 3 có cấu trúc tương tự chất 3. Trên phổ proton cũng cho tín hiệu của sáu proton thơm, trong đó có hai proton H-3 và H-4 tương tác ortho với nhau và bốn proton thơm còn lại thuộc vòng benzen. Tuy nhiên, trên phổ proton của chất 3 còn xuất hiện thêm tín hiệu một nhóm methoxy tại δH3 67 s, 3H đặc trưng cho nhóm methyl ester
Phổ 13C NMR của chất 3 cho tín hiệu của 15 carbon bao gồm một carbonyl
ester tại δC 175.00, tín hiệu của sáu carbon methyl vòng thơm, năm carbon bậc 4 vòng thơm, hai carbon methylene mạch nhánh và tín hiệu của một carbon methoxy tại δC
49.85. Do ảnh hưởng của nhóm methyl ester tại vị trí C-3’, trên phổ proton và carbon của chất 3 cho thấy δC và δH của tại vị trí C-1’ và C-2’ đều dịch chuyển về phía trường thấp hơn so với chất 1 δH/δC C-1’: 2 94/33 44 và C-2’: 3 47/29 49
Phân tích dữ liệu phổ MS, 1H và 13C NMR và so sánh với tài liệu tham khảo
cho thấy chất 3 có cấu trúc là methyl ester của β-carboline-1-propionic acid. Do vậy, chất 3 được xác định là methyl β-carboline-1-propionate hay infractine. Infractine lần đầu tiên được phân lập từ lá cây Cortinarius infractus [91].
Theo tra cứu tài liệu nhận thấy, hợp chất này cũng lần đầu tiên được phân lập từ cây mật nhân tại miền Trung – Tây Nguyên.
Chất 4: β-carboline-2N-oxide-1-propionic acid
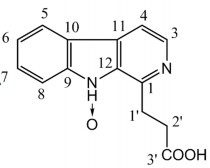
Dữ liệu phổ 1H-NMR và 13C-NMR của chất 4 được thể hiện ở bảng 3.8 và phổ
1H-13C (DMSO), phổ MS được thể hiện ở phụ lục 5.
Bảng 3.8. Số liệu phổ 1H- và 13C-NMR của chất 4
Chất 4 | EL1C (DMSO-d6) [89] | |||
δH (ppm, J/Hz) | δC/ppm | δH (ppm, J/Hz) | δC/ppm | |
1 | 140,35 | 140,48 | ||
2 | - | - | ||
3 | 8,23 (1H, d, J = 5,5) | 137,30 | 8,16 (1H, d, J = 5,5) | 137,19 |
4 | 7,94 (1H, d, J = 5,5) | 112,79 | 7,88 (1H, d, J = 5,5) | 112,39 |
5 | 8,19 (d, J = 8,0) | 119,17 | 8,15 (1H, d, J = 8,5) | 118,80 |
6 | 7,23 (1H, dd, J = 8,0; 1,5) | 127,80 | 7,19, m | 127,45 |
7 | 7,53 (1H, ddd, J = 7,0, 6.8, 1.0) | 121,61 | 7,49 (1H, ddd, J = 8,1; 6,9; 1,2) | 121,46 |
8 | 7,59 (1H, d, J = 8,0) | 111,91 | 7,49 (1H, d, J = 8,0) | 112,15 |
9 | 144,04 | 147,11 | ||
10 | 127,01 | 126,91 | ||
11 | 120,99 | 121,12 | ||
12 | 133,99 | 134,46 | ||
1’ | 2,87 (2H, t, J = 7,5) | 31,31 | 2,87 (2H, t, J = 7,5) | 36,65 |
2’ | 3,35 (2H, t, J = 7,5) | 28,04 | 3,34 (2H, t, J = 7,5) | 31,26 |
3’ | 174,10 | 177,87 |
Có thể bạn quan tâm!
-
 Sơ Đồ Tạo Cao Chiết N-Henxane Và Cao Chiết Ethyl Acetate
Sơ Đồ Tạo Cao Chiết N-Henxane Và Cao Chiết Ethyl Acetate -
 Bố Trí Thí Nghiệm Khảo Sát Yếu Tố Thời Gian Chiết
Bố Trí Thí Nghiệm Khảo Sát Yếu Tố Thời Gian Chiết -
 Khảo Sát Một Số Thành Phần Cơ Bản Của Nguyên Liệu
Khảo Sát Một Số Thành Phần Cơ Bản Của Nguyên Liệu -
 Xây Dựng Quy Trình Chiết Rễ Cây Mật Nhân Bằng Phương Pháp Chưng Ninh Hồi Lưu Trong Dung Môi Ethanol 80 %
Xây Dựng Quy Trình Chiết Rễ Cây Mật Nhân Bằng Phương Pháp Chưng Ninh Hồi Lưu Trong Dung Môi Ethanol 80 % -
 Kết Quả Thử Hoạt Tính Sinh Học Của Dịch Chiết Rễ Cây Mật Nhân
Kết Quả Thử Hoạt Tính Sinh Học Của Dịch Chiết Rễ Cây Mật Nhân -
 Kết Quả Thử Khả Năng Kháng Oxy Hóa Của Dịch Chiết Nước
Kết Quả Thử Khả Năng Kháng Oxy Hóa Của Dịch Chiết Nước
Xem toàn bộ 151 trang tài liệu này.
Chất 4 được phân lập dưới dạng tinh thể màu trắng. Phổ khối ESI-MS cho pic ion phân tử tại m/z = 257,9 [M+2H]+ (95 %) và m/z 255.8 [M], kết hợp số liệu phổ 1H và 13C được công thức phân tử dự đoán là C14H12N2O3. So với chất 1, chất 4 có khối lượng phân tử lớn hơn 16 đơn vị carbon, tương ứng với một nguyên tử oxy. Như vậy, chất 4 là một dẫn xuất N-oxide của chất 1.
So sánh phổ 1H và 13C NMR của hai chất đo trên c ng dung môi cho thấy trên cho thấy các tín hiệu pic tương đồng nhau, riêng phổ 13C NMR có một số tín hiệu dịch chuyển về phía trường thấp hơn với giá trị chênh lệch đáng kể tại C-9 (từ 144,01 về 147,11), C-12 (từ 133,99 đến 134,46), C-1’ từ 31,31-36,65), C-2’ từ 28,04 đến
31,26), C-3’ từ 174,10 đến 177,87).
Qua tham khảo tài liệu, nếu oxy gắn ở vị trí nitơ số 2 thì độ chuyển dịch hóa học của proton H-3 và carbon C-3 đều phải có sự thay đổi nhiều. Tuy nhiên, bảng trên cho thấy proton H-3 hầu như không có sự thay đổi. Carbon C-9 và C-12 cùng với mạch
nhánh gắn tại C-1 lại có sự thay đổi đáng kể về độ chuyển dịch hóa học. Điều này chứng tỏ nguyên tử oxy được gắn với NH, cấu trúc không ph ng của liên kết NH→O đã ảnh hưởng đến carbon C-9, C-12 và mạch nhánh cạnh nó [89] [92].
Qua so sánh với tài liệu tham khảo và kết hợp các dữ kiện phổ cho thấy chất 4 là β-carboline-2N-oxide-1-propionic acid và là chất lần đầu tiên được phân lập từ rễ cây mật nhân.
3.2.2. Kết quả phân lập, định danh các hợp chất không thuộc nhóm alkaloid
Chất 5: Eurylene
![]()
![]()
Dữ liệu phổ 1H-NMR và 13C-NMR của chất 5 được thể hiện ở bảng 3.9 và phổ
1H-13C (DMSO), phổ MS được thể hiện ở phụ lục 5.
Bảng 3.9. Số liệu phổ 1H- và 13C-NMR của chất 5
Chất 5 | Eurylene [61] | Vị trí | Chất 5 | Eurylene [61] | |||||
a,b δC | a,c δH (J = Hz) | a, d δC | a,e δH | a,b δC | a,c δH (J = Hz) | a, d δC | a, e δH | ||
1 | 17.61 | 1.61, s | 17.6 | 1,61, s | 18 | 86.60 | 3.76, dd (8.0, 7.0) | 86.60 | 3.76, dd (8.1, 6.8) |
2 | 131.58 | - | 131.6 | - | 19 | 72.72* | - | 83.80 | - |
3 | 124.52 | 5.10, t, (6.0) | 124.5 | 5.10 td (7.0, 1.2) | 20 | 37.31 | 20a: 1.48, m 20b: 1.37, m | 37.3 | |
4 | 22.11 | 4a: 2.04, m 4b: 2.06, m | 22.1 | 21 | 22.11 | 21a: 2.04, m 21b: 2.06, m | 22.1 | ||
5 | 37.58 | 5a: 1.48, m 5b: 1.37, m | 37.6 | 22 | 124.51 | 5.10, t, (6.0) | 124.5 | 5.10 td (7.0, 1.2) | |
6 | 72.03* | - | 83.6 | 23 | 131.57 | - | 131.6 | - |
84.38 | 3.70, dd, (9.5, 5.5) | 84.6 | 3.70, dd, (9.2, 5.5) | 24 | 17.61 | 1.61, s | 17.6 | 1,61, s | |
8 | 25.73 | 1,83, m | 25.6 | 25 | 25.66 | 1.68, s | 25.7 | 1.68, s | |
9 | 34.18 | 9a: 1.90, m 9b: 1.63, m | 34.2 | 26 | 24.01 | 1.16, s | 24.0 | 1.16, s | |
10 | 83.60* | - | 72.0 | 27 | 22.76 | 1.15, s | 22.8 | 1.15, s | |
11 | 77.62 | 4.86, t, (10.0) | 77.6 | 4.87 brt (9.2) | 28 | 22.49 | 1.16, s | 22.5 | 1.16, s |
12 | 26.85 | 12a: 1.66, m 12b:1.48, m | 26.9 | 29 | 24.14 | 1.18, s | 24.2 | 1.18, s | |
13 | 27.04 | 13a: 1.66, m 13b:1.48, m | 27.1 | 30 | 25.64 | 1.68 s | 25.7 | 1.68 s | |
14 | 78.13 | 4.86, t, (10.0) | 78.2 | 4.87 brt (9.2) | 31 | 170.94 | - | 170.9 | - |
15 | 83.82* | - | 72.7 | 32 | 21.15 | 2.07, s | 21.2 | 2.07, s | |
16 | 34.87 | 16a: 1.96, m 16b: 1.53, m | 34.9 | 33 | 170.81 | - | 170.7 | - | |
17 | 25.55 | 1,83, m | 25.8 | 34 | 21.09 | 2.06, s | 21.1 | 2.06, s |
a: đo trong CDCl3, b: 125MHz, c: 500 MHz, d: 100 MHz, e: 400 MHz
Chất 5 được phân lập dưới dạng tinh thể hình kim màu vàng. Phổ khối ESI-MS của chất 5 cho tín hiệu tại m/z 577.1 [M-H2O + H]+, 559.2 [M-2H2O+H]+ và 629.2 [M+Cl]-, kết hợp số liệu phổ 1H và 13C được công thức phân tử dự đoán là C34H58O8. Phổ 1H và 13C NMR của chất 5 cho tín hiệu đặc trưng của khung squalene triterpene.
Phổ 13C NMR cho thấy có tổng cộng 34 carbon, bao gồm hai carbon carbonyl tại δC 170.94 và 170.81, bốn carbon olephin tại δC 131.58, 131.57, 124.52 và 124.51,
bốn carbon oximethin tại δC 86.60, 84.38, 78.13, 77.62, bốn carbon mang oxy bậc 4 tại
δC 83.82, 83.60, 72.72 và 72.03, 10 carbon methilene trong khoảng δC 45 83 đến 22.11, cùng với tín hiệu của 10 carbon methyl trong khoảng δC từ 25.66-17.61.
Trên phổ 1H NMR, đường intergram chỉ cho tín hiệu của một nửa số proton so
với phổ 13C NMR và tính toán từ phổ khối Điều này chứng tỏ trong phân tử của chất 5 có sự tương đồng giữa hai nửa phân tử. Phổ 1H NMR của chất 5 cho tín hiệu của hai proton olephin tại δH 5.10 (2H, t, J = 6.0, H-3 và H-22), tín hiệu của hai proton oximethin có gắn nhóm acetate được dịch chuyển về phía trường thấp tại δH 4.86 (2H, t, J =10.0, H-11 và H-14) và tín hiệu của một proton oximethin tại δH 3.76 (1H, dd, J = 8.0, 7.0, H-18), 3.70 (1H, dd, J = 9.5, 5.5, H-7), tín hiệu của hai nhóm methyl acetat
(COCH3) tại δH 2.07 và 2.06 (2s, 6H), tín hiệu của các nhóm vinyl methyl tại δH 1.68 (s, 6H, H-25 và H-30), 1.61 (s, 6H, H-1 và H-24), tín hiệu singlet của các nhóm methyl còn lại xuất hiện tại δH 1.18 (3H, s, H-29), 1.16 (6H, s, H-26 và H-28), 1.15 (3H, s, H-
27) và các tín hiệu của các nhóm methylen tại δH 2.04-1.28.
Việc gắn các dữ liệu phổ 1H và 13C NMR của chất 5 được thực hiện dựa trên phân tích chi tiết phổ cộng hưởng từ hạt nhân 2 chiều HSQC và HMBC. Phổ HMBC cho thấy tương tác giữa proton H-11 và H-14 δH 4.86), H-32 và H-34 δH 2.07 và 2.06)/OCO của nhóm carbonyl, chứng tỏ hai nhóm carbonyl được gắn tại vị trí H-11 và H-14. Hai proton H-11 và H-14 còn cho thấy có tương tác với C-12 và C-13 δC 26 9 và 27 1 Tương tác của các proton olephin H-3 và H-22 δH 5.10)/C-1 và C-24
δC 17.61); C-25 và C-30 δC 25.66 và 25.64) đã kh ng định vị trí của nối đôi Tương
tác giữa proton H-7 δH 3.76) và H-18 δH 3.70)/C-26 δC 24.14) và C-29 δC 24 01 đã kh ng định vị trí của carbon bậc 4 mang oxy C-6 và C-19 nằm cạnh vòng tetrahydrofuran Tương tác của proton H-27 δH 1.15)/C-9 δC 34.18) và H-28 δH 1.16)/C-16 δC 34.87) chứng tỏ hai vòng tetrahydrofuran đã được gắn hai nhóm methyl tại vị trí C-10 và C-15.
Theo tài liệu tham khảo, các vị trí carbon mang oxy bậc 4 là C-10 và C-15 có độ dịch chuyển hóa học là δC 72.0 và 72.7; C-6 và C-19 δC 83.60 và 83.80. Tuy nhiên, trên phổ HMBC của chất 5 cho thấy tương tác của H-11 và H-14 với hai carbon tại δC 83 60 và 83 62 Điều này chứng tỏ hai carbon này phải là C-10 và C-15. Bên cạnh đó hai proton H-11 và H-14 lại hoàn toàn không có tương tác với carbon tại δC 72.0 và 72 7 Ngược lại, carbon tại δC 72 0 và 72 7 có tương tác với H-5 và H-20 δH 1.37) chứng tỏ hai carbon này phải ở vị trí C-6 và C-19 [61].
Qua phân tích dữ liệu phổ MS, 1D và 2D-NMR và so sánh với tài liệu tham khảo, hợp chất 5 hoàn toàn trùng khớp với eurylene, một squalenoid đã được phân lập trước đó cũng từ cây mật nhân. Squalene là một hợp chất bicyclic với nửa bên trái (từ C-1 đến C-12) là dẫn xuất của 2,5-trans-tetrahydrofuran và nửa bên phải (từ C-13 đến C-24) là dẫn xuất của 2,5-cis-tetrahydrofuran. Cấu hình của squalene trước đó đã được xác định dựa trên phổ X-ray. Eurylene có hoạt tính chống lại dòng tế bào ung thư máu P388 với IC50 95 µM [61].
Chất 6: Eurycomanone và chất 7: 14,15β-hydroxyklaineanol
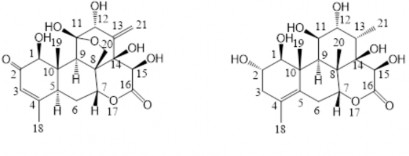
Dữ liệu phổ 1H-NMR và 13C-NMR của chất 6 và chất 7 được thể hiện ở bảng
3.10 và phổ 1H-13C (DMSO), phổ MS được thể hiện ở phụ lục 5.
Bảng 3.10. Số liệu phổ 1H- và 13C-NMR của chất 6 và chất 7
Chất 6 và tài liệu tham khảo [54] | Chất 7 và tài liệu tham khảo [93] | |||||
δa,b H | δ a,c C | δ a, d C | δ a, b H | δ a, c C | δ e, d C | |
1 | 4,59 brs | 82,38 | 82,5 | 4,28 d, J = 9.8 | 81,56 | 82,90 |
2 | 197,10 | 197,1 | 3,49, m | 66,43 | 67,66 | |
3 | 5,20, m, H-3 | 124,79 | 124,9 | 2,12 m 1,96, dd, J = 17,5; 10,5, H-3a | 39,66 | 41,09 |
4 | 162,62 | 162,7 | 123,52 | 124,70 | ||
5 | 2.50, m | 40,72 | 40,7 | 130,87 | 131,99 | |
6 | 2,11, m, H-6a 1,97, m, H-6b | 24,61 | 24,7 | dd, J = 15,0, 4,0, H- 6a brd, J = 15,0, H-6e | 27,37 | 28,47 |
7 | 5,98, brs | 70,44 | 70,6 | 5,16 brs, | 69,09 | 70,89 |
8 | 51,17 | 51,3 | 45,82 | 47,08 | ||
9 | 2,93 brs | 46,08 | 46,2 | 1,51, d, J = 2,0 | 45,35 | 46,61 |
10 | 44,77 | 44,8 | 43,05 | 44,50 | ||
11 | 107,80 | 107,8 | 4,54, brs, giống triplet | 72,51 | 74,47 | |
12 | 434, brs, | 79,12 | 79,2 | 3,13, dd, J = 9,5, 2,5 | 81,36 | 82,81 |
13 | 146,07 | 146,0 | 2,17, m | 34,94 | 36,62 | |
14 | 77,96 | 78,0 | 76,01 | 77,57 | ||
15 | 5,64, brs | 74,66 | 74,8 | 3,45, s | 75,78 | 77,89 |
16 | 172,33 | 172,4 | 174,48 | 176,10 | ||
17 | - | - | - | - | - | |
18 | 1,05, s | 22,31 | 22,4 | 1,37, s | 18,91 | 14,22 |
19 | 1,94, s | 9,52 | 9,7 | 1,41, s | 17,26 | 16,11 |
20 | 3,53,d, J = 8,5, H-20a 3,67, d, J = 8,5, H-20b | 66.09 | 66,2 | 1,58, s | 19,33 | 19,77 |
21 | 5,37, d, J = 1,5, H-21a 5,20, m, H-21b | 118,70 | 118,9 | 1,05, d, J = 7,0 | 13,21 | 19,64 |
a: Đo trong DMSO, b: 500 MHz, c: 125 MHz; d: 100 MHz; e: Đo trong pyridine
Chất 6 được phân lập dưới dạng bột màu trắng. Phổ khối lượng ESI-MS m/z: 408.9 [M+H]+ (15 %), 390.9 [M+H-H2O]+ (100 %), 406.8 [M-H]- (70 %). Phổ 1H và
13C NMR của chất 6 cho các tín hiệu đặc trưng của một quassinoid.
Phổ 1H NMR cho tín hiệu của hai nhóm methyl singlet tại δH 1,94 (3H, s, H-19) và 1,05 (3H, s, H-18), tín hiệu của một nhóm exomethylen và 1 proton olephin tại δH 5,37 (1H, d, J = 1,5, H-21a) và 5,20 (2H, m, H-21b và H-3). Ngoài ra, còn xuất hiện một số tín hiệu của proton methylene mạch vòng dạng AB 2,11 (1H, m, H-6a), 1,97 (1H, m, H-6b) và 3,67 (1H, d, J = 8,5, H-20b), 3,53 (1H, d, J = 8,5, H-20a).
Bên cạnh đó, còn có tín hiệu của 4 proton gắn với oxy tại δH 5,98 (1H, brs, H- 7), 5,64 (1H, brs, H-15), 4,59 (1H, brs, H-1), 434 (1H, brs, H-12). Tín hiệu của hai proton methyl xuất hiện tại δH 2,93 (1H, brs, H-9) và 2.50 (1H, m, H-5). Tín hiệu của proton H-7 tại δH 5,98 (1H, brs, H-7) chứng tỏ H-7 phải là một proton β-equatorial.
Phổ 13C-NMR cho tín hiệu của 20 carbon trong đó có hai nối đôi tại δC 124,79 (C-3), 162,62 (C-4) và 146,07 (C-13), 118,70 (C-21), hai carbon carbonyl bao gồm một carbonyl hệ vòng δ-lacton tại δC 172,33 (C-16) và một carbon ketone liên hợp tại δC 197,10 (C-2), bốn carbon oxymethine, một carbon oxymethylene, một carbon hemiacetal tại δC 107,80 (C-11), một carbon mang oxy bậc 4 tại δC 77,96 (C-14), hai carbon methyl tại δC 9,52 (C-19) và 22,31 (C-18), hai carbon bậc 4, hai carbon methyl và một carbon methylene.
Kết hợp các dữ liệu phổ MS và NMR cho thấy chất 6 là một quassinoid có công thức cấu tạo là C20H24O9. So sánh với tài liệu tham khảo, chất 6 chính là eurycomanone Đây là một trong những thành phần chính tạo nên vị đắng của rễ cây mật nhân. Cùng với eurycomanol, eurycomanone được biết đến là một trong hai hoạt chất chính làm tăng cường và thúc đẩy hormone sinh dục nam testosterone [54].
Chất 7 được phân lập dưới dạng bột màu trắng. Phổ khối ESI-MS của chất 7 cho pic ion tại m/z 433.0 [M+Cl]-, 90 %, tương ứng với công thức phân tử C20H30O8. Phổ cộng hưởng từ hạt nhân 1H và 13C NMR cho thấy chất 7 có công thức cấu tạo
cũng là một quassinoid có khung klaineanone.
Phổ 13C NMR của chất 7 cũng bao gồm 20 carbon trong đó có một carbon carbonyl, hai carbon olephin bậc 4, 6 carbon oxymethine, một carbon mang oxy bậc 4, hai carbon methin v ng trường cao, hai carbon methylene, hai carbon bậc 4 vùng
trường cao và 4 carbon methyl. Phổ 13C NMR của chất 7 so với chất 6 đã mất tín hiệu của carbon keton liên hợp mà chỉ còn carbonyl của lactone mạch vòng δ tại δC 174,48 (C-16 Đồng thời, tín hiệu của carbon olephin bậc 1 và bậc 2 cũng không còn, thay vào đó là tín hiệu của hai carbon olephin bậc 4 tại δC 123,52 (C-4) và 130,87 (C-5). Tín hiệu carbon tại C-21 không còn là carbon olephin mà là một methyl doublet (δH/δC 1,05/18,91) với hằng số tương tác là J = 7,0. Tín hiệu proton tại H-7 (δH 5,16, s) chứng tỏ phải là proton equatorial và có định hướng β trên cấu trúc phân tử. Tín hiệu tại C-3 không còn là một proton olephin mà là một methylene mạch vòng với δH 2,17, m, H- 3e, 1,96, dd, J = 17,5; 10,5, H-3a. Tín hiệu tại C-20-C-11 không còn là hệ mạch vòng hemiacetal mà C-20 là một metyl singlet tại δC 1,58 và C-11 là một oxymethine carbon với δC 72,51.
Qua so sánh với tài liệu tham khảo, chất 7 có số liệu trùng khớp với chất 14,15β-hydroxy klaineanol. Hợp chất này đã được phân lập trước đó từ cây mật nhân vào năm 1993, hợp chất này có hoạt tính kháng k sinh tr ng sốt r t [25] [62].
Kết quả: Chúng tôi đã chiết tách, phân lập và cấu trúc hóa học của các hợp chất với thông tin chung được trình bày tại bảng 3.11.
Bảng 3.11. Bảng tổng hợp kết quả phân lập và xác định cấu trúc hóa học các chất từ rễ cây mật nhân
Tên hợp chất | Đặc điểm, hoạt tính sinh học | Tài liệu tham khảo | |
I. | Hợp chất nhóm alkaloid, bao gồm: | ||
1. | Chất 1: β-carboline-1- propionic acid | Hợp chất lần đầu tiên từ rễ cây mật nhân ở miền Trung – Tây Nguyên được phân lập và công bố. | [89] |
2. | Chất 2: 9,10- dimethoxycanthin-6-one | Hợp chất có hoạt tính kháng độc tế bào khá mạnh đối với dòng tế bào Fibrosarcoma HT-1080 ở người với nồng độ tác dụng IC50 = 5,0 μM. | [5] [90] |
3. | Chất 3: Infractine | Hợp chất lần đầu tiên từ rễ cây mật nhân ở miền Trung – Tây Nguyên được phân lập và công bố. | [91] |
4. | Chất 4: β-carboline-2N- oxide-1-propionic acid | Hợp chất lần đầu tiên được phân lập từ rễ cây mật nhân. | [89] [92] |
II. | Hợp chất không thuộc nhóm alkaloid, bao gồm: | ||






