Khả năng tạo gel được đánh giá theo 4 mức:
Không tạo gel
+ Tạo gel sau vài giây và tan sau vài phút
++ Tạo gel ngay lập tức và tan sau thời gian từ 10 – 20 phút
+++ Tạo gel ngay lập tức và duy trì được > 20 phút
3.2.3.6. Khả năng chảy lỏng
Khả năng chảy lỏng được đánh giá bằng cách úp ngược ống nghiệm chứa 2 ml DIG và quan sát bằng mắt thường. Tính thời gian t từ khi bắt đầu úp ống nghiệm đến khi DIG trong ống chảy đến miệng ống. Khả năng chảy lỏng được đánh giá theo 4 mức (Preetha J. P. et al., 2010):
Không chảy
+ Kém: t > 6 giây
++ Trung bình: 3 < t < 6 giây
+++ Tốt: t < 3 giây
Với pH 6,0 tiến hành ở các nhiệt độ: 4 1 ºC (nhiệt độ bảo quản), 25 1 (nhiệt độ phòng)
Với pH 7,4 tiến hành ở nhiệt độ: 37 1 (nhiệt độ trước giác mạc).
3.2.3.7. Độ nhớt
Sử dụng nhớt kế Brookfield.
DIG ở pH 6,0 được cho vào 1 cốc 100 mL tiến hành đo với tốc độ quay tăng từ 5 rpm đến 25 rpm và công thức sau đó được điều chỉnh pH tăng lên 7,4 bằng cách thêm triethanolamin (Reddy J. and Ahmed M., 2013).
3.2.3.8. Thử kết dính sinh học
Dựa trên các tài liệu tham khảo (Ramadan E. et al., 2010), mô hình đánh giá lực kết dính sinh học được thiết kế như hình 3.2.

Hình 3.2. Mô hình thử kết dính sinh học gel in situ tự chế
Cách xử lý giác mạc mắt heo: giác mạc mắt heo sau khi bóc tách được rửa sạch và bảo quản bằng dung dịch nước mắt nhân tạo, sử dụng trong vòng 3 giờ sau khi bóc tách.
Tiến hành đo lực kết dính sinh học được tiến hành như sau: lắp đặt các bộ phận như hình mô tả. Dùng giác mạc mắt heo đã được xử lý. Cố định giác mạc vào mặt dưới quả cân (đường kính 2 cm). Chỉnh nhiệt độ máy khuấy từ ở 37 1 . Cốc nhựa chứa một lượng nước xác định để đảm bảo hệ thống cân bằng. Cho vào giữa quả cân và đĩa sắt 0,2 mL DIG. Nâng nhẹ cốc nhựa để giác mạc gắn với quả cân nhanh chóng được tiếp xúc với DIG trước khi nó bị gel hóa khoảng 1 phút. Vặn buret với tốc độ tối đa để nước chảy vào cốc cho đến khi miếng giác mạc tách ra thì khoá buret. Khối lượng làm mất bám dính được xác định bằng hiệu số giữa khối lượng nước trong cốc sau và khối lượng nước trong cốc ban đầu.
Lực bám dính niêm mạc được tính bằng công thức: BS = m/S (Ramadan E. et al., 2010).
Trong đó: BS: lực bám dính niêm mạc (g/cm2)
m: khối lượng thêm vào làm mất bám dính S: diện tích tiếp xúc (S = 3,14 cm2)
3.2.3.9. Đánh giá tính kháng khuẩn
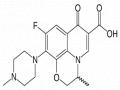
Tác dụng kháng khuẩn được xác định bằng kỹ thuật khuếch tán từ các “giếng” được tạo ra trên môi trường thạch rắn. Hai dung dịch vô khuẩn bao gồm: (1) ofloxacin trong hệ đệm citro – phosphate pH 6,0 (dung dịch chuẩn) và (2) chế phẩm được pha loãng thích hợp với hệ đệm citro – phosphate pH 6,0 (dung dịch thử) được đổ vào các “giếng” đã được đục sẵn trên môi trường thạch dinh dưỡng vô khuẩn trước khi nhân giống với các chủng thử nghiệm là Pseudomonas aeruginosa và Staphylococcus aureus. Sau khi dung dịch khuếch tán vào 2 đĩa thạch, đem ủ ở 37 °C trong 24 giờ. Mỗi dung dịch được tiến hành 3 lần. Vùng ức chế (ZOI) được xác định quanh các giếng (Bangun D. H. et al., 2014).
3.2.3.10. Định lượng hoạt chất
Tiến hành định lượng bằng phương pháp HPLC (Dược điển VN IV).
Điều kiện sắc ký:
Pha động: hỗn hợp dung dịch natri lauryl sulfat 0,24 % - acetonitril - acid acetic băng (580 : 400 : 20).
Pha tĩnh: cột thép không gỉ (25 cm × 4,6 mm) được nhồi pha tĩnh C18 (5 m). Nhiệt độ cột: duy trì ở 35 °C.
Detector quang phổ tử ngoại đặt ở bước sóng 294 nm. Tốc độ dòng: 1,5 ml/min.
Thể tích tiêm: 20 l.
Mẫu chuẩn:
Hòa tan 0,06 g ofloxacin chuẩn trong 100 mL dung dịch acid hydrocloric 0,05 M (TT), sau đó lấy ra 1 mL dung dịch trên pha với 10 mL dung dịch acid hydrocloric 0,05 M (TT) để thu được dung dịch có nồng độ khoảng 0,06 mg/mL.
Mẫu thử:
Hòa tan một lượng DIG trong dung dịch acid hydrocloric 0,05 M (TT) để thu được dung dịch có nồng độ ofloxacin khoảng 0,06 mg/mL.
Công thức tính:
Nồng độ dược chất trong mẫu thử được tính theo công thức sau (Hoá phân tích tập 2, 2013):
Trong đó:
Ct : nồng độ dược chất trong mẫu DIG (mg/mL).
mc: khối lượng dược chất cân ban đầu để pha mẫu chuẩn (mg). St: diện tích pic chính của mẫu DIG (mAU.giây).
Sc: diện tích pic của mẫu chuẩn (mAU.giây).
Phần trăm dược chất chứa trong mẫu DIG được tính theo công thức:
Trong đó:
H: phần trăm dược chất trong mẫu DIG (%).
Ct: nồng độ dược chất trong mẫu DIG (mg/mL).
Co: nồng độ lý thuyết của dược chất trong DIG bào chế (mg/mL), Co= 0,06 mg/mL.
Yêu cầu: hàm lượng ofloxacin trong chế phẩm phải nằm trong giới hạn từ 90 % - 110 % so với hàm lượng ghi trên nhãn (chuyên luận “Ofloxacin”, Dược điển VN IV).
3.2.3.11. Đánh giá khả năng phóng thích hoạt chất in vitro
Môi trường hòa tan là nước mắt nhân tạo. Màng cellophane được ngâm qua đêm trong nước mắt nhân tạo (pH = 7,4), sau đó được gắn vào 1 đầu của 1 xi lanh. Hút chính xác 1 mL chế phẩm vào xi lanh. Xi lanh được gắn liền với ổ trục bằng kim loại và được treo vào trong cốc có chứa 50ml môi trường hòa tan (duy trì ở nhiệt độ 37 1°C). Trục quay với tốc độ 50 vòng/phút (50 rpm). Mỗi giờ lấy ra 1 mL môi trường hòa tan và bổ sung vào cốc một lượng tương ứng môi trường đã lấy ra (Sinh dược học và các hệ thống trị liệu mới, 2007; Rathore K. S., 2011). Lượng dược chất giải phóng được xác định bằng phương pháp định lượng như mục 3.2.3.10.
Cách tính tỷ lệ dược chất giải phóng tại các thời điểm.
Nồng độ dược chất trong môi trường khuếch tán tại thời điểm t (Hoá phân tích tập 2, 2013):
Trong đó:
Ct: nồng độ dược chất trong môi trường khuếch tán tại thời điểm t (µg/mL).
n):
Cc: nồng độ mẫu chuẩn (µg/mL).
St: diện tích pic của mẫu giải phóng (mAU.giây). Sc: diện tích pic của mẫu chuẩn (mAU.giây).
Tổng lượng dược chất đã giải phóng từ DIG tại thời điểm t (lần lấy mẫu thứ
∑
Trong đó:
Qt: tổng lượng dược chất đã giải phóng tại thời điểm t (µg). V: thể tích môi trường khuếch tán (mL).
v: thể tích mỗi lần lấy mẫu giải phóng (mL).
Ct: nồng độ dược chất trong môi trường khuếch tán tại thời điểm t (µg/mL). Ci: nồng độ dược chất trong môi trường khuếch tán tại thời điểm i (µg/mL). Phần trăm dược chất đã giải phóng từ DIG tại thời điểm t:
Trong đó:
Xt: phần trăm dược chất giải phóng tại thời điểm t (%). Qt: lượng dược chất đã giải phóng tại thời điểm t (mg). M: khối lượng dược chất có trong mẫu DIG (mg).
3.2.3.12. Độ ổn định
Gel được đựng trong lọ kín, bảo quản ở 5 1 . Theo dòi độ ổn định của gel trong 15, 30, 45 ngày.
CHƯƠNG 4. KẾT QUẢ VÀ THẢO LUẬN
4.1. XÂY DỰNG CÔNG THỨC CƠ BẢN GEL IN SITU CHỨA 0,3 % OFLOXACIN
4.1.1. Khảo sát nồng độ của carbopol
Theo kết quả khảo sát, ta thấy nồng độ carbopol để tạo được gel lại làm cho dung dịch thuốc có tính acid cao làm tủa hoạt chất và không dễ dàng trung hòa bởi tác dụng đệm của nước mắt. Chính vì vậy, việc giảm nồng độ carbopol mà không làm ảnh hưởng đến khả năng tạo gel và tính chất lưu biến của hệ thuốc rất quan trọng.
Có hai cơ chế giúp cho chuỗi polymer được duỗi thẳng hoàn toàn (Raymond C. R. et al., 2009):
Trung hòa với chất có tính kiềm (amino acid, kali hydroxid, natri hydroxid, natri bicarbonat, amin hữu cơ như mono, di hay triethanolamin, diisopropanolamin). Quá trình trung hòa tạo ra lực đẩy giữa các nhóm COO- giúp duỗi thẳng chuỗi polymer trong gel. Quá trình này diễn ra rất nhanh. Gel chỉ được tăng độ nhớt khi nằm trong khoảng pH 6 – 11, độ nhớt sẽ giảm đáng kể khi pH < 3 hoặc pH > 12.
Thêm các chất có nhiều nhóm hydroxy như các polyol (glycerin, HPMC, propylenglycol, polyethylen glycol) giúp hình thành các liên kết hydro và duỗi thẳng chuỗi polymer. Quá trình này cần thời gian để gel đạt đến độ nhớt tối đa.
4.1.2. Khảo sát sự phối hợp giữa carbopol và các tá dược hỗ trợ
Trung hoà với triethanolamin
Khảo sát 0,15 % (kl/tt) dược chất, hệ đệm citro – phosphat pH 6,0 và carbopol với việc điều chỉnh pH bằng triethanolmin. Mỗi công thức bào chế với lượng 50 mL.
Các công thức được chuẩn bị thể hiện trong hình 4.1.

Hình 4.1. Các công thức được trung hoà bằng triethanolamin đã chuẩn bị Các công thức khảo sát được trình bày trong bảng 4.1.
Bảng 4.1. Công thức thuốc với nồng độ carbopol được trung hoà bởi triethanolamin
Ofloxacin (%, kl/tt) | Carbopol (%, kl/tt) | Triethanolamin (%, kl/tt) | |
A1 | 0,15 | 0,25 | 0,18 |
A2 | 0,15 | 0,3 | 0,2 |
A3 | 0,15 | 0,35 | 0,23 |
A4 | 0,15 | 0,4 | 0,25 |
A5 | 0,15 | 0,45 | 0,29 |
A6 | 0,15 | 0,5 | 0,32 |
Có thể bạn quan tâm!
-
 Nghiên cứu xây dựng công thức điều chế thuốc nhỏ mắt gel in situ chứa 0,3 % ofloxacin - 1
Nghiên cứu xây dựng công thức điều chế thuốc nhỏ mắt gel in situ chứa 0,3 % ofloxacin - 1 -
 Nghiên cứu xây dựng công thức điều chế thuốc nhỏ mắt gel in situ chứa 0,3 % ofloxacin - 2
Nghiên cứu xây dựng công thức điều chế thuốc nhỏ mắt gel in situ chứa 0,3 % ofloxacin - 2 -
 Các Chỉ Tiêu Đánh Giá Gel In Situ Tạo Bởi Thay Đổi Ph
Các Chỉ Tiêu Đánh Giá Gel In Situ Tạo Bởi Thay Đổi Ph -
 Chỉ Định, Chống Chỉ Định, Tác Dụng Không Mong Muốn
Chỉ Định, Chống Chỉ Định, Tác Dụng Không Mong Muốn -
 Nghiên cứu xây dựng công thức điều chế thuốc nhỏ mắt gel in situ chứa 0,3 % ofloxacin - 6
Nghiên cứu xây dựng công thức điều chế thuốc nhỏ mắt gel in situ chứa 0,3 % ofloxacin - 6 -
 Nghiên cứu xây dựng công thức điều chế thuốc nhỏ mắt gel in situ chứa 0,3 % ofloxacin - 7
Nghiên cứu xây dựng công thức điều chế thuốc nhỏ mắt gel in situ chứa 0,3 % ofloxacin - 7
Xem toàn bộ 63 trang tài liệu này.
Các công thức xác định khả năng tạo gel và khả năng chảy lỏng của theo phương pháp trình bày mục 3.2.3.5. và mục 3.2.3.6.
Khả năng tạo gel được đánh giá dựa trên hình thái và khoảng thời gian mà các gel hình thành, màu sắc đã được thêm vào để dễ quan sát hơn, thể hiện trong hình 4.2.

– A6
Hình 4.2. Quan sát trực quan sự hình thành gel trong các công thức A1 – A6 Kết quả được trình bảy ở bảng 4.2.
Bảng 4.2. Kết quả khả năng tạo gel và khả năng chảy lỏng của các công thức A1
Công thức | pH 6,0 | pH 7,4 | Khả năng tạo gel ở 37 1 | |
4 | 25 | 37 | ||
A1 | +++ | +++ | +++ | - |
A2 | +++ | +++ | ++ | ++ |
A3 | +++ | +++ | + | +++ |
A4 | ++ | ++ | + | +++ |
A5 | + | + | - | +++ |
A6 | - | - | - | +++ |
Chú thích: Khả năng chảy lỏng (thời gian chảy t): “-” không chảy; “+” kém (t > 6 giây); “++” trung bình (3 < t < 6 giây); “+++” tốt (t < 3 giây).