chức amine trên bề mặt vật liệu mặc dù phương pháp này khiến diện tích bề mặt và đường kính mao quản của chất mang giảm. Bên cạnh đó, việc khai thác tính năng acid của vật liệu HPA-MQTB-NH2 không thực sự hiệu quả, cho độ chuyển hóa thấp hơn khá nhiều so với HPA nguyên chất. Chính vì vậy, việc nghiên cứu gắn HPA lên vật liệu MQTB silica thông qua tạo liên kết với các ion như NH4+, Cs+ cũng đang được các nhà khoa học quan tâm.
Mô hình liên kết giữa HPA với bề mặt chất mang đã biến tính cũng được Hong Liu và các cộng sự [39] đề cập như ở Hình 1.9. Việc gắn HPA qua nhóm NH2 đã làm tăng tính ưa nước của xúc tác, do đó đã làm tăng hoạt tính xúc tác trong phản ứng ester hóa giữa acid axetic và n-butanol với độ chọn lọc sản phẩm đạt gần 100%.
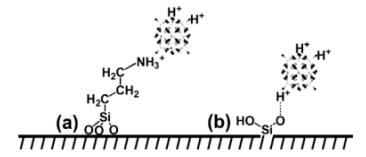
Hình 1.9. Sơ đồ cấu trúc xúc tác với acid H3PW12O40 gắn trên SBA-15: (a)- HPA-NH2- SBA-15; (b)- HPW-SBA-15. [39]
Ở Việt Nam, một phương pháp khác để gắn HPA lên chất mang SBA-15 đã biến tính APTES được nhóm tác giả Phạm Xuân Núi thực hiện thành công là phương pháp trực tiếp (one-step) [40, 41]. Trong phương pháp này, APTES được cho ngay vào trong quá trình tổng hợp SBA-15. Vật liệu thu được (SBA-15 đã biến tính APTES) được proton hóa với acid triflic sau đó cho vào dung dịch acid H3PW12O40 khuấy hồi lưu, lọc rửa, sấy chất rắn thu được sản phẩm cuối cùng. Vật liệu thu được có cấu trúc MQTB lục lăng của chất mang SBA-15, đồng thời cấu trúc Keggin của acid dị đa H3PW12O40 cũng vẫn được duy trì. Vật liệu được ứng dụng xúc tác trong phản ứng khử lưu huỳnh do tính oxy hóa của W. Với nguyên tử W có tính oxy hóa cao, vật liệu cho hoạt tính xúc tác cao trong phản ứng đề sulfur hóa với độ chuyển hóa của dibenzothiophene đạt gần 100%.
1.2.2.4. Phương pháp cố định muối của HPA trên bề mặt chất mang
Acid HPA được ứng dụng nhiều trong ngành công nghiệp hóa học do có tính acid cao và tính oxy hóa khử. Mặc dù ở dạng rắn nhưng acid HPA tan nhiều trong nước và các dung môi phân cực nên hình thành dạng xúc tác đồng thể có diện tích bề mặt thấp và không thể tái sử dụng trong các quá trình tổng hợp. Để vượt qua những hạn chế trên, dạng muối của HPA được điều chế bằng cách trao đổi proton của HPA với các cation như Cs+, K+, NH4+, Rb+, … tạo thành muối không tan trong nước và có diện tích bề mặt lớn (>100 m2/g) [42]. Tuy nhiên, các muối của HPA có độ bền thủy nhiệt kém, có dạng huyền phù trong môi trường phân cực gây khó khăn trong quá trình lọc. Vì vậy, nhiều nghiên cứu đã tiến hành đưa muối của HPA lên các chất mang như vật liệu SiO2, MCM-41, MCM-48, SBA-15, ... Hoạt tính xúc tác của các loại vật liệu này được kiểm chứng thông qua phản ứng alkyl, acyl hóa, và ester hóa,… [43].
Năm 2014, Chamark và cộng sự [44] đã tiến hành tẩm muối Cs của HPA lên vật liệu SBA-15 thông qua quy trình hai giai đoạn:
Có thể bạn quan tâm!
-
 Nghiên cứu tổng hợp xúc tác dị thể siêu acid cố định trên các chất mang Al-SBA-15 và ZSM-5/SBA-15 ứng dụng trong phản ứng tổng hợp fructone - 2
Nghiên cứu tổng hợp xúc tác dị thể siêu acid cố định trên các chất mang Al-SBA-15 và ZSM-5/SBA-15 ứng dụng trong phản ứng tổng hợp fructone - 2 -
 Tổng Quan Về Các Phương Pháp Dị Thể Hóa Acid Dị Đa Trên Chất Mang
Tổng Quan Về Các Phương Pháp Dị Thể Hóa Acid Dị Đa Trên Chất Mang -
![Vị Trí Của Polyoxometalate Keggin Trên Bề Mặt Zeolite Y [20].](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Vị Trí Của Polyoxometalate Keggin Trên Bề Mặt Zeolite Y [20].
Vị Trí Của Polyoxometalate Keggin Trên Bề Mặt Zeolite Y [20]. -
 Ứng Dụng Của Xúc Tác Acid Dị Đa Trong Phản Ứng Chuyển Hóa Hợp Chất Hữu Cơ
Ứng Dụng Của Xúc Tác Acid Dị Đa Trong Phản Ứng Chuyển Hóa Hợp Chất Hữu Cơ -
 Xúc Tác Acid Dị Đa Hpa Cho Phản Ứng Tổng Hợp Fructone
Xúc Tác Acid Dị Đa Hpa Cho Phản Ứng Tổng Hợp Fructone -
 Tổng Hợp Chất Mang Zsm-5/sba-15 Với Các Tỉ Lệ Si/al Khác Nhau
Tổng Hợp Chất Mang Zsm-5/sba-15 Với Các Tỉ Lệ Si/al Khác Nhau
Xem toàn bộ 144 trang tài liệu này.
+ Giai đoạn 1, muối Cs2CO3 được đưa vào chất mang, khi đó, cation Cs+ gắn lên bề mặt mao quản thông qua sự tương tác giữa nhóm silanol và Cs2CO3.
+ Giai đoạn 2, một lượng HPA với tỉ lệ Cs:H xác định được đưa lên vật liệu. Muối của Cs và HPA được hình thành trong mao quản của SBA-15 thông qua sự tương tác giữa acid HPA và ion Cs+ trong bước tẩm thứ hai. Kết quả đặc trưng cấu trúc cho thấy vật liệu vẫn giữ được cấu trúc lục lăng điển hình của SBA-15 khi đưa muối Cs/HPA lên chất mang.
Muối amoni của HPA cũng đã được Fangli Jing và cộng sự [45] đưa lên các loại chất mang khác nhau như SBA-15, ZrO2/SBA-15, SiO2 và sử dụng trong phản ứng oxy hóa chọn lọc isobutene thành acid methacrylic.
Khác với SBA-15, vật liệu Al-SBA-15 có các tâm Bronsted [AlO4-], dễ dàng trao đổi ion để tạo thành các tâm NH4+ và Cs+ liên kết với chất mang dưới dạng ion bù trừ điện tích khung. Khi đưa HPA lên, proton H+ của HPA sẽ trao đổi ion với các tâm NH4+ và Cs+ tạo thành muối của HPA trong mao quản vật liệu. So với phương pháp tẩm được thực hiện trên chất mang SBA-15, HPA được phân bố đồng đều tại các vị trí tâm Bronsted xác định trên Al-SBA-15. Do đó, việc gắn HPA lên vật liệu
Al-SBA-15 bằng cách trao đổi ion với các tâm NH4+, Cs+ là vấn đề cần được nghiên cứu.
1.2.2.5. Phương pháp tổng hợp HPA trực tiếp lên chất mang
Nếu như ở các phương pháp trên sử dụng HPA dạng phân tử (sử dụng các acid đã được thương mại hóa như acid phosphotungstic H3PW12O40, acid silicotungstic H4SiW12O40, acid phospomolybdic H3PMo12O40,…) để gắn lên trên chất mang thì ở phương pháp này sử dụng các tiền chất (thường là từ các muối hoặc oxide kim loại và các acid vô cơ) để tạo ra acid HPA trong sự có mặt của chất mang. Phương pháp này thường sử dụng chất mang là các zeolite.
Zeolite với các hốc lớn trong mạng lưới (gọi là supercages) có đường kính 1,12 nm (Hình 1.10) đã được sử dụng để hình thành các hợp chất với polyoxometalate. Những supercages này được liên kết với nhau bằng các cửa sổ có đường kính 0,735 nm. Do đó, zeolite là vật liệu lý tưởng để gắn (encapsulation) các polyoxometalate Keggin trong không gian của các supercages mà không bị tách rời (Hình 1.11) [46]. Việc gắn các polyoxometalat vào zeolite được quan tâm chú ý vì vật liệu này có thể kết hợp các ưu điểm của zeolite với khả năng hấp phụ và các ưu điểm của polyoxometalate với đặc tính acid, với đặc tính này sẽ khắc phục được những nhược điểm của polyoxometalate về độ tan cao trong các dung môi phân cực nên không sử dụng để làm xúc tác dị thể. Vì các polyoxometalate không thể đi qua các cửa sổ của các supercages, do đó không thể thu được các vật liệu gắn POM bằng việc thêm các polyanion để khuếch tán vào trong mạng lưới của zeolite. Vì vậy chỉ có khả năng duy nhất là tổng hợp trực tiếp bên trong tinh thể zeolite. Tuy nhiên, việc tổng hợp các hợp chất Keggin chỉ có thể thực hiện trong môi trường acid rất thấp (pH<1) và zeolite Y thương mại (với tỉ lệ Si/Al gần 2,5) thì lại không bền trong điều kiện này. Do đó, cần phải loại nhôm (dealuminate) trước khi sử dụng làm chất mang như một số nghiên cứu đã công bố [47- 49].
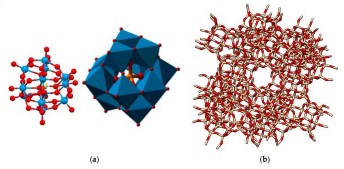
Hình 1.10. Sơ đồ cấu trúc Keggin (a) và các hốc lớn của zeolite Y [46].
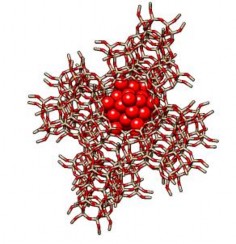
Hình 1.11. Polyoxometalate Keggin trong hốc lớn của zeolite Y [46].
Keggin 12-photphomolybdat [PMo12O40]3-, kí hiệu là PMo12 có thể được tổng hợp dễ dàng từ MoO3 và H3PO4 theo phương trình phản ứng:
12 MoO3 + H3PO4 → H3PMo12O40
Phản ứng này được áp dụng để chế tạo vật liệu với hy vọng polyoxometalate sẽ được định vị vào trong các hốc lớn của zeolite Y. Theo hướng nghiên cứu này, Mukai và các cộng sự [48, 49] đã tiến hành bẫy H3PMo12O40 trong mao quản của zeolite Y và sử dụng làm xúc tác cho phản ứng ester hóa acid acetic với ethanol (môi trường phân cực). Các HPA được đưa vào cùng quá trình tổng hợp zeolite Y và hình thành với kích thước khoảng 1 nm trong các hốc lớn của zeolite Y có kích thước 1,3 nm. Kết quả cho thấy HPA đã được hình thành trong zeolite Y với hàm lượng cao nhất đạt 17% khối lượng. Tuy nhiên sự hình thành này chỉ phù hợp với mẫu có tỉ lệ Si/Al đủ lớn, vì sự xuất hiện của quá nhiều nhôm sẽ dẫn tới khó hình thành zeolite Y trong quá trình tổng hợp xúc tác (zeolite sẽ bị phân hủy trong quá trình tổng hợp polyacid). Ngược lại, nếu hàm lượng nhôm quá ít sẽ không giữ được nhiều HPA trong
các hốc mao quản lớn của zeolite Y. Do đó, việc điều khiển hàm lượng nhôm trong quá trình tổng hợp và việc “bắt giữ” HPA là những bước quan trọng quyết định đến hoạt tính của xúc tác. Mô hình gắn HPA lên chất mang bằng phương pháp “bẫy” được thể hiện như Hình 1.12.
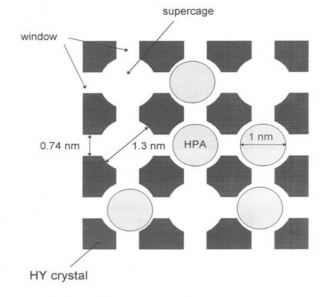
Hình 1.12. HPA được gắn lên chất mang bằng phương pháp “bẫy” [48].
Hơn nữa, sự có mặt của các cation trong các hốc (supercage) rất cần thiết cho quá trình bẫy HPA. Vì vậy, sự có mặt của loại ion đối trong zeolite Y cũng không kém phần quan trọng. Kết quả cho thấy nếu ion bù trừ điện tích khung là NH4+ và Cs+ thì quá trình “bắt” HPA sẽ hiệu quả hơn so với các loại ion khác như Na+, K+. Trong quá trình thử hoạt tính xúc tác, kết quả cho thấy xúc tác có hoạt tính khá tốt. Tuy nhiên, lượng HPA trên vật liệu đã bị giảm khối lượng từ 0,17 g xuống 0,08 g sau năm lần phản ứng. Điều này cho thấy có thể một phần HPA trên bề mặt đã bị mất trong quá trình phản ứng hoặc trong quá trình rửa xúc tác với nước nóng, HPA bị hòa tan. Nghiên cứu này cho thấy zeolite là vật liệu mang HPA hiệu quả nếu có thể “bẫy” được HPA vào trong hệ mao quản.
Wang và cộng sự [50] đã tổng hợp H3PMo12O40 bẫy trong zeolite Y đề nhôm, theo quy trình này, zeolite và các lượng MoO3 khác nhau được trộn lẫn, nghiền đồng nhất thành bột mịn và nung ở 500 oC trong 4 giờ. Lượng H3PO4 mong muốn sau đó được thêm vào và tiến hành nung mẫu ở 95 oC trong 3 giờ. Chất rắn được sử dụng làm xúc tác của phản ứng khử lưu huỳnh trong dibenzothiophene bằng H2O2 trong acetonitrile. Kết quả tốt nhất thu được với mẫu chứa 10% H3PMo12O40 (hiệu suất khử
25
lưu huỳnh là 83,2%) và xúc tác có thể được tái sử dụng ít nhất 3 lần mà không bị mất hoạt tính.
Wei và các cộng sự [51] đề xuất một phương pháp đưa pha hoạt tính acid phosphomolybdat (HPMo) trong zeolite không đề nhôm (non-dealuminated Y zeolite) (với tỉ lệ Si/Al= 2,6). Các proton của zeolite đầu tiên được thay thế bởi các cation Cs+ bằng phản ứng với một lượng mong muốn Cs2CO3 sau đó là quá trình nung. Các polyoxometalat được tổng hợp trực tiếp bằng việc thêm sodium molypdate và acid phosphoric, với pH điều chỉnh đến 2-3 bằng HCl. Xúc tác 30%PMo-CsY thể hiện hoạt tính tốt (độ chuyển hóa 50% và độ chọn lọc 100%) trong phản ứng ester hóa pha lỏng acid axetic với iso-butanol ở điều kiện phản ứng tối ưu. Hơn nữa, hoạt tính xúc tác vẫn giữ được sau năm chu kì phản ứng, cho thấy độ bền vượt trội của xúc tác tổng hợp được.
Chen và cộng sự [52] đã tổng hợp H3PMo12O40 (HPMo) bẫy trong tinh thể nano H-ZSM-5 từ các tiền chất MoO3, H3PO4, HNO3 và kết hợp với Ni (từ muối Ni(NO3)2) và sử dụng hệ xúc tác này trong phản ứng chuyển hóa hydrocarbon n-octane. Kích thước tinh thể zeolite là 18 nm với sự hình thành các hạt 70-100 nm. Kết quả cho thấy, HPMo không phù hợp với kênh mao quản của H-ZSM-5 nhưng được định vị trong hệ mao quản thứ cấp được hình thành bởi các tinh thể nano. Sự có mặt của HPMo và Ni đã cải thiện đáng kể hiệu suất chuyển hóa của n-octane (đạt 90,5% so với 47,1% của xúc tác HZSM-5 tinh thể).
Sulikowski và các cộng sự [53] đã công bố kết quả bẫy acid phosphotungstic (HPW) trong hốc lớn của faujasite Y. Vật liệu bẫy có hoạt tính tăng đáng kể trong phản ứng bất đối hóa toluene và trimethylbenzene (độ chuyển hóa từ 8% tới 31% và độ chọn lọc từ 5% tới 50%) so với faujasite ban đầu.
Một nghiên cứu khác [54] cũng thực hiện nghiên cứu “bẫy” HPA trong mao quản hốc lớn của zeolite Y sử dụng phương pháp dùng lò vi sóng. Vật liệu tổng hợp có độ acid cao hơn zeolite ban đầu và có số tâm acid Bronsted tăng cao. Hàm lượng HPA được hình thành đạt khoảng 5,6% khối lượng so với zeolite Y. Kết quả này cho thấy hàm lượng HPA được cố định trên zeolite Y chưa cao so với các dạng chất mang khác như SBA-15 (hàm lượng HPA có thể lên tới 40-60% khối lượng). Mặc dù vậy,
26
vật liệu này đã cho hoạt tính xúc tác cao hơn so với zeolite và HPW trong phản ứng tổng hợp 4,4´-dimethyldiphenylmetan từ toluene và formaldehyde.
Như vậy, khi các polyoxometalate được tổng hợp trong sự có mặt của zeolite, việc bẫy HPA chỉ xảy ra trong zeolite faujasite. Với tất cả các loại zeolite khác, HPA chỉ có thể gắn ở ngoài tinh thể. Ảnh hưởng của tỉ lệ Si/Al rất quan trọng, vì sự bẫy HPA dường như chỉ xảy ra với các mẫu zeolite đã được đề nhôm. Một yếu tố nữa ảnh hưởng đến khả năng gắn HPA là sự có mặt của các cation trong zeolite. Vì các ion amoni và cesi có thể tạo thành các muối Keggin polyoxo kim loại nên được ưu tiên sử dụng trong việc chế tạo xúc tác có thể tái sử dụng trong dung môi phân cực. Tuy nhiên, các zeolite đã đề nhôm có chứa các mao quản nhỏ nơi mà các polyoxo kim loại có thể gắn vào trong và rất khó để xác định liệu việc tổng hợp dẫn đến các ion Keggin được gắn hoàn toàn bên trong các supercage hay chỉ có thể gắn trong các mao quản trung bình.
1.2.3. Một số vật liệu mao quản trung bình làm chất mang acid HPA
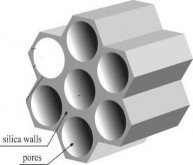
Có nhiều vật liệu được sử dụng để làm chất mang acid HPA như là các vật liệu oxide kim loại TiO2, SiO2, ZrO2, Al2O3, vật liệu có cấu trúc mao quản như zeolite, các loại khoáng sét tự nhiên, vật liệu MQTB,... Việc cố định lên các chất mang oxide kim loại có thể gây ra một vài sự thay đổi về tính chất oxy hóa khử và độ mạnh acid, hoặc trong một vài trường hợp có thể gây ra sự phân hủy HPA [55]. Chất mang tốt nhất dường như là SiO2 vì nó không làm biến đổi tính chất của các đa acid. Hơn nữa, trên bề mặt chất mang SiO2 có chứa các nhóm chức, do vậy có khả năng hình thành liên kết với HPA. Trong số đó, vật liệu mao quản trung bình SBA-15 được nghiên cứu và sử dụng rộng rãi hơn cả.
1.2.3.1. Vật liệu Al-SBA-15
Vật liệu mao quản trung bình SBA-15 được Stucky và cộng sự [56] công bố năm 1998. Đây là vật liệu rây phân tử mao quản trung bình có đối xứng lục lăng với độ trật tự cao, kích thước mao quản rộng và đồng đều (có thể đạt 300 Å), thành mao quản đều và dày (31– 64 Å). Do đó, SBA-15 có độ bền nhiệt và thủy phân cao hơn so với vật liệu thuộc họ M41S [57]. Với diện tích bề mặt riêng lớn (600 – 1000 m2/g), SBA-15 là một loại vật liệu phù hợp cho nhiều ứng dụng khác nhau. Nó có thể được dùng làm chất hấp phụ và tách loại trong phân tích môi trường, vật liệu quang tiên
27
tiến [58- 61]. Vật liệu này được tổng hợp bằng cách sử dụng chất định hướng cấu trúc (ĐHCT) là các chất hoạt động bề mặt copolyme Pluronic (P123) trong môi trường acid. So với MCM-41, vật liệu SBA-15 có diện tích bề mặt riêng lớn, cấu trúc mao quản xốp và đồng đều, thành mao quản dày, độ bền thủy nhiệt cao nên rất thích hợp làm chất mang HPA. Cơ chế tổng hợp vật liệu MQTB SBA-15 được thể hiện ở Hình 1.13.
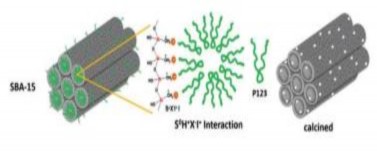
Hình 1.13. Cấu trúc của SBA-15 và cơ chế tạo thành SBA-15 [62].
Vật liệu mao quản trung bình SiO2 nguyên chất chỉ có các nhóm silanol trên bề mặt, có tính acid yếu và không có hoạt tính xúc tác. Vì vậy, để làm cho các vật liệu này có thể ứng dụng trong lĩnh vực xúc tác, các tâm acid mạnh hơn đã được đưa vào mạng cấu trúc của chúng. Thông thường, sự thay thế của các nguyên tử khác với hóa trị thấp hơn hóa trị của silic tạo ra điện tích âm trong mạng lưới, điện tích này có thể được trung hòa bởi proton, do đó tạo ra tính acid cho vật liệu. Có nhiều kim loại được sử dụng để đưa vào mạng cấu trúc của vật liệu MQTB để thay thế đồng Hình cho Si như Fe, Co, Ti,… nhưng Al là kim loại được quan tâm nhiều nhất theo quan điểm về việc tạo ra tính acid. Bằng sự thay thế của Al trong cấu trúc silica tạo ra các tâm acid Bronsted và các tâm acid này tham gia vào nhiều phản ứng quan trọng trong công nghiệp [63- 65]. Có hai phương pháp đã được phát triển để kết hợp các nguyên tử Al vào trong mạng cấu trúc của các vật liệu MQTB là phương pháp tổng hợp trực tiếp [66- 68] và phương pháp "tổng hợp sau" (post-synthesis) [69- 70]. Phương pháp tổng hợp trực tiếp khó thực hiện do sự phân ly của liên kết kim loại Me-O-Si trong môi trường acid cũng như sự khác biệt lớn trong tốc độ thủy phân giữa silicon alkoxide và aluminium alkoxide, do đó việc tổng hợp trực tiếp các vật liệu SBA-15 được thế Al trong mạng theo phương pháp thủy nhiệt thông thường là rất khó khăn.


![Vị Trí Của Polyoxometalate Keggin Trên Bề Mặt Zeolite Y [20].](https://tailieuthamkhao.com/uploads/2022/10/20/nghien-cuu-tong-hop-xuc-tac-di-the-sieu-acid-co-dinh-tren-cac-chat-mang-4-1-120x90.jpg)


