phần lớn, cấu trúc phân tử đặc biệt, tính acid Bronsted mạnh, tính oxy hóa khử phù hợp, độ bền nhiệt lớn với khả năng bay hơi thấp và độ bền ăn mòn thấp của các hợp chất HPA rất phù hợp cho các ứng dụng công nghệ xanh. Dựa vào các tính chất này, việc tổng hợp, đặc trưng và ứng dụng của các xúc tác mới trên cơ sở HPA là lĩnh vực được đặc biệt quan tâm và phát triển. Mặc dù các xúc tác đồng thể HPA có hiệu quả rất đáng kể nhưng chúng có chung nhược điểm là rất khó tách và tái sử dụng. Vì lí do này, các ứng dụng của HPA yêu cầu phải tách và thu hồi tái sử dụng lại xúc tác. Trong những năm vừa qua, rất nhiều nhóm nghiên cứu đã tập trung thay thế các xúc tác HPA đồng thể thành các xúc tác dị thể để có thể dễ dàng tách ra khỏi hỗn hợp phản ứng, giảm thiểu tối đa lượng thải ra môi trường, do đó làm tăng khả năng ứng dụng của loại hợp chất này.
1.1.2. Cấu trúc của các acid dị đa
1.1.2.1. Cấu trúc phân tử acid dị đa
Do khả năng kết hợp giữa các phối tử kim loại và các dị tố khác nhau nên có rất nhiều loại acid dị đa. Các acid dị đa có thể tồn tại ở dạng cấu trúc khác nhau như Keggin, Dawson, Anderson,… Hai trong số các nhóm được biết đến nhiều nhất là các acid dị đa trên cơ sở cấu trúc Keggin (HnXM12O40) và các acid dị đa trên cơ sở cấu trúc Wells- Dawson (HnX2M18O62).
Hình 1.1. Cấu trúc Keggin và cấu trúc Dawson [2].
1.1.2.2. Cấu trúc Keggin
Cấu trúc Keggin được nghiên cứu nhiều vì cấu trúc này được đánh giá có tính acid mạnh và độ ổn định cao hơn cả. Các anion dị đa cấu trúc Keggin có công thức (Xn+M12O40(8-n)), trong đó X là nguyên tử trung tâm (Si4+, Ge4+, Si4+, P5+, As4+,…), n
là số oxy hóa của nguyên tử X. M là Mo hoặc W, kim loại này có thể bị thay thế một phần bởi một số kim loại khác. Ví dụ các acid Keggin H3PW12O40, H3PMo12O40, H4SiW12O40,… [3].
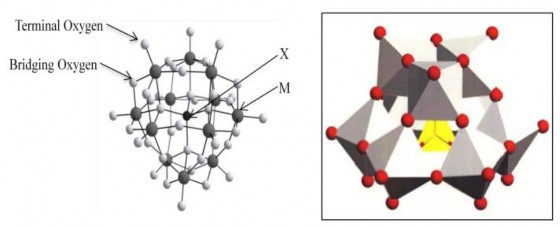
Hình 1.2. Cấu trúc Keggin anion Xn+M12O40(8-n) [3].
Cấu trúc này được phát minh đầu tiên bởi J.F Keggin vào năm 1933. Cấu trúc Keggin bao gồm một trung tâm tứ diện XO4 được bao quanh bởi 12 bát diện MO6. 12 bát diện MO6 được chia thành bốn nhóm chính, mỗi nhóm gồm ba bát diện như trên Hình 1.2. Sự sắp xếp cấu trúc này dẫn đến sự hình thành một polyanion dạng cầu.
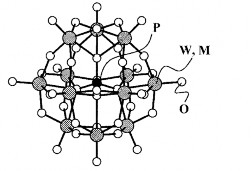
Hình 1.3. Cấu trúc Keggin của anion (PW12O40)3-.
Các cấu trúc cơ bản liên kết với nhau tạo ra các cấu trúc thứ cấp. Trong cấu trúc thứ cấp, các liên kết hydro kết nối với các cation dihydronium (như H5O2+) với các nguyên tử oxy đầu cuối của bốn anion Keggin (Hình 1.4). Có nhiều cấu trúc thứ cấp của acid dị đa kiểu Keggin khác nhau. Các mạng tinh thể lập phương tâm khối thường gặp như H3PW12O40.6H2O, mạng lập phương tâm mặt như
H3PW12O40.29H2O. Các loại mạng khác được tạo ra từ các anion Keggin phụ thuộc cả vào số lượng các phân tử hydrat hóa và điện tích anion.
Hình 1.4. Cấu trúc thứ cấp của H3PW12O40.6H2O [4].
1.1.2.3. Cấu trúc Wells-Dawson
Các anion dị đa cấu trúc Wells-Dawson thường có công thức chung là [(Xn+)2M18O62] (2n-16) trong đó Xn+ là P5+ hoặc As5+, M là Mo6+ hoặc W6+, liên kết với oxy tạo ra các đơn vị bát diện MO6. Cấu trúc, được gọi là đồng phân isomer, có hai “nửa đơn vị" giống hệt nhau của nguyên tử trung tâm được bao quanh bởi 9 đơn vị bát diện XM9O31 được liên kết qua nguyên tử oxy (Hình 1.5) [5].
Hình 1.5. Cấu trúc Wells-Dawson của anion P2W18O626-.
Các acid dị đa cấu trúc Wells-Dawson như là acid phospho-tungstic H6P2W18O62, phospho-molybdic H6P2Mo18O62, arsenicmolybdic H6As2Mo18O62 có tính chất siêu acid và độ ổn định đáng kể cả trong dung dịch và trong trạng thái rắn.
1.1.3. Tính chất của các acid dị đa
1.1.3.1. Tính chất acid
Các tính chất acid - bazơ của các hợp chất dị đa có thể được thay đổi bằng cách lựa chọn dị tố trong cấu trúc sơ cấp và cation. Các acid dị đa đều là những acid mạnh (siêu acid) và mạnh hơn rất nhiều so với các acid rắn truyền thống như SiO2-Al2O3, H3PO4/SiO2, zeolit HX và HY và các acid như H2SO4, HCl, acid p-sulfonic toluene,… Các dị đa này có tính acid mạnh là do có sự di chuyển mật độ điện tích trên toàn bề mặt của polyanion có kích thước lớn, dẫn đến hình thành lực tương tác yếu giữa các proton và anion [3, 6].
Lực acid có thể được mô tả theo hàm acid Hammett Ho: Ho = pKBH+ - log ([BH+]/[B])
Trong đó: [B] là nồng độ của bazơ B, [BH+] là nồng độ của acid liên hợp, KBH+ là hằng số cân bằng của phản ứng: BH+ ↔ B + H+.
Tỷ lệ [BH+]/[B] có thể được xác định bằng phương pháp so sánh màu và xác định các điểm chuẩn trong phương pháp chuẩn độ.
Trong thực tế, H2SO4 100% được biết đến như một chất có tính acid mạnh với lực acid Ho= -11,94. Do đó, để đánh giá lực acid của một chất nào đó, giá trị Ho của H2SO4 100% được xem như là một mốc giá trị đối chứng. Các acid có giá trị thấp hơn
-12 được xếp vào loại siêu acid. Giá trị hàm Hammett của một số acid rắn được trình bày trong Bảng 1.1 [6].
Bảng 1.1. Giá trị Ho của một số chất acid rắn.
Hợp chất | Lực acid Ho | |
1 | H2SO4 | -11.94 |
2 | Nafion | -12,0 |
3 | H3PW12O40 | -13,2 |
4 | AlCl3-CuCl2 | -13,7 |
5 | SbF5/SiO2-Al2O3 | -13,7 |
6 | SO42-/TiO2 | -14,5 |
7 | SO42-/ZrO2 | -16,1 |
Có thể bạn quan tâm!
-
 Nghiên cứu tổng hợp xúc tác dị thể siêu acid cố định trên các chất mang Al-SBA-15 và ZSM-5/SBA-15 ứng dụng trong phản ứng tổng hợp fructone - 1
Nghiên cứu tổng hợp xúc tác dị thể siêu acid cố định trên các chất mang Al-SBA-15 và ZSM-5/SBA-15 ứng dụng trong phản ứng tổng hợp fructone - 1 -
 Nghiên cứu tổng hợp xúc tác dị thể siêu acid cố định trên các chất mang Al-SBA-15 và ZSM-5/SBA-15 ứng dụng trong phản ứng tổng hợp fructone - 2
Nghiên cứu tổng hợp xúc tác dị thể siêu acid cố định trên các chất mang Al-SBA-15 và ZSM-5/SBA-15 ứng dụng trong phản ứng tổng hợp fructone - 2 -
![Vị Trí Của Polyoxometalate Keggin Trên Bề Mặt Zeolite Y [20].](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Vị Trí Của Polyoxometalate Keggin Trên Bề Mặt Zeolite Y [20].
Vị Trí Của Polyoxometalate Keggin Trên Bề Mặt Zeolite Y [20]. -
 Phương Pháp Cố Định Muối Của Hpa Trên Bề Mặt Chất Mang
Phương Pháp Cố Định Muối Của Hpa Trên Bề Mặt Chất Mang -
 Ứng Dụng Của Xúc Tác Acid Dị Đa Trong Phản Ứng Chuyển Hóa Hợp Chất Hữu Cơ
Ứng Dụng Của Xúc Tác Acid Dị Đa Trong Phản Ứng Chuyển Hóa Hợp Chất Hữu Cơ
Xem toàn bộ 144 trang tài liệu này.
1.1.3.2. Tính oxy hóa khử
Trong dung dịch, các acid dị đa có khả năng trao đổi electron do các nguyên tử kim loại có trạng thái oxy hóa cao. Thế khử của các hợp chất acid dị đa có chứa Mo và V thường cao hơn các hợp chất dị đa khác, bởi vì các ion này có tính oxy hóa mạnh. Khả năng oxy hóa thường giảm theo thứ tự: V > Mo > W, trong đó V là nguyên tố có tính oxy hóa mạnh nhất nên các hợp chất dị đa chứa V rất dễ bị khử. Ngoài ra bản chất của dị tố làm thay đổi điện tích tổng của polyanion nên cũng ảnh hưởng rất lớn đến tính oxy hóa khử của các hợp chất acid dị đa. Chẳng hạn, sự tăng điện tích dẫn đến giảm khả năng oxy hóa của cặp oxy hóa khử W6+ /W5+ trong các hợp chất theo thứ tự sau: PVW12O403- > SiIVW12O404- ≈ GeIVW12O404- > BIIIW12O405- ≈ FeIIIW12O405- > H2W12O406- ≈ CoW12O406- > CuIW12O407-.
Ngoài ra, các cation đối cũng gây ra tác động đáng kể đến khả năng oxy hóa khử của acid dị đa. Khi ion dương càng dễ bị khử thì acid dị đa cũng dễ bị khử và ngược lại. Khi cation không bị khử, như cation kim loại kiềm, khả năng khử của kim loại trong cấu trúc cơ bản, do vậy bị ảnh hưởng bởi bản chất của cation. Khả năng oxy hóa được đánh giá qua tốc độ khử của hợp chất dị đa bằng việc sử dụng các tác nhân H2, CO và hợp chất hữu cơ, nhưng đôi khi các dữ kiện xuất hiện không đồng nhất, do sự khác nhau về loại chất khử, độ không đồng nhất, sự phân hủy của xúc tác [7, 8].
1.1.3.3. Tính ổn định nhiệt
Tính ổn định nhiệt của các acid dị đa thường khá cao và tính ổn định thay đổi phụ thuộc rất nhiều vào loại acid dị đa [9]. Tính chất này thay đổi theo cấu trúc của các hợp phần tạo nên chúng, chẳng hạn như:
H3PW12O40 > H4SiW12O40 > H3PMo12O40 > H4SiMo12O40
Ở nhiệt độ trên 400 oC, sự phân hủy cấu trúc Keggin là nguyên nhân làm giảm tính acid, phản ứng phân hủy như sau: H3PW12O40 → 1/2P2O5 + 12 WO3 + 3/2 H2O Ngoài ra, tính ổn định nhiệt của các acid dị đa còn phụ thuộc vào môi trường
tiếp xúc. Trong môi trường tiếp xúc có mặt hơi nước và oxy sẽ làm tăng tính ổn định
nhiệt của các hợp chất acid dị đa. Ngược lại, nếu các hợp chất acid dị đa tiếp xúc với môi trường có tính chất khử thì tính ổn định nhiệt giảm đáng kể [3].
1.1.3.4. Khả năng hòa tan trong nước
Thông thường, các hợp chất acid dị đa là những chất rắn dễ hòa tan trong nước, các dung môi hữu cơ chứa oxy như ethanol, ether,… và tan hạn chế trong các dung môi không nước. Đặc biệt các acid dị đa hoàn toàn không tan trong các dung môi như benzen, ether dầu và cloroform. Đối với các muối của các hợp chất acid dị đa, tính tan phụ thuộc vào bản chất của ion kim loại. Có thể phân thành hai nhóm chính: Nhóm thứ nhất bao gồm các muối của các ion kim loại có kích thước nhỏ như: Na+, Cu2+, Li+,… Đây là các muối dễ tan trong nước và các dung môi phân cực. Cấu trúc của các muối này có nhiều nét tương đồng với các acid dị đa. Nhóm thứ hai là muối của các ion có kích thước lớn gồm: K+, Rb+, Cs+,… Các muối này khó hòa tan trong nước và các dung môi phân cực nên có thể được áp dụng làm chất xúc tác acid rắn cho một số quá trình hóa học. Muối của các cation hữu cơ như tetrabutylammonium không tan trong nước nhưng tan trong dung môi hữu cơ nên thường được sử dụng cho việc tách các POM cũng như tách xúc tác trong môi trường hữu cơ [3].
1.1.3.5. Diện tích bề mặt và cấu trúc lỗ xốp
Diện tích bề mặt và cấu trúc lỗ xốp của các hợp chất acid dị đa phụ thuộc rất nhiều vào các hợp phần tạo nên chúng. Các polyoxometalate thường có diện tích bề mặt thấp phản ánh độ tan cao trong nước. Các mao quản của hợp chất polyoxometalate là các liên kết hạt, không phải là liên kết trong tinh thể. Đối với các muối của các kim loại có kích thước nhỏ (các kim loại nhóm A hoặc H) như Na, Mg, Cu,.. có diện tích bề mặt thấp (1 - 15 m2/g). Trong khi đó, diện tích bề mặt riêng của các muối nhóm B như Cs+, Ag+, K+, NH4+,.. thường cao hơn nhiều (khoảng 50-200 m2/g). Khi thay thế một phần H+ bởi các nguyên tử có kích thước lớn như Cs+ hay NH4+, cấu trúc vi mao quản của hợp chất dị đa acid được tăng lên (> 0,59 nm) và có thể được kiểm soát thông qua việc điều chỉnh tỉ lệ trao đổi ion. Do đó, bản chất của ion dương trong các hợp chất dị đa có ảnh hưởng rất lớn đến diện tích bề mặt riêng cũng như tính chất xốp của vật liệu [9]. Ngoài ra, diện tích bề mặt riêng của các hợp chất acid dị đa còn phụ thuộc nhiều vào kích thước các hạt sơ cấp, tỉ lệ trao đổi ion, quá trình kết tủa và giai đoạn sấy xúc tác.
1.1.3.6. Tính chất xúc tác
Chức năng xúc tác của các hợp chất acid dị đa đã thu hút được nhiều sự quan tâm trong thời gian qua. Do tính chất đặc biệt nên các acid dị đa được sử dụng như xúc tác đồng thể, dị thể và oxy hóa khử. Các hợp chất này được coi là hệ xúc tác “mô hình” để nghiên cứu cơ bản các vấn đề về xúc tác. Theo quan điểm về tính acid đã chỉ ra rằng, các hợp chất acid dị đa có tính acid mạnh hơn nhiều so với phần lớn các loại xúc tác acid thông thường khác. Trong dung dịch, các acid dị đa như H3PW12O40, H4SiW12O40 và H3PMo12O40 bị phân ly hoàn toàn, hằng số phân ly của các acid dị đa trong acid acetic được trình bày trong Bảng 1.2 [10].
Bảng 1.2. Hằng số phân ly của các acid HPA trong acid acetic (ở 25 oC).
pKi | |
H3PW12O40 | 4,7 |
H4SiW12O40 | 4,87 |
H3PMo12O40 | 4,68 |
H4SiMo12O40 | 2,10 |
HBr | 5,6 |
H2SO4 | 7,00 |
HCl | 8,40 |
Với pK1 = -logKi, Ki là hằng số phân ly acid.
Các acid dị đa có độ acid mạnh nên thường được ứng dụng cho nhiều phản ứng khác nhau như phản ứng đề hydro hóa alcohol, ester hóa, alkyl hóa, isomer hóa,... Tuy nhiên, các hợp chất acid này hòa tan rất tốt trong các dung môi phân cực như nước, ethanol, ... nên chúng trở thành các xúc tác đồng thể. Xúc tác hòa tan trong môi trường phản ứng sẽ gây khó khăn trong việc thu hồi xúc tác, tách và tinh chế sản phẩm. Do đó, để tận dụng được những ưu điểm của các hợp chất acid dị đa cần thiết phải dị thể hóa xúc tác.
1.2. Tổng quan về các phương pháp dị thể hóa acid dị đa trên chất mang
1.2.1. Giới thiệu chung về quá trình dị thể hóa HPA
Việc phát triển các chiến lược mới về tái sinh xúc tác là một nhiệm vụ quan trọng về kinh tế và môi trường của ngành công nghiệp hóa chất và dược phẩm. Mặc
dù các hợp chất dị đa được sử dụng như xúc tác dị thể trong môi trường không phân cực, nhưng do độ tan cao trong nhiều dung môi phân cực đã làm cho các hợp chất này trở thành xúc tác đồng thể. Vì vậy, việc dị thể hóa các xúc tác này là cần thiết trong lĩnh vực công nghệ. Hơn nữa, việc tăng số lượng các tâm hoạt động trên bề mặt cũng là một mục tiêu cần chú ý trong việc dị thể hóa các xúc tác HPA. Mặc dù HPA là các xúc tác đồng thể, lượng tâm hoạt động trên bề mặt nhỏ vì diện tích bề mặt thấp. Do các ion HPA dễ bị cụm vào nhau nên các pha hoạt động nằm sâu bên trong ko có hoạt tính do ko tiếp xúc với chất phản ứng. Khi đó, các phân tử chất phản ứng không phân cực không thể khuếch tán vào pha hoạt động của HPA mà chỉ hấp phụ trên bề mặt ngoài, làm giảm đáng kể hiệu quả của phản ứng. Cơ chế này gọi là “xúc tác bề mặt”, nơi các phản ứng diễn ra trong không gian hai chiều (bề mặt ngoài và thành mao quản) của xúc tác rắn và tốc độ phản ứng tỉ lệ với diện tích bề mặt. Do đó, trong nhiều ứng dụng xúc tác dị thể, việc gắn HPA lên trên các bề mặt chất mang là mục tiêu được hướng tới.
Có thể dị thể hóa các acid dị đa bằng việc phân tán HPA lên trên các chất mang không tan khác nhau. Những xúc tác này có thể được thu hồi đơn giản bằng cách lọc hoặc ly tâm. Tuy nhiên, trong một vài trường hợp, tương tác yếu giữa HPA với các chất mang dẫn đến việc HPA bị rửa trôi ra khỏi bề mặt chất mang trong môi trường phản ứng phân cực. Để giải quyết vấn đề này, các phương pháp khác nhau, như là bao gói (encapsulation), ghép (grafting), kết nối (tethering), đã được nghiên cứu. Việc dùng những phương pháp này sẽ hạn chế sự rửa trôi HPA ra khỏi bề mặt chất mang nhưng đồng thời độ hoạt động thấp cũng như độ chọn lọc kém hơn so với xúc tác đồng thể do yếu tố phân tán và không gian.
1.2.2. Các phương pháp dị thể hóa acid HPA trên các chất mang
Hiện nay, hướng nghiên cứu gắn HPA lên các chất mang khác nhau đang được quan tâm vì có các ưu điểm vượt trội như tăng bề mặt tiếp xúc của xúc tác (HPA/ chất mang) với nguyên liệu ban đầu trong các phản ứng sử dụng môi trường phân cực, có khả năng tách sản phẩm, thu hồi và tái sinh xúc tác đơn giản. Với hướng nghiên cứu này, họ vật liệu silic oxide mao quản trung bình (MQTB) với thành phần là SiO2 như MCM-41 và SBA-15 được sử dụng nhằm phân tán và cố định HPA theo



![Vị Trí Của Polyoxometalate Keggin Trên Bề Mặt Zeolite Y [20].](https://tailieuthamkhao.com/uploads/2022/10/20/nghien-cuu-tong-hop-xuc-tac-di-the-sieu-acid-co-dinh-tren-cac-chat-mang-4-1-120x90.jpg)

