dung dịch điện giải và giải phóng các ion khác thay thế tương tự với một lượng tương đương về hóa học. Trong quá trình này, bất kỳ thay đổi cấu trúc của nhựa sẽ xảy ra [111]. Thu hồi các kim loại nặng có giá trị từ nước thải vô cơ cũng có thể được thực hiện bằng trao đổi ion [38]. Kim loại được thu hồi ở dạng cô đặc hơn bằng cách rửa sử dụng các tác nhân thích hợp, sau khi tách nhựa đã "no".
Phương pháp trao đổi ion có một vị trí rất đặc biệt trong xử lý nước thải và xử lý kim loại nặng. Khi cột trao đổi ion có chất trao đổi cation axit mạnh được sử dụng, các kim loại nặng có thể được loại bỏ hiệu quả. Nó thường được ưa thích hơn so với các phương pháp khác như kết tủa hóa học do hiệu quả cao, lượng bùn thải ít, thu hồi các kim loại giá trị và tính chọn lọc cao. Tuy nhiên nó có nhược điểm là giá thành cao và quá trình sử dụng phức tạp.
1.2.3.4. Phương pháp hấp phụ
Một phương pháp hóa lý khác để loại bỏ kim loại nặng từ nước thải là phương pháp hấp phụ, phương pháp này đã thành công trong việc giảm nồng độ kim loại. Sự hấp phụ dựa trên sự chuyển khối giữa pha lỏng và pha rắn được gọi là chất hấp phụ [68]. Quá trình hấp phụ chất gây ô nhiễm, có ba giai đoạn chính: (i) sự xâm nhập của chất gây ô nhiễm từ dung dịch số lượng lớn đến bề mặt hấp phụ; (ii) hấp phụ chất gây ô nhiễm trên bề mặt hấp phụ; và (iii) các chất ô nhiễm thâm nhập vào bên trong cấu trúc hấp phụ.
Những chất hấp phụ này cung cấp diện tích bề mặt lớn và dung lượng hấp phụ cao. Ưu điểm là tiến trình có thể hoạt động được ở chế độ đảo ngược và các chất hấp phụ sẽ được tái sinh bằng sự giải phóng. Các chất hấp phụ có thể được lấy từ chất thải nông nghiệp, phụ phẩm công nghiệp hoặc các vật liệu tự nhiên. Một số trong số nhiều các chất hấp phụ được sử dụng trong quá trình này là than hoạt tính (AC), ống nano cacbon (CNT) và mùn cưa.
Than hoạt tính (AC) thường được tổng hợp từ các sản phẩm phụ của nông nghiệp khi sử dụng K2CO3. Bề mặt tối đa của nó diện tích nằm trong khoảng 1266-3256 m2/g [110]. Hấp phụ bằng than hoạt tính được sử dụng rộng rãi để loại bỏ kim loại độc hại và đã được nghiên cứu rộng rãi [17].
Vật liệu ống nano cacbon (CNT) nổi tiếng với những tính chất và ứng dụng tuyệt vời của chúng. Kim loại nặng hấp phụ trên để CNTs bởi một cơ chế phức hợp [58]. Khi so sánh với than hoạt tính, CNTs có dung lượng hấp phụ cao hơn vì diện tích bề mặt của nó lớn hơn.
Vật liệu hấp phụ từ các phụ phẩm nông nghiệp là các vật liệu hấp phụ rẻ tiền có nguồn gốc từ các sản phẩm phụ của quá trình nông nghiệp. Hiện nay, nó đang thu được nhiều sự quan tâm lớn của các nhà nghiên cứu, đặc biệt là các quá trình xử lý kim loại nặng trong môi trường nước [96], [131], [120]. Loại vật liệu này có nhiều ưu điểm như thân thiện môi trường, giá thành rẻ, hiệu quả cao, khả năng thu hồi kim loại nặng và tái sử dụng vật liệu khi so sánh với các kỹ thuật hấp phụ khác. Thông thường, việc sử dụng phụ phẩm nông nghiệp được yêu thích bởi vì chúng chứa 3 thành phần cấu trúc chính bao gồm hemi xenlulo, xenlulo và lignhin.
Có thể bạn quan tâm!
-
 Vật Liệu Tổ Hợp Trên Cơ Sở Tio2 Và Graphen
Vật Liệu Tổ Hợp Trên Cơ Sở Tio2 Và Graphen -
 Ô Nhiễm Kim Loại Nặng Trong Nước Thải Sản Xuất Vật Liệu Nổ.
Ô Nhiễm Kim Loại Nặng Trong Nước Thải Sản Xuất Vật Liệu Nổ. -
 Nghiên cứu tổng hợp vật liệu TiO2- Fe2O3/GNP từ quặng ilmenit và graphit định hướng chuyển hóa Cr(VI) trong nước thải công nghiệp quốc phòng - 6
Nghiên cứu tổng hợp vật liệu TiO2- Fe2O3/GNP từ quặng ilmenit và graphit định hướng chuyển hóa Cr(VI) trong nước thải công nghiệp quốc phòng - 6 -
 Nghiên cứu tổng hợp vật liệu TiO2- Fe2O3/GNP từ quặng ilmenit và graphit định hướng chuyển hóa Cr(VI) trong nước thải công nghiệp quốc phòng - 8
Nghiên cứu tổng hợp vật liệu TiO2- Fe2O3/GNP từ quặng ilmenit và graphit định hướng chuyển hóa Cr(VI) trong nước thải công nghiệp quốc phòng - 8 -
 Quy Trình Kỹ Thuật Tổng Hợp Vật Liệu Gnp Từ Graphit Tự Nhiên
Quy Trình Kỹ Thuật Tổng Hợp Vật Liệu Gnp Từ Graphit Tự Nhiên -
 Xác Định Đặc Trưng Bề Mặt, Đặc Trưng Nhiệt Của Vật Liệu
Xác Định Đặc Trưng Bề Mặt, Đặc Trưng Nhiệt Của Vật Liệu
Xem toàn bộ 173 trang tài liệu này.
Mùn cưa gỗ - chất thải rắn thu được từ quá trình chế biến gỗ cơ khí- có thể được sử dụng như một chất hấp phụ kim loại nặng với chi phí thấp, chủ yếu do thành phần lingocellulosic của nó. Mùn cưa gỗ chủ yếu gồm xenlulo (45-50%) và lignin (23-30%), cả hai đều có khả năng gắn các cation kim loại do các nhóm hydroxyl, cacboxylic và phenol có mặt trong cấu trúc của chúng [100]. Sự quan tâm đến việc sử dụng phụ phẩm nông nghiệp chẳng hạn như len thải, chất thải hạt, vỏ cây, bông biến tính, và mùn cưa để loại bỏ các kim loại nặng trong dung dịch bằng trong thời gian gần đây tăng lên [129].
Đất sét có nhiều ưu điểm như khả năng trao đổi cation cao, diện tích bề mặt lớn, độ ổn định hóa học và cơ học cao và cấu trúc lớp do đó đất sét có hiệu quả hấp phụ cao đối với kim loại nặng. Vì những ưu điểm này, một số lượng lớn các nhà nghiên cứu đã sử dụng đất sét để hấp phụ một số chất ô nhiễm đặc biệt là các ion kim loại nặng trong môi trường nước[98].
Orhan và Kocaoba [93] đã sử dụng zeolit tự nhiên và zeolit biến tính (bằng HNO3 hoặc NaOH) để xử lý một số kim loại nặng, bao gồm Cr và Pb trong môi trường nước. Zeolit biến tính đã cải thiện đáng kể khả năng hấp phụ kim loại
nặng. Ince [59] đã nghiên cứu hiệu suất hấp phụ Ni (II) trong môi trường nước của đất sét trong điều kiện tối ưu. Dung lượng hấp phụ của đất sét là 19,4 mg/g. Các oxit kim loại nano như Fe2O3, TiO2, MnO2 và-Al2O3 là các chất hấp phụ thân thiện môi trường và có hoạt tính hấp phụ kim loại nặng trong môi trường nước cao vì ái lực riêng và diện tích bề mặt lớn. Ngoài ra các oxit kim loại ở kích thước nano cũng chứng tỏ khả năng hấp phụ đặc biệt cao do các vị trí hấp phụ cư trú chủ yếu trên bề mặt [56]. MnO2, ZnO, ɣ-Fe2O3, TiO2,-AlOOH và -Al2O3 … đã được sử dụng oxit kim loại như chất hấp phụ riêng lẻ hoặc sử
dụng ở dạng tổ hợp với nhiều loại chất nền khác nhau.
1.2.3.5. Phương pháp lọc màng
Sự phát triển của phương pháp lọc màng rất nhanh từ năm 1979 đến 1980 [102]. Những quy trình này được phát triển và được sử dụng do hiệu quả loại bỏ cao hơn, không tạo ra tải lượng ô nhiễm và đôi khi giảm tiêu thụ năng lượng hơn so với các phương pháp thông thường [84]. Những ưu điểm này giúp quá trình lọc màng có phạm vi ứng dụng lớn bao gồm công nghiệp thực phẩm và nước giải khát, công nghệ sinh học, lọc nước và xử lý nước thải chứa kim loại nặng [103]. Các quá trình màng được sử dụng trong xử lý nước và nước thải bởi vì phương pháp tách đơn giản [94].
Có nhiều thông số khác nhau có thể ảnh hưởng đến hiệu suất màng, trong đó quan trọng nhất là vật liệu đang sử dụng, kích thước lỗ màng và thành phần. Những thông số này dẫn đến hiệu suất cao và quá trình phân tách có tính kinh tế [67]. Vật liệu nên được lựa chọn theo cách giúp cho quá trình sản xuất của màng với đặc tính kháng hóa chất và độ khuyết tật trong cấu trúc. Nhiều loại vật liệu khác nhau được sử dụng trong chế tạo màng như kim loại, gốm, và vật liệu composite [41], [ 67].
Công nghệ lọc màng bao gồm 5 phương pháp xử lý chính bao gồm thẩm thấu ngược (RO), siêu lọc (UF), vi lọc (MF), lọc nano (NF) và thẩm phân điện (ED). Các quy trình này về cơ bản giống nhau, nhưng có một số sự khác biệt
trong cấu trúc lỗ xốp (kích thước lỗ, phân bố kích thước lỗ xốp và độ rỗng), độ thấm màng và áp suất vận hành được thiết lập [87].
Màng MF và UF là các loại màng xốp có thể hoạt động ở áp suất thấp [106], [ 41]. Kích thước lỗ xốp của màng MF điển hình nằm trong khoảng từ 0,05 đến 10 micro mét và áp suất trong khoảng từ 0,1 đến 2 bar. Tuy nhiên, màng UF có các lỗ xốp với kích thước trong phạm vi từ 1 đến 100nm và áp suất vận hành khoảng từ 1 đến 5 bar [41]. Màng RO không xốp và hoạt động dưới áp suất vận hành thấp từ khoảng 10 đến 20 bar với màng lỗ rỗng dưới nanomet [41], [ 67]. Màng NF được vận hành ở áp suất giữa 10 đến 20 bar và kích thước lỗ rỗng là 1nm [106].
Phương pháp điện thẩm tách (ED) được phát triển vào những năm 1950 trong các nghiên cứu về quá trình khử muối [86]. ED là một quá trình màng lai hóa chất lỏng mới [99]. Nó được sử dụng trong việc xử lý nước thải từ các ngành công nghiệp khác nhau [23], tách nước sản xuất axit và bazơ từ muối
[86] cũng như chưng cất phân đoạn bao gồm quá trình ổn định rượu vang, khử khoáng sữa [43], vv. Khi chiều phân cực của các điện cực ED bị đảo ngược, quá trình được gọi là quá trình điện thẩm tách ngược chiều (EDR) đôi khi nó tốt hơn ED. EDR làm giảm sự đóng cặn, tắc nghẽn và có tỷ lệ phục hồi cao hơn. Mặt khác EDR cần nhiều hệ thống đường ống nước và điều khiển về điện hơn [23].
1.2.3.6. Phương pháp quang xúc tác
Quá trình oxy hóa nâng cao (AOPs) là một công nghệ mới trong công nghiệp làm sạch không khí và nước [36]. Quang xúc tác là một quá trình oxy hóa nâng cao AOP phổ biến và được sử dụng rộng rãi [47]. Phương pháp này sử dụng các chất bán dẫn không độc hại, có khả năng nhận năng lượng của ánh sáng với bước sóng thích hợp để kích hoạt tạo thành các electron và lỗ trống quang sinh [85]. Do vậy, nó được ưa chuộng hơn phương pháp hóa học vì không sử dụng lượng lớn các chất hóa học độc hại làm tác nhân phản ứng và
quá trình không để lại lượng tồn dư hóa chất lớn phải xử lý [85]. Quá trình xúc tác quang trở nên phổ biến như là một quá trình hiệu quả vì thiết kế đơn giản, chi phí hoạt động thấp, có tính ổn định và hiệu quả xử lý cao [62]. Quá trình này được áp dụng trong nhiều lĩnh vực đang được các nhà nghiên cứu quan tâm bao gồm quá trình phân tách quang học nước để tạo ra khí hydro [51], khử trùng [35], tổng hợp các hợp chất hữu cơ [92], oxy hóa chọn lọc [44] và sản xuất nhiên liệu [21]. Bên cạnh đó, phương pháp còn có những thế mạnh trong việc loại bỏ các chất gây ô nhiễm như kim loại nặng và các chất hữu cơ khó phân hủy [8].
Ứng dụng quá trình quang xúc tác để xử lý kim loại nặng, tác giả Devagi Kanakaraju và cộng sự đã sử dụng vật liệu TiO2/Alg/FeNPs để xử lý cùng lúc ba ion kim loại Cr(III), Cu(II), and Pb(II) với nồng độ ban đầu của các ion là 44 ppm dưới điều kiện chiếu sáng bằng tia cực tím với bước sóng 254 nm. Hiệu suất loại bỏ các ion đạt trên 98,4% sau thời gian 72 phút [64].
Yunguang Yu và cộng sự đã tổng hợp thành công vật liệu tổ hợp CdS/ Cs3PW12O40 bằng phương pháp tự lắp ráp tĩnh điện (electrostatic self-assembly) và ứng dụng vật liệu vào quá trình quang khử Cr(VI) với sự có mặt của EDTA. Kết quả cho thấy, trong điều kiện chiếu sáng bằng nguồn ánh sáng khả kiến (sử dụng đèn xenon 300W với bước sóng lớn hơn 400 nm) vật liệu tổ hợp có khả năng chuyển hóa Cr(VI) là 82% sau 120 phút với nồng độ ban đầu của dung dịch chứa Cr(VI) là 21 mg/L, lượng xúc tác sử dụng là 2 g/L và với hàm lượng EDTA đưa vào là 1 mM [130].
Yao Li và cộng sự đã tổng hợp vật liệu tổ hợp 3D TiO2-graphen hydrogel có cấu trúc mạng không gian 3 chiều. Sự kết hợp giữa chất nền graphen và các hạt nano hình cầu TiO2 đã góp phần nâng cao khả năng di chuyển và phân tách của các điện tử, do đó vật liệu tổ hợp có khả năng chuyển hóa Cr(VI) tốt hơn so với vật liệu TiO2 ban đầu. Hiệu suất chuyển hóa của vật liệu đạt 100% sau thời gian 30 phút chiếu sáng với nồng độ Cr(VI) ban đầu là 5 mg/L [78].
Xue Bai và cộng sự đã tổng hợp vật liệu lai ghép RP-MoS2 /RGO (RP- phốt pho đỏ) thông qua quá trình thủy nhiệt hai bước, vật liệu có những ưu điểm như chi phí thấp, có độ bền hóa học, hiệu suất xử lý cao và ổn định. Vật liệu có khả năng quang xúc tác xử lý đồng thời cả ion Cr(VI) và các chất hữu cơ (RhB, Mb và phenol) với hiệu suất trên 98% sau thời gian 30 phút với nồng độ chất ô nhiễm ban đầu là 50 ppm [25].
Zengping Chen đã biến tính TiO2 bằng Mn và đưa lên trên nền vật liệu RGO bằng phương pháp thủy nhiệt một bước. Vật liệu có hoạt tính xúc quang trong điều kiện chiếu sáng bằng ánh sáng nhìn thấy. Nhóm tác giả đã thử nghiệm hoạt tính xúc tác quang của vật liệu bằng quá trình quang khử Cr(VI) trong các điều kiện chiếu sáng bằng ánh nhìn thấy và ánh sáng mặt trời với nồng độ Cr(VI) ban đầu là 20 ppm, với thời gian và hiệu suất chuyển hóa lần lượt là 30 phút với hiệu suất 97,32 % và 60 phút với hiệu suất 99,02% [34].
Quang xúc tác bao gồm hai vấn đề cơ bản là quang hóa và xúc tác, bởi vì quá trình cần cả photon (ánh sáng) và chất xúc tác (chất bán dẫn) để kích hoạt phản ứng hóa học. Các photon có thể được cung cấp bởi nguồn ánh sáng UV (300-388 nm) hoặc nguồn ánh sáng nhìn thấy (388-520 nm), tùy thuộc vào bản chất loại vật liệu xúc tác quang được sử dụng[20].
Vật liệu xúc tác quang được đặc trưng bởi một vùng hóa trị được điền đầy các electron (VB) và một vùng dẫn trống (CB); electron ở vùng hóa trị VB có thể được kích hoạt bởi một photon với năng lượng bằng hoặc lớn hơn năng lượng vùng cấm (Eg), khoảng năng lượng giữa CB và VB. Khi được kích thích, electron chuyển từ VB sang CB và để lại một điện tích dương trong VB, được gọi là lỗ trống (h+). Hiện tượng này là quá trình tách điện tử, là bước đầu tiên cho phản ứng quang xúc tác.
Các cặp electron - lỗ trống quang sinh sau đó có thể là tham gia vào một số phản ứng như sau:
i) Quá trình tái tổ hợp electron-lỗ trống và quá trình tiêu hao năng lượng đầu vào dưới dạng nhiệt năng;
ii) Quá trình electron và lỗ trống bị giữ lại trong các trạng thái bề mặt không ổn định;
iii) Phản ứng với với các tác nhân cung cấp electron hoặc các tác nhân nhận electron được hấp phụ trên bề mặt chất bán dẫn hoặc bên trong lớp kép mang điện bao quanh các hạt mang điện của các hạt tích điện để khởi đầu cho các quá trình oxy hóa khử [48].
Quá trình xúc tác quang có thể được mô tả như là một hệ “bốn pha” trong đó ngoài pha dung dịch (dung môi nước hoặc dung môi hữu cơ), pha rắn (chất xúc tác quang) và các pha khí (oxy và nitơ), một pha mang điện chính là các hạt mang điện tích được tạo thành khi vật liệu xúc tác tiếp xúc nguồn sáng phù hợp. Một phản ứng xúc tác quang được khởi đầu với sự hình thành các cặp electron và lỗ trống, tiếp theo các phản ứng oxy hóa - khử.
Theo Chen và Ray [48], quá trình quang xúc tác bao gồm cả các phản ứng oxy hóa và phản ứng khử, nhưng khi có mặt của các tác nhân nhận electron và lỗ trống thì một trong hai phản ứng sẽ trở thành phản ứng chính. Khi có mặt của các tác nhân nhận electron (electron scavenger) (ví dụ oxy), các phản ứng oxy hóa trở lên trội hơn, trái lại khi có mặt của tác nhân khử lỗ trống (hole scavenger) (ví dụ axit formic, metanol, etanol, axit citric ...) thì có thể bỏ qua phản ứng oxy hóa và phản ứng khử trở thành phản ứng chính.
Quá trình quang khử các hợp chất hóa học chỉ xảy ra khi vùng dẫn của xúc tác quang có thế âm hơn thế khử của các chất hóa học đó. Ngược lại, quá trình quang oxy hóa các hợp chất hóa học sẽ xảy ra khi vùng hóa trị của xúc tác quang có thế dương hơn thế của oxy hóa của các chất hóa học đó. Vì vậy, mức năng lượng của đáy vùng dẫn là cơ sở để xác định hoạt tính quang khử của các electron quang sinh.
Các quá trình oxy hóa khử Cr(VI) được mô phỏng trong hình 1.4. Trong hình a) là quá trình quang khử Cr(VI) của vật liệu Mn-TiO2 và hình b) là quá trình quang khử Cr(VI) của vật liệu Mn-TiO2/RGO [34]. Theo nhóm tác giả ở
đây Cr (VI) tiếp nhận electron quang sinh rồi chuyển hóa thành Cr(III) và hấp phụ trên bề mặt vật liệu xúc tác quang. Axit formic đóng vai trò tác nhân nhận lỗ trống quang sinh và chuyển hóa thành CO2 và H2O.
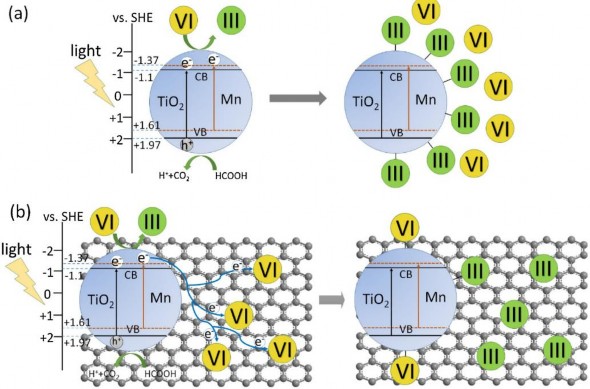
Hình 1.4. Mô phỏng quá trình quang khử Cr(VI) [34]
1.2.4. Các yếu tố ảnh hưởng đến quá trình quang khử các ion kim loại
Các quá trình biến đổi có khả năng thực hiện được (quá trình oxy hóa hoặc khử) của các cặp kim loại phụ thuộc vào giá trí tương đối của thế oxy hóa khử được so sánh với mức năng lượng của vùng dẫn và vùng hóa trị của xúc tác quang. Hình 1.5 mô tả các vị trí của vùng hóa trị và vùng dẫn của xúc tác quang TiO2 (anatas) và mối liên quan giữa chúng với thế của quá trình khử của các ion kim loại tại các pH khác nhau.
Hình 1.5 thể hiện sự phụ thuộc của vị trí vùng dẫn và vùng hóa trị vào pH của môi trường. Khi pH môi trường tăng lên vị trí của cả vùng hóa trị và vùng dẫn đều có xu hướng chuyển dịch về phía giảm điện thế, trung bình khoảng 59 mV trên mỗi đơn vị pH. Trong khi đó, thế của đa số các ion kim loại






