không phụ thuộc vào pH (trừ Cr (VI)). Thông thường, khi pH tăng sẽ thúc đẩy quá trình quang khử của các ion kim loại xảy ra. Tuy nhiên, các electron quang sinh không chỉ tham gia vào phản ứng quang khử các ion kim loại mà chúng còn có thể khử cả proton, nước và oxy hòa tan tùy thuộc vào từng điều kiện môi trường cụ thể.
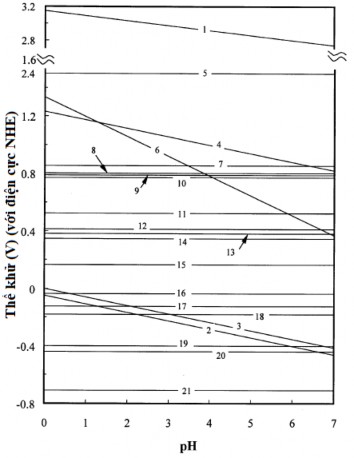
1-EVB, 2-ECB, 3-𝜑𝐻∗⁄𝐻2 , 4-𝜑𝑂2⁄𝐻2𝑂, 5-𝜑𝐴𝑢3+⁄𝐴𝑢, 6-𝜑𝐶𝑟6+⁄𝐶𝑟3+ , 7-𝜑𝐻𝑔2+⁄𝐻𝑔,
2
8-𝜑𝐴𝑔+⁄𝐴𝑔, 9-𝜑𝐻𝑔2+⁄𝐻𝑔, 10-𝜑𝐹𝑒3+⁄𝐹𝑒2+ , 11-𝜑𝐶𝑢+⁄𝐶𝑢, 12-𝜑𝐻𝑔𝐶𝑙2⁄𝐻𝑔,
4
13-𝜑𝐻𝑔𝐶𝑙2−⁄𝐻𝑔, 14-𝜑𝐶𝑢2+⁄𝐶𝑢, 15-𝜑𝐶𝑢2+⁄𝐶𝑢+ , 16-𝜑𝐹𝑒3+⁄𝐹𝑒 , 17-𝜑𝑃𝑏2+⁄𝑃𝑏,
18-𝜑𝑁𝑖2+⁄𝑁𝑖, 19-𝜑𝐶𝑑2+⁄𝐶𝑑 , 20-𝜑𝐹𝑒2+⁄𝐹𝑒 , 21-𝜑𝐶𝑟3+⁄𝐶𝑟
Hình 1.5. Vị trí của các vùng dẫn và vùng hóa trị của TiO2 (anatas) so sánh với thế khử của các ion kim loại ở các giá trị pH khác nhau [29].
Có thể bạn quan tâm!
-
 Ô Nhiễm Kim Loại Nặng Trong Nước Thải Sản Xuất Vật Liệu Nổ.
Ô Nhiễm Kim Loại Nặng Trong Nước Thải Sản Xuất Vật Liệu Nổ. -
 Nghiên cứu tổng hợp vật liệu TiO2- Fe2O3/GNP từ quặng ilmenit và graphit định hướng chuyển hóa Cr(VI) trong nước thải công nghiệp quốc phòng - 6
Nghiên cứu tổng hợp vật liệu TiO2- Fe2O3/GNP từ quặng ilmenit và graphit định hướng chuyển hóa Cr(VI) trong nước thải công nghiệp quốc phòng - 6 -
 Các Yếu Tố Ảnh Hưởng Đến Quá Trình Quang Khử Các Ion Kim Loại
Các Yếu Tố Ảnh Hưởng Đến Quá Trình Quang Khử Các Ion Kim Loại -
 Quy Trình Kỹ Thuật Tổng Hợp Vật Liệu Gnp Từ Graphit Tự Nhiên
Quy Trình Kỹ Thuật Tổng Hợp Vật Liệu Gnp Từ Graphit Tự Nhiên -
 Xác Định Đặc Trưng Bề Mặt, Đặc Trưng Nhiệt Của Vật Liệu
Xác Định Đặc Trưng Bề Mặt, Đặc Trưng Nhiệt Của Vật Liệu -
 Đánh Giá Hiệu Quả Xử Lý Nước Nhiễm Cr (Vi) Sau Xử Lý
Đánh Giá Hiệu Quả Xử Lý Nước Nhiễm Cr (Vi) Sau Xử Lý
Xem toàn bộ 173 trang tài liệu này.
Như trên hình 1.5, quá trình quang khử của Cr(III), Cd(II) và Fe(II) không xảy ra ở bất kỳ pH nào do thế khử của các ion này thấp hơn so với thế
khử của electron quang sinh, trong khi đó quá trình quang khử các ion kim loại khác như Au(III), Cr(VI), Hg(II), Ag(I), Hg (I), Fe(III), Cu(I) và Cu(II) đều có thể thực hiện được về mặt nhiệt động học. Trong số các ion kim loại đó, Cr(VI) và Fe(III) chỉ có thể bị khử về tương ứng là Cr(III) và Fe(II), còn trong trường hợp của Pb(II) và Ni(II) thì tùy thuộc vào độ pH mà quá trình có thể thực hiện được hoặc không về mặt nhiệt động học [29].
Sơ đồ phản ứng phản ứng quang khử kim loại của TiO2 như sau Bước 1: Khởi đầu
ℎ𝑣≥𝐸𝐵𝐺
𝑇𝑖𝑂2 → 𝑇𝑖𝑂2
(ℎ+
+ 𝑒
−) (1.1)
Bước 2: Quá trình oxy hóa các hợp chất hữu cơ và nước
𝑂𝐻− +ℎ+ → 𝐻𝑂. (1.2)
𝑂𝐻. +𝑅𝐻 → 𝑅. + 𝐻2𝑂 → 𝐶𝑂2 + 𝑎𝑥í𝑡 𝑘ℎ𝑜á𝑛𝑔 (1.3)
2𝐻2𝑂 + 4ℎ+ → 𝑂2 + 4𝐻+ (1.4) Bước 3: Quá trình khử các ion kim loại
𝑀𝑛+ +𝑒− → 𝑀(𝑛−1)+ (1.5)
Có một số thông số ảnh hưởng đến quá trình quang khử của các ion kim loại như: nồng độ ion kim loại ban đầu, lượng xúc tác sử dụng, sự có mặt của chất tiêu thụ electron hoặc chất tiêu thụ lỗ trống, cường độ ánh sáng.
a. Ảnh hưởng của nồng độ ion kim loại ban đầu
Động học phản ứng xúc tác quang khá khác so với các phản ứng oxy hóa nâng cao thông thường (AOP) và thường theo tác động của tác động bão hòa. Tốc độ ban đầu của phản ứng quang xúc tác theo cơ chế Langmuir– Hinshelwood đối với nồng độ ban đầu của ion kim loại
𝑟0
= 𝑘𝐾𝐶0
1+𝐾𝐶0
(1.6)
Theo công thức này, ở nồng độ cao (KC0 >>1), tốc độ phản ứng là cao nhất và được mô tả là tốc độ bậc không, trái lại với dung dịch loãng (KC0<<1), tốc độ phản ứng là bậc nhất.
b. Ảnh hưởng của pH
Một biến số quan trọng khác là pH, vì pH quyết định các hình thái của cả bề mặt của chất xúc tác quang và cả ion kim loại bị khử, nó ảnh hưởng sâu hơn đến hiệu quả phản ứng xúc tác quang.
Xu hướng chung khi đánh giá hiệu quả phản ứng quang khử ion kim loại với sự biến đổi pH là ở pH thấp, hiệu quả phản ứng quang khử thường thấp và khi pH tăng lên trong phạm vi môi trường axit sẽ làm tăng hiệu quả phản ứng quang khử, như khi pH tiếp tục tăng sẽ dẫn đến hiệu quả phản ứng quang khử sẽ bị giảm.
Trong môi trường nước, pH thấp cung cấp một lượng ion H+, các ion này có thể ảnh hưởng đến bề mặt TiOH (TiO2 bị hydrat hóa) để hình thành Ti.OH2+. Các phân tử Ti.OH2+ bị proton hóa sẽ gặp khó khăn hơn để giải phóng các electron, mặc dù các ion kim loại đa số tồn tại ở các dạng mà các dạng đó dễ dàng bị khử với số lượng lớn, hiệu quả phản ứng quang khử thấp thường được quan sát thấy. Có thể thấy rằng số lượng các electron đóng vai trò nổi bật lên quá trình quang khử.
Khi tăng pH trong giới hạn môi trường axit, nồng độ H+ giảm, nó làm quá trình tạo TiOH có thể tăng lên. Điều này có thể làm tăng quá trình giải phóng electron và các ion kim loại được tìm thấy như là các dạng bị khử, cho nên quá trình quang phân hủy có thể tăng lên đáng kể.
Cuối cùng, số lượng nhóm OH có thể vượt quá ở pH cao, điều này có thể tạo ra bề mặt mang điện âm của TiO2 để hình thành TiO-. Điều này có thể làm chậm lại quá trình giải phóng electron. Theo một khía cạnh khác, các ion kim loại thường tạo kết tủa với ion hydroxit để hình thành M(OH)n (M là ion kim loại, n là hóa trị). Cả hai tình huống này đều gây ra hiệu ứng ngược đối với quá trình quang khử.
Vì nhiều yếu tố khác nhau mà giá trị pH tối ưu cũng phụ thuộc nhiều vào bản chất của riêng từng ion kim loại. Giá trị pH tối ưu đối với Ag thường là từ
6 - 7, với Cr(VI) là pH = 2 [83], với Cu(II) là từ 2 - 3,5 [113]và với Hg(II) là pH = 4 - 4,5[97].
c. Ảnh hưởng của hàm lượng vật liệu xúc tác quang
Tốc độ ban đầu của phản ứng xúc tác quang tỷ lệ thuận vào hàm lượng vật liệu xúc tác quang sử dụng. Tuy nhiên khi tăng đến một giá trị hàm lượng tối ưu thì tốc độ phản ứng trở lên không phụ thuộc vào lượng xúc tác quang.
Hàm lượng tối ưu này phụ thuộc lớn vào các yếu tố như cường độ ánh sáng, hình dạng của thiết bị phản ứng, kích thước hạt xúc tác quang và thành phần pha. Ở hàm lượng tối ưu, có thể cho rằng toàn bộ bề mặt của xúc tác quang được chiếu sáng bởi nguồn ánh sáng tới. Khi hàm lượng chất xúc tác vượt quá hàm lượng tối ưu, sẽ xảy ra hiệu ứng che chắn của giữa các hạt xúc tác làm cho ánh sáng không thể tiếp xúc với các hạt xúc tác bị che khuất, làm các hạt bị che khuất này không thể thể hiện được hoạt tính xúc tác quang của mình, do đó hoạt tính xúc tác quang không tăng mặc dù khi tăng hàm lượng xúc tác quang sẽ làm tăng diện tích bề mặt xúc tác quang trên 1 đơn vị thể tích của dung dịch. Chen và Ray đã đề xuất một công thức để giải thích ảnh hưởng của hàm lượng xúc tác quang lên tốc độ phản ứng xúc tác quang.
𝑟𝑖 = 𝑘[1 − 𝑒−𝜀𝛽𝐶𝑥ú𝑐 𝑡á𝑐𝐻] (1.7)
Trong đó k là hằng số tốc độ phản ứng, Cxúc tác là hàm lượng xúc tác, hệ số hấp thụ ánh sáng của hệ phản ứng là Ɛ, β là số lũy thừa liên quan đến cường độ ánh sáng (giá trị của nó nằm giữa 0,5 và 1) và H là chiều dày theo hướng truyền qua của ánh sáng [97].
c. Ảnh hưởng của tác nhân nhận electron và lỗ trống
Trong phản ứng xúc tác quang, các electron tham gia trong phản ứng khử trong khi các lỗ trống tham gia trong phản ứng oxy hóa. Việc sử dụng tác nhân nhận electron (thường là oxy hòa tan) là cần thiết trong trường hợp phản ứng oxy hóa. Tốc độ quang oxy hóa của phenol khi có mặt của oxy hòa tan đã được
mô tả bởi Chen và Ray [97], tốc độ này cũng theo công thức Langmuir– Hinshelwood:
𝑘 =
𝑘𝐾𝑂2𝑝𝑂2 1+𝐾𝑂2𝑝𝑂2
(1.8)
Trong đó k là hằng số động học đo được của quá trình phân hủy chất hữu cơ, 𝐾𝑂2 là hằng số hấp phụ oxy hòa tan trên bề mặt của xúc tác quang, 𝑝𝑂2 là áp suất riêng phần của oxy hòa tan.
Trong khi đó, quá trình quang khử cần một tác nhân lỗ trống (thường là axit formic, etanol, methanol, EDTA, axit citric…) tham gia trong hệ phản ứng trong suốt quá trình khử. Thông thường oxy được thay thế bằng các dòng khí nitơ hoặc các khí trơ khác tuần hoàn hoặc liên tục [97].
d. Ảnh hưởng của cường độ chiếu sáng
Với sự tăng lên của cường độ ánh sáng, giá trị luồng photon (số lượng các photon tới trên đơn vị thời gian trên đơn vị diện tích) tăng, điều này nâng cao quá trình tạo ra các cặp electron - lỗ trống. Do đó ở cường độ chiếu sáng thấp, phản ứng quang xúc tác sẽ theo tốc độ bậc nhất với cường độ ánh sáng, trong khi ở cường độ cao, tốc độ phản ứng xúc tác quang tỷ lệ với căn bậc hai của cường độ. Theo Herrmann, ở cường độ cao hơn (25 mWm-2) tốc độ hình thành cặp electron-lỗ trống vượt quá tốc độ phản ứng, dẫn đến thúc đẩy quá trình tái tổ hợp electron-lỗ trống [97].
e. Ảnh hưởng của thời gian chiếu sáng
Thời gian phản ứng được xác định bởi khoảng thời gian tiếp xúc giữa ánh sáng với chất xúc tác quang và các electron quang sinh của các chất này với các ion kim loại bị khử. Xu hướng chung được quan sát thấy là hiệu quả của phản ứng quang khử được nâng cao khi thời gian phản ứng được tăng lên. Nhưng khi thời gian phản ứng được nâng cao quá thời gian tối ưu, phản ứng quang khử thường không phụ thuộc vào thời gian phản ứng.
Lúc bắt đầu và trong khoảng thời gian sau đó, sự tiếp xúc giữa ánh sáng và chất xúc tác quang trở lên hiệu quả hơn và kết quả là tạo ra một lượng lớn hơn các electron. Sau đó, khoảng thời gian kéo dài sau đó cho phép sự tiếp xúc hiệu quả hơn giữa các electron có thể với các ion kim loại bị khử. Điều này có thể nâng cao một cách đáng kể phản ứng quang khử. Ở một thời điểm, phản ứng quang khử đạt mức độ tối đa thể hiện rằng thời gian tối ưu đã đạt được. Khi thời gian phản ứng kéo dài hơn khoảng thời gian tối ưu, một lượng rất lớn sản phẩm được tạo thành sẽ ngăn cản sự tiếp xúc giữa các tác nhân phản ứng. Do đó, các chất xúc tác quang sẽ bị cản trở quá trình giải phóng ra nhiều electron, điều này sẽ không làm tăng phản ứng quang khử. Một nguyên nhân khác là các ion bị khử trong dung dịch đã bị khử hoàn toàn, không còn các ion trong dung dịch. Thời gian phản ứng tối ưu được xác định là khoảng 5 giờ đối với ion Ag(I), 4 giờ với ion Cr(VI), 3giờ đối với Cu(II) và 50-150 phút đối với ion Hg (II)[113].
f. Phương pháp nhận biết tác nhân oxi hóa trong quang xúc tác
Phản ứng xúc tác quang diễn ra theo cơ chế gốc với sự hình thành các gốc tự do e-, h+, sau đó sự xuất hiện của ∙OH, O2-. Gốc tự do ∙OH là tác nhân oxi hóa mạnh cho phép khoáng hóa không chọn lọc các hợp chất hữu cơ. Theo tác giả Buxton [28], để nhận biết gốc tự do ∙OH có thể dùng tác nhân butanol- 1, khi có sự tham gia của butanol-1 tốc độ chuyển hóa hợp chất hữu cơ giảm mạnh do butanol-1 dễ dàng khử các tác nhân ∙OH. Khi nghiên cứu cơ chế quá trình quang xúc tác Cr(VI) và RhB, tác giả Xue Bai [24] cũng đã sử dụng các chất dập tắt gốc tự do như: natri etylen diamin tetra acetic (EDTA-Na) để dập tắt gốc h+, dimetyl sunfoxit (DMSO) dập tắt gốc e-, benzoquinon (BQ) dập tắt gốc •OH, rượu isopropyl để dập tắt gốc •O2-. Kết quả cho thấy, khi sử dụng các chất dập tắt gốc tự do, hiệu quả phản ứng quang xúc tác giảm đi rõ rệt.
1.3. Kết luận chương 1
Trên đây là một số các công trình nghiên cứu đi sâu vào việc sử dụng vật liệu tổ hợp trên cơ sở graphen để xử lý môi trường. Qua đó, có thể thấy rằng việc ứng dụng vật liệu trên cơ sở graphen và oxit kim loại đang thu hút được rất nhiều sự quan tâm của các nhà nghiên cứu trong nước, đây là hướng nghiên cứu mới do đa phần các công trình là từ 2016 trở lại đây, số lượng công bố rất đa dạng, trong đó hướng xử lý kim loại nặng là hướng đang được tập trung nhất. Các vật liệu tổ hợp đều thể hiện khả năng hấp phụ và hoạt tính xúc tác quang xử lý các chất ô nhiễm tốt hơn nhiều lần so với các vật liệu thành phần khi sử dụng riêng lẻ.
Graphen được sử dụng trong các nghiên cứu chủ yếu là GO và RGO được tổng hợp trực tiếp từ graphit bằng phương pháp Hummers hoặc Hummers cải tiến sử dụng các tác nhân oxy hóa mạnh để tạo ra GO sau đó được khử bằng các tác nhân khử thu được RGO. Việc GO và RGO được sử dụng nhiều trong các nghiên cứu do các dẫn xuất graphen này có thể tạo được liên kết bền vững với các oxit kim loại nhờ các nhóm chức chứa oxy trên bề mặt. Tuy nhiên vì sử dụng các tác nhân oxy hóa mạnh làm cho bề mặt graphen xuất hiện các khuyết tật và vì thế nó làm giảm các đặc tính của graphen như làm giảm diện tích bề mặt, độ dẫn điện, khả năng lan truyền electron. Mặt khác quá trình tổng hợp graphen đi qua GO phải trải qua nhiều bước, phức tạp, sử dụng các tác nhân oxy hóa mạnh làm cho khả năng ứng dụng vật liệu vào thực tế còn nhiều hạn chế. Graphen nanoplatelets (hay graphen nanoplates) là một vật liệu graphen, có diện tích bề mặt lớn, bề mặt ít khuyết tật, có độ dẫn điện cao, được chế tạo đơn giản bằng phương pháp hóa học và có thể được ứng dụng trên quy mô công nghiệp.
Ngoài ra đa phần các nghiên cứu đang tập trung vào việc sử dụng quá trình hấp phụ để xử lý kim loại nặng, còn quá trình xử lý kim loại nặng bằng phương pháp oxy hóa nâng cao mà cụ thể ở đây là phương pháp xúc tác quang gần như chưa được quan tâm. Phương pháp oxy hóa nâng cao là phương pháp xử lý tiên tiến, đã chứng tỏ hiệu quả xử lý rất tốt với các chất ô nhiễm vô cơ và hữu cơ, đối với kim loại nặng, quá trình xử lý bằng oxy hóa nâng cao có thể
giảm lượng hóa chất sử dụng, các tác nhân xúc tác không độc, ít phát thải chất thải thứ cấp, khả năng tái sử dụng cao. Đối với nước thải sản xuất vật liệu nổ quốc phòng đây cũng là phương pháp phù hợp vì có thể xử lý đồng thời cả các kim loại nặng và các chất hữu cơ khó phân hủy trong đó.
Vật liệu tổ hợp trên cơ sở graphen và oxit kim loại bán dẫn có nhiều ưu điểm vượt trội so với việc sử dụng các vật liệu riêng lẻ, do nó có thể tận dụng được khả năng hấp phụ kim loại nặng, độ dẫn điện và khả năng lan truyền electron của graphen nhờ đó hiệu ứng xúc tác quang của vật liệu tổ hợp sẽ được cải tiến rõ rệt.
Qua quá trình tổng quan về vật liệu trên cơ sở graphen và oxit kim loại, đặc điểm nước thải nhiễm kim loại nặng của sản xuất vật liệu nổ công nghiệp và khái quát ưu, nhược điểm của các phương pháp xử lý kim loại nặng, hướng nghiên cứu của đề tài luận án được lựa chọn tập trung đến là hướng về tổng hợp vật liệu trên cơ sở graphen và TiO2, ứng dụng trong quá trình quang xúc tác xử lý kim loại nặng. Tiền chất graphen lựa chọn là graphen nanoplatelets (hay graphen nanoplates) được tổng hợp trực tiếp từ graphit tự nhiên bằng phương pháp hóa học. Tiền chất chế tạo TiO2 là đi từ tinh quặng ilmenit 52% Bình Định. Đối tượng hướng đến xử lý là ion Cr(VI) trong nước thải sản xuất quốc phòng.