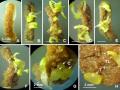
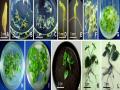
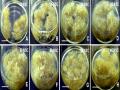
Bảng 3.16. Ảnh hưởng của NAA và môi trường khoáng đến sự tạo rễ bất định trực tiếp từ mảnh lá (3 x 10 mm), ở môi trường ½MS, 30 NSC.
Môi trường khoáng | Tỷ lệ mẫu tạo rễ (%) | Số rễ/mẫu | Chiều dài rễ (mm) | |
0 | MS | 00,0o* | 00,0s | 0,00p |
0,5 | MS | 63,33n | 8,46q | 8,23m |
1 | MS | 66,67m | 9,52mn | 8,61k |
2 | MS | 78,89j | 12,39h | 9,28i |
3 | MS | 87,78e | 15,78d | 10,79g |
4 | MS | 82,22f | 13,46f | 7,29l |
5 | MS | 72,22h | 10,69l | 6,45o |
0 | ½MS | 00,0o | 00,0s | 0,00p |
0,5 | ½MS | 82,22h | 9,67m | 10,50h |
1 | ½MS | 86,67fg | 11,74i | 11,48e |
2 | ½MS | 93,33c | 15,52e | 12,32d |
3 | ½MS | 100,00a | 19,67a | 16,29a |
4 | ½MS | 96,67b | 17,33b | 9,41i |
5 | ½MS | 88,89e | 13,06g | 8,48kl |
0 | B5 | 00,0o | 00,0s | 0,00p |
0,5 | B5 | 71,11l | 6,89r | 11,46ef |
1 | B5 | 81,11hi | 8,22q | 12,43d |
2 | B5 | 88,89e | 9,33n | 13,51c |
3 | B5 | 95,56b | 11,50j | 14,65b |
4 | B5 | 92,22cd | 10,50l | 10,41h |
5 | B5 | 85,56g | 8,80o | 9,31i |
0 | SH | 00,0o | 00,0s | 0,00p |
0,5 | SH | 65,56m | 8,41qr | 8,81j |
1 | SH | 71,11l | 9,52mn | 9,28i |
2 | SH | 80,00ij | 12,46h | 11,28f |
3 | SH | 91,11d | 16,59c | 12,29d |
4 | SH | 85,56g | 13,36f | 8,36l |
5 | SH | 75,56k | 11,04k | 7,76n |
Có thể bạn quan tâm!
-
 Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc.
Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc. -
 Nhân Phôi Qua Nuôi Cấy Lỏng Lắc Trong Môi Trường Sh, 30 – 60 Nsc.
Nhân Phôi Qua Nuôi Cấy Lỏng Lắc Trong Môi Trường Sh, 30 – 60 Nsc. -
 Tạo Cây Con Từ Phôi Vô Tính Nuôi Lỏng Lắc Trong Môi Trường Ms, ½Ms
Tạo Cây Con Từ Phôi Vô Tính Nuôi Lỏng Lắc Trong Môi Trường Ms, ½Ms -
 Minh Họa Sự Tái Sinh Rễ Trực Tiếp Và Khảo Sát Hình Thái Giải Phẫu Rễ Tái Sinh Trực Tiếp
Minh Họa Sự Tái Sinh Rễ Trực Tiếp Và Khảo Sát Hình Thái Giải Phẫu Rễ Tái Sinh Trực Tiếp -
 Ảnh Hưởng Của Naa, Iba Đến Sự Phân Nhánh Rễ, Ở Môi Trường ½Ms, 21 Nsc.
Ảnh Hưởng Của Naa, Iba Đến Sự Phân Nhánh Rễ, Ở Môi Trường ½Ms, 21 Nsc. -
 Diễn Biến Tăng Trưởng Sinh Khối Rễ Bất Định Theo Thời Gian, 7 – 49 Nsc.
Diễn Biến Tăng Trưởng Sinh Khối Rễ Bất Định Theo Thời Gian, 7 – 49 Nsc.
Xem toàn bộ 180 trang tài liệu này.
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt có ý nghĩa ở mức p ≤ 0, 05 trong phép thử Duncan. Số liệu (%) được chuyển đổi sang arcsin√𝑥 khi phân tích thống kê.

Hình 3.37. Tạo rễ trực tiếp từ mảnh lá (3 x 10 mm) ở môi trường ½MS, có NAA, 30 NSC. A. 0,5 mg/L B. 1 mg/L C. 2 mg/L D. 3 mg/L, E. 4 mg/L, F. 5 mg/L. |

Hình 3.39. Tạo rễ trực tiếp từ mảnh lá (3 x 10 mm) ở môi trường SH, có NAA, 30 NSC. A. 0,5 mg/L B. 1 mg/L C. 2 mg/L D. 3 mg/L E. 4 mg/L, F. 5 mg/L. |
Hệ thống LMTB gồm những mẫu cấy có kích thước nhỏ (1 - vài mm), hàm chứa ít chất điều hòa sinh trưởng nội sinh, nên sự phát sinh hình thái phụ thuộc chủ yếu vào chất ĐHST bổ sung vào môi trường. Hệ thống này có ưu điểm là thời gian phát sinh hình thái tương đối ngắn do đáp ứng nhanh với nuôi cấy, tỷ lệ phát sinh hình thái cao, đa dạng về hình thái phát sinh tùy môi trường nuôi cấy. Do đó, hệ thống này đã được ứng dụng hiệu quả trong thực tiễn nuôi cấy in vitro nhằm nghiên cứu cơ
bản về phát sinh hình thái, nhân giống cây trồng [178].
Kết quả của thí nghiệm tạo rễ bất định trực tiếp từ mô lá NGBCC cho thấy, môi trường ½MS có 3 mg/L NAA được xem là rất thích hợp cho tạo rễ bất định trực tiếp từ mô lá của NGBCC; ngược lại, IBA hoàn toàn không gây đáp ứng tạo rễ bất định. Ling và cộng sự (2013) cho rằng trường hợp NAA có tác động tốt đối với tạo rễ là do NAA được oxy hóa hiệu quả thành IAA để tế bào sử dụng [179]. Tác động âm tính đối với tạo rễ có thể do IBA không được chuyển đổi thành IAA bởi quá trình β-oxy hóa ở các thể peroxisome trong tế bào [180].
Đã ghi nhận NAA, ở dạng riêng lẻ hoặc kết hợp với auxin khác, là tác nhân kích thích tạo rễ tốt từ mành lá nhiều loài thực vật được nuôi cấy in vitro như Eurycoma longifolia khi dùng 3 mg/L NAA [181] hoặc 3 mg/L NAA (kết hợp với 1 mg/L IBA) là thích hợp nhất cho tạo rễ từ mảnh lá Gynura procumbens [182]. IBA cũng là chất điều hòa sinh trưởng rất thích hợp trong sử dụng tạo rễ đối với nhiều cây dược liệu [98]. Tuy nhiên, ở một số đối tượng thực vật, IBA (kể cả IAA) hoàn toàn không thích hợp, ví dụ như ở trường hợp tạo rễ bất định từ mảnh lá Andrographis paniculata trên môi trường MS chỉ tạo được rễ bất định khi sử dụng NAA (1 mg/L) [183]; cũng nhận thấy chồi Diospyros crassiflora không tạo rễ bất định trên môi trường ½MS có IBA (2,5 - 19,6 µM). Nói chung, loại và nồng độ auxin thích hợp cho cảm ứng tạo rễ và kéo dài rễ bất định phụ thuộc chủ yếu vào loài thực vật [184].
Như đã trình bày mô lá tạo rễ bất định tốt nhất trên môi trường khoáng ½MS ở tất cả các chỉ tiêu theo dõi so với các môi trường MS, B5 và SH. Theo Khalafalla và cộng sự (2009), đáp ứng tạo rễ từ mô lá phụ thuộc vào thành phần khoáng cơ bản của môi trường và hàm lượng đạm nitrate. Tương tự như một số loài thực vật khác, theo chúng tôi, có thể do nhu cầu về khoáng đa lượng đối với NGBCC ở mức tương đối thấp, cụ thể tổng khoáng đa lượng ở môi trường ½MS là thấp nhất (2.116 mg/L) so với tổng khoáng đa lượng ở các môi trường MS, B5 và SH cao hơn nhiều, lần lượt là 4.232 mg/L, 2.999 mg/L và 3.146 mg/L; và trong đó có thể nhu cầu về đạm nitrate cũng ở mức thấp hơn – 1.775 mg/L ở ½MS so với các môi trường MS, B5 và SH - cao hơn nhiều là 3.550 mg, 2.500 mg và 2.500 mg, theo thứ tự. Cũng theo Khalafalla và cộng sự (2009), trong mối tương quan với đạm nitrate, đạm ammonium (NH4) cũng đóng vai trò quan trọng trong tạo rễ và cho rằng số rễ Vernonia amygdalina tái sinh từ mảnh lá trên môi trường B5 ít hơn so với môi trường MS có thể do thành phần
104
đạm ammonium (NH4)2SO4 trong môi trường B5 ít hơn (134 mg/L) ở môi trường MS (NH4NO3, 1.650 mg/L) [185]. Ở NGBCC, số rễ tái sinh ít trên môi trường B5 cũng có thể do yếu tố ammonium tương tự như trường hợp của các tác giả nêu trên. Trong môi trường SH có đạm NH4PO4 phôi Panax quinquefolius nẩy mầm tạo rễ trụ tốt trên môi trường có khoáng thấp - ½SH [36]; tương tự, chồi Panax ginseng (có nguồn gốc phôi vô tính) phát triển rễ trụ tốt trên môi trường 1/3SH [41]. Rễ Panax ginseng tạo sinh khối tốt trong môi trường SH chỉ có ½NH4PO4 [186]. Ở NGBCC, đáp ứng tái sinh rễ không tốt có thể do nồng độ NH4PO4 ở môi trường SH không phù hợp hoặc loại đạm ammonium này khác với NH4NO3, loại thích hợp hơn cho loài thực vật này ở môi trường MS, ½MS hoặc/và khác với (NH4)2SO4 ở môi trường B5.
Như vậy, kết quả của nghiên cứu này cho thấy NAA có vai trò quan trọng trong việc tạo rễ bất định trực tiếp từ mô lá, tỷ lệ % mẫu tạo rễ, số rễ/mẫu và chiều dài rễ khác nhau chịu ảnh hưởng bởi các mức nồng độ của NAA và hàm lượng – thành phần của môi trường khoáng.
3.1.1.2. Ảnh hưởng của nồng độ đường đến sự tạo rễ bất định trực tiếp từ mô lá
Ảnh hưởng của nồng độ đường đến sự tạo rễ bất định trực tiếp từ mảnh lá (10 x 10 mm)
Kế thừa kết quả thí nghiệm trên, môi trường ½MS có bổ sung 3 mg/L NAA được sử dụng để nghiên cứu xác định nồng độ đường thích hợp cho tạo rễ bất định.
Bảng 3.17. Ảnh hưởng của nồng độ đường đến sự tạo rễ bất định trực tiếp từ mảnh lá (10 x 10 mm), ở môi trường ½MS, 30 NSC.
Tỷ lệ mẫu tạo rễ (%) | Số rễ/mẫu | Chiều dài rễ (mm) | |
20 | 92,22b* | 58,35b | 14,63b |
30 | 100,00a | 70,50a | 16,70a |
40 | 87,78c | 46,44c | 12,26c |
50 | 85,56d | 36,24d | 10,47d |
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt có ý nghĩa ở mức p ≤ 0, 05 trong phép kiểm định LSD. Số liệu (%) được chuyển đổi sang (x+0,5)1/2 khi xử lý thống kê.
Ở 30 ngày sau nuôi cấy, kết quả thí nghiệm cho thấy các nghiệm thức có nồng độ sucrose khác nhau cho kết quả khác biệt về mặt thống kê ở tất cả các chỉ tiêu theo
105
dõi, trong đó nồng độ sucrose 30 g/L là tối ưu cho tạo rễ ở mảnh lá có tỷ lệ mẫu tạo rễ 100%, số rễ/mẫu 70,50; chiều dài rễ 16,70 mm (Bảng 3.17), ở nồng độ sucrose cao 50 g/L các chỉ tiêu theo dõi đều giảm (tỷ lệ mẫu tạo rễ 85,56%, số rễ/mẫu 36,24; chiều dài rễ 10,47 mm) rễ hơi vàng, ít lông hút hơn, rễ ngắn hơn (Hình 3.40).
Mô tế bào thực vật nuôi cấy in vitro ít hoặc không có khả năng tự dưỡng nên cần bổ sung nguồn carbon. Đường là nguồn carbon được sử dụng phổ biến, trong nuôi cấy mô giúp hỗ trợ quá trình phân bào và phát sinh hình thái; ngoài ra, nồng độ đường thích hợp còn làm gia tăng hàm lượng hợp chất thứ cấp trong rễ [98].
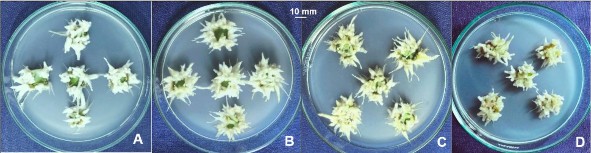
Hình 3.40. Ảnh hưởng của nồng độ đường đến sự tạo rễ từ mảnh lá (10 x 10 mm), ở môi trường ½MS, 30 NSC.
A,B,C,D. Đĩa cấy mảnh lá tạo rễ ở môi trường ½MS có sucrose 20, 30, 40, 50 g/L.
Ảnh hưởng của nồng độ đường đến sự tạo rễ bất định trực tiếp từ mảnh lá (3 x 10 mm)
Kết quả thí nghiệm cho thấy, sau nuôi cấy 30 ngày các mẫu cấy ở môi trường có 30 g/L sucrose tạo rễ tốt nhất với tỷ lệ mẫu tạo rễ 100%; số rễ/mẫu 22,65; chiều dài rễ 15,40 mm; thấp nhất khi môi trường có bổ sung sucrose với nồng độ cao 50 g/L, các chỉ tiêu theo dõi đều giảm 82,59%; số rễ/mẫu 9,37; chiều dài rễ 9,54 mm. Ở các nghiệm thức có nồng độ sucrose 20 g/L, 40 g/L chỉ tiêu tỷ lệ mẫu tạo rễ, chiều dài rễ có khác biệt thống kê nhưng số rễ/mẫu không khác biệt về thống kê. Từ kết quả này cho thấy, các mức nồng độ sucrose khác nhau có ảnh hưởng khác biệt đến tạo rễ bất định. Tỷ lệ % mẫu tạo rễ ở mẫu cấy mảnh lá có kích thước nhỏ (3 x 10 mm) cao hơn mẫu cấy mảnh lá (10 x 10 mm) do đáp ứng của mẫu cấy với môi trường nuôi cấy tốt hơn. Tuy nhiên, ở nghiệm thức nồng độ sucrose cao 50 g/L, ở mẫu cấy mảnh lá kích thước nhỏ (3 x 10 mm) lại có tỷ lệ mẫu tạo rễ ít hơn so với mẫu cấy mảnh lá do ở nồng độ đường cao làm áp suất thẩm thấu tăng, mô cấy thiếu nước ảnh hưởng đến sinh lý của mô cấy.
106
Bảng 3.18. Ảnh hưởng của nồng độ đường đến sự tạo rễ bất định trực tiếp từ mảnh lá (3 x 10 mm), ở môi trường ½MS, 30 NSC.
Tỷ lệ mẫu tạo rễ (%) | Số rễ/mẫu | Chiều dài rễ (mm) | |
20 | 95,19b* | 11,59b | 13,61b |
30 | 100,00a | 22,65a | 15,40a |
40 | 91,11c | 11,54b | 11,53c |
50 | 82,59d | 9,37c | 9,54d |
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt ý nghĩa với p ≤ 0,05 trong phép thử LSD. Số liệu (%) được chuyển đổi sang (x+0,5)1/2 khi xử lý thống kê.
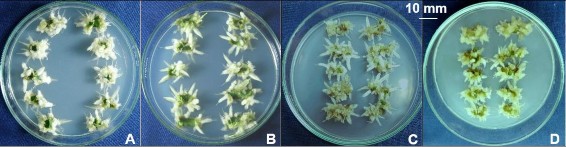
Hình 3.41. Ảnh hưởng của nồng độ đường đến sự tạo rễ trực tiếp từ mảnh lá (3 x 10 mm), ở môi trường ½MS, 30 NSC.
A,B,C,D. Đĩa cấy mảnh lá (3 x 10 mm) tạo rễ ở môi trường ½MS có sucrose 20, 30, 40, 50 g/L.
Như vậy, môi trường ½MS có bổ sung 3 mg/L NAA với 30 g/L sucrose là thích hợp nhất cho tạo rễ bất định từ mô lá NGBCC. Kết quả này cũng phù hợp với một số kết quả nghiên cứu sử dụng đường sucrose 30 g/L để tạo rễ bất định Panax vietnamensis [187], Panax stipuleanatus [46], sucrose 30 g/L là tối ưu cho rễ Panax ginseng phát triển [188].
3.1.1.3. Ảnh hưởng của điều kiện chiếu sáng đến sự tạo rễ bất định trực tiếp từ mô
lá
Ảnh hưởng của điều kiện chiếu sáng đến sự tạo rễ bất định trực tiếp từ
mảnh lá (10 x 10 mm)
Trong nghiên cứu tạo rễ bất định, ánh sáng được cho là tác nhân ức chế sự hình thành rễ, nhất là giai đoạn hình thành sơ khởi rễ, điều kiện tối cần cho giai đoạn đầu của quá trình ra rễ, chu kỳ tối thích hợp để rễ phát triển 3 - 10 ngày tùy thuộc vào loài thực vật khác nhau [189]. Nhiều nghiên cứu tạo rễ bất định đạt kết quả tốt trong
điều kiện tối. Tuy nhiên ở đối tượng NGBCC, nhận thấy ánh sáng lại có tác động tích cực đến sự thành rễ bất định từ mô lá. Số liệu (Bảng 3.19) cho thấy, các chỉ tiêu theo dõi có sự khác biệt rõ rệt giữa các nghiệm thức. Ở điều kiện chiếu sáng, mẫu tạo rễ với tỷ lệ rất cao, chiếm 95,56% (2.000 lux), 100% (4.000 lux); rễ hình thành với số lượng nhiều nhất 68,80 rễ/mẫu (4.000 lux), thấp nhất mẫu cấy ở điều kiện tối. Các mẫu cấy mảnh lá nuôi cấy ở cường độ chiếu sáng khác nhau, thì rễ hình thành có chiều dài khác nhau, mẫu cấy mảnh lá ở điều kiện tối rễ hình thành dài nhất (19,77 mm), mẫu cấy mảnh lá ở điều kiện chiếu sáng 4.000 lux tạo rễ có chiều dài cũng khá tốt (16,53 mm). Như vậy, sự khác biệt về các chỉ tiêu theo dõi ở các nghiệm thức cho thấy, điều kiện sáng, tối có ảnh hưởng đến sự phát sinh rễ từ mảnh lá (Hình 3.42)
Bảng 3.19. Ảnh hưởng của điều kiện chiếu sáng đến sự tạo rễ bất định trực tiếp từ mảnh lá (10 x 10 mm), ở môi trường ½MS, 30 NSC
Tỷ lệ mẫu tạo rễ (%) | Số rễ/mẫu | Chiều dài rễ (mm) | Đặc điểm rễ | |
4.000 | 100a* | 68,80a | 16,53b | Rễ dài, nhiều lông hút, màu trắng đục |
2.000 | 95,56b | 30,03b | 15,37c | Rễ dài, nhiều lông hút, màu trắng |
Tối | 93,33c | 27,20c | 19,77a | Rễ rất dài, ít lông hút, một số rễ màu hơi vàng |
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt ý nghĩa với p ≤ 0,05 trong phép thử LSD. Số liệu (%) được chuyển đổi sang (x+0,5)1/2 khi xử lý thống kê.
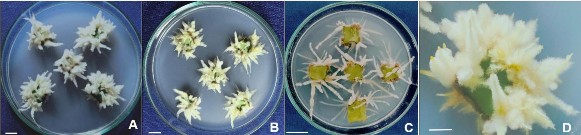
Hình 3.42. Ảnh hưởng của điều kiện chiếu sáng đến sự tạo rễ bất định từ mảnh lá (10 x 10 mm), ở môi trường ½MS, 30 NSC.
A,B,C. Đĩa cấy mảnh lá tạo rễ ở cường độ chiếu sáng 4.000 lux, 2.000 lux, tối; D.
Mảnh lá tạo rễ ở môi trường ½MS có 3 mg/L NAA, 4000 lux. Thanh ngang 10 mm.
Ảnh hưởng của điều kiện chiếu sáng đến sự tạo rễ bất định trực tiếp từ mảnh lá (3 x 10 mm)
Đối với mẫu cấy mảnh lá (3 x 10 mm), nhận thấy hiệu quả tạo rễ cao nhất ở nghiệm thức có cường độ chiếu sáng 4.000 lux (100% mẫu tạo rễ; 21,96 rễ/mẫu; chiều dài rễ 15,53 mm) so với mẫu cấy ở cường độ chiếu sáng 2.000 lux và điều kiện tối (Bảng 3.20, Hình 3.41). Ở điều kiện chiếu sáng khác nhau, kết quả tạo rễ khác nhau về tỷ lệ % mẫu tạo rễ, số rễ/mẫu, chiều dài rễ (mm).
Bảng 3.20. Ảnh hưởng của điều kiện chiếu sáng đến sự tạo rễ bất định trực tiếp từ mảnh lá (3 x 10 mm), ở môi trường ½MS, 30 NSC.
Tỷ lệ mẫu tạo rễ (%) | Số rễ/mẫu | Chiều dài rễ (mm) | Đặc điểm rễ | |
4.000 | 100a* | 21,96a | 15,53a | Rễ dài, nhiều lông hút, màu trắng đục |
2.000 | 94,44b | 16,19b | 13,43b | Rễ ngắn, nhiều lông hút, màu trắng |
Tối | 91,11c | 14,11c | 14,37c | Rễ ngắn, nhiều lông hút, một số rễ màu hơi vàng |
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt ý nghĩa với p ≤ 0,05 trong phép thử LSD. Số liệu (%) được chuyển đổi sang (x+0,5)1/2 khi xử lý thống kê.
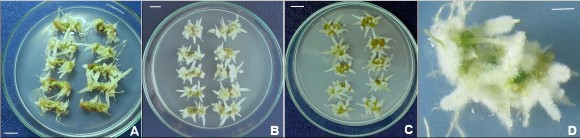
Hình 3.43. Ảnh hưởng của điều kiện chiếu sáng đến sự tạo rễ bất định từ mảnh lá (3 x 10 mm), ở môi trường ½MS, 30 NSC.
A,B,C. Đĩa cấy mảnh lá tạo rễ ở cường độ chiếu sáng 4.000 lux, 2.000 lux, tối; D. Mảnh lá tạo rễ ở môi trường ½MS có 3 mg/L NAA, 4000 lux. Thanh ngang 10 mm. Như vậy, kết quả thí nghiệm cho thấy sự cảm ứng tạo rễ bất định từ mô lá,
hiệu quả cao nhất ở điều kiện chiếu sáng 4000 lux, các chỉ tiêu theo dõi đều có giá trị cao nhất. Trong tự nhiên, sự tạo rễ bất định thuận lợi hơn khi ở điều kiện tối, nhưng trong nuôi cấy mô với điều kiện môi trường tối ưu (khoáng, chất ĐHST,..), nhiều