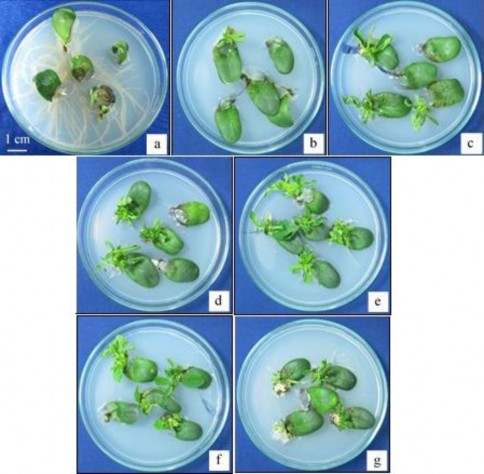
Hình 3.3. Sự hình thành chồi của đốt lá mầm giống MTĐ 176 ở các nồng độ BA khác nhau sau 3 tuần nuôi cấy.
a, b, c, d, e, f, g: đốt lá mầm tái sinh trên môi trường có 0; 0,5; 1; 1,5; 2; 2,5; 3 mg/l BA.
a
c
d
e
f
b
5 mm
Hình 3.4. Sự đáp ứng của đốt lá mầm và một nửa hạt của giống MTĐ 176 ở các nồng độ BA khác nhau sau 3 tuần nuôi cấy.
a, b, c: đốt lá mầm trên môi trường có BA 0; 2; 3 mg/l; d, e, f: một nửa hạt trên môi trường có BA 0; 2; 3 mg/l.
Hình 3.5. Sự hình thành chồi của mẫu một nửa hạt
giống MTĐ 176 ở các nồng độ BA khác nhau sau 3 tuần nuôi cấy.
a, b, c, d, e, f, g: đốt lá mầm tái sinh trên môi trường có 0; 0,5; 1; 1,5; 2; 2,5; 3 mg/l BA.
ảng 3 5. Ảnh hưởng của các nồng độ BA lên sự tái sinh của đốt lá mầm và một nửa hạt giống HL 07-15
Tỉ lệ mẫu tạo chồi (%)1 | Số chồi/mẫu2 | |||
QC1 | QC2 | QC1 | QC2 | |
0 | 0,00 e | 0,00 e | 0,00 e | 0,00 e |
0,5 | 36,67 d | 40,00 d | 0,70 ± 0,17 d | 0,77 ± 0,15 d |
1 | 53,33 c | 56,67 c | 1,57 ± 0,21 c | 1,67 ± 0,25 c |
1,5 | 76,67 b | 73,33 b | 2,73 ± 0,35 b | 2,77 ± 0,31 b |
2 | 96,67 a | 96,67 a | 5,17 ± 0,55 a | 5,30 ± 0,56 a |
2,5 | 96,67 a | 93,33 a | 4,87 ± 0,47 a | 4,80 ± 0,53 a |
3 | 93,33 a | 96,67 a | 4,50 ± 0,46 a | 4,77 ± 0,65 a |
Có thể bạn quan tâm!
-
 Kim Châm Để Tạo Vết Thương Cho Mẫu Chuyển Gen
Kim Châm Để Tạo Vết Thương Cho Mẫu Chuyển Gen -
 Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt
Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt -
 Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro
Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro -
 Sự Tái Sinh Của Đốt Lá Mầm Giống Mtđ 176 Trên Môi Trường Có Ppt.
Sự Tái Sinh Của Đốt Lá Mầm Giống Mtđ 176 Trên Môi Trường Có Ppt. -
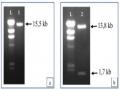
 Tạo Dòng Agrobacterium Tumefaciens Eha 105 Chứa Plasmid Pitb-Ast Ly Trích, Kiểm Tra Plasmid Pitb-Ast Từ E. Coli
Tạo Dòng Agrobacterium Tumefaciens Eha 105 Chứa Plasmid Pitb-Ast Ly Trích, Kiểm Tra Plasmid Pitb-Ast Từ E. Coli -
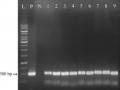
 Chuyển Gen Bằng Vi Khuẩn A. Tumefaciens Sử Dụng Dao Mổ Kết Hợp Sóng Siêu Âm, Thấm Chân Không Tạo Vết Thương Mẫu
Chuyển Gen Bằng Vi Khuẩn A. Tumefaciens Sử Dụng Dao Mổ Kết Hợp Sóng Siêu Âm, Thấm Chân Không Tạo Vết Thương Mẫu
Xem toàn bộ 176 trang tài liệu này.
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 trong phép thử Duncan. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x; số liệu (2) được chuyển sang dạng log(x+1) trước khi xử lý thống kê.

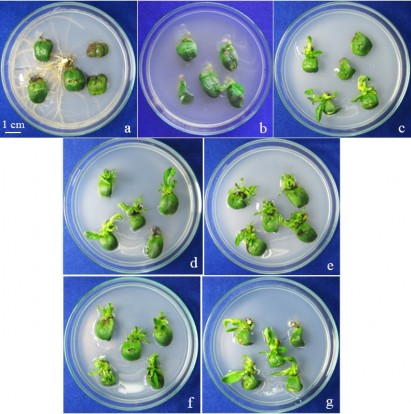
Hình 3.6. Sự hình thành chồi của đốt lá mầm giống HL 07-15 ở các nồng độ BA khác nhau sau 3 tuần nuôi cấy.
a, b, c, d, e, f, g: đốt lá mầm tái sinh trên môi trường có 0; 0,5; 1; 1,5; 2; 2,5; 3 mg/l BA.
ảng 3.6. Ảnh hưởng của các nồng độ BA lên sự tái sinh của đốt lá mầm và một nửa hạt giống OMĐN 29
Tỉ lệ mẫu tạo chồi (%)1 | Số chồi/mẫu2 | |||
QC1 | QC2 | QC1 | QC2 | |
0 | 0,00 e | 0,00 e | 0,00 e | 0,00 e |
0,5 | 36,67 d | 40,00 d | 0,57 ± 0,15 d | 0,67 ± 0,12 d |
1 | 53,33 c | 63,33 c | 1,43 ± 0,25 c | 1,67 ± 0,25 c |
1,5 | 76,67 b | 76,67 b | 2,87 ± 0,40 b | 2,93 ± 0,35 b |
2 | 96,67 a | 96,67 a | 5,03 ± 0,51 a | 5,10 ± 0,56 a |
2,5 | 96,67 a | 93,33 a | 4,63 ± 0,45 a | 4,80 ± 0,44 a |
3 | 93,33 a | 96,67 a | 4,27 ± 0,55 a | 4,70 ± 0,53 a |
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 trong phép thử Duncan. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x; số liệu (2) được chuyển sang dạng log(x+1) trước khi xử lý thống kê.
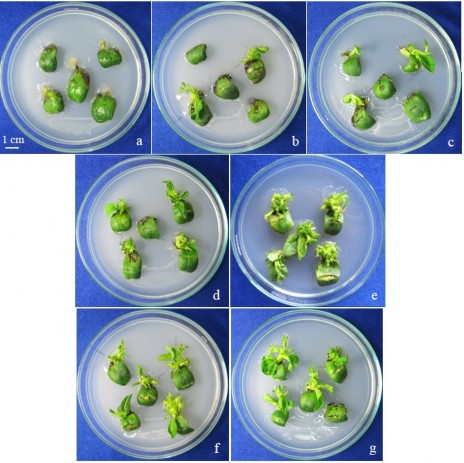
Hình 3.7. Sự hình thành chồi của đốt lá mầm giống OMĐN 29 ở các nồng độ BA khác nhau sau 3 tuần nuôi cấy.
a, b, c, d, e, f, g: đốt lá mầm tái sinh trên môi trường có 0; 0,5; 1; 1,5; 2; 2,5; 3 mg/l BA.
Như vậy, cả mẫu đốt lá mầm và nửa hạt trên 3 giống đều có khả năng đáp ứng tái sinh tốt với sự kích thích tạo chồi bất định của BA. Nồng độ BA tối ưu với cả 3 giống trên đốt lá mầm và nửa hạt là 2 mg/l. Khả năng đáp ứng tái sinh của hai loại mẫu, một nửa hạt và đốt lá mầm, trên cả 3 giống khá giống nhau. Điều này có thể do bản chất của vùng tái sinh trên đốt lá mầm và một nửa hạt giống nhau, đều là vùng mô phân sinh bên (nách). Sự khác nhau về cách xử lý mẫu, thời gian nuôi mẫu (đốt lá mầm từ cây nảy mầm 5 ngày, một nửa hạt từ hạt ngâm trong nước 20 giờ) không ảnh hưởng nhiều đến khả năng tái sinh của vùng này.
Nhiều nghiên cứu trên các giống đậu tương khác nhau cũng ghi nhận nồng độ BA tối ưu cảm ứng tạo chồi từ đốt lá mầm khoảng 2 mg/l [111][127][129]. Khi
sử dụng nồng độ BA tối ưu, khả năng tạo đa chồi được ghi nhận khác nhau giữa các giống, như giống Incasoy-36 (Cuba) có 96,8% mẫu tạo chồi với 4,3 chồi/mẫu [104], giống JS335 (Ấn Độ) có 53,33% mẫu tạo chồi, với 4,66 chồi/mẫu [101], một số giống Trung Quốc có 97,2% mẫu tạo chồi với 13 chồi/mẫu [102]. Hiện tượng khi tăng nồng độ quá mức tối ưu, ảnh hưởng không tốt đến khả năng tạo chồi cũng được nhiều tác giả ghi nhận như Janani và Kumari (2013) khi tăng nồng độ BA từ 15 µM lên 20 µM và 25 µM tỉ lệ tạo chồi và số chồi/mẫu đều giảm từ 53,3% xuống 50% và 43,3% [101]. Soto và cộng sự (2013) cho biết khi tăng nồng độ BA tối ưu từ 1,5 mg/l lên 2; 3; 6 mg/l, tỉ lệ mẫu tạo chồi và số chồi/mẫu đều giảm [104]. Hiện tượng tạo mô sẹo nhiều ở vùng trụ dưới lá mầm khi sử dụng nồng độ BA cao cũng được ghi nhận bởi Ma và Wu (2008) [102]. Trên một số giống cây khác dùng BA để cảm ứng tạo chồi trực tiếp từ mô phân sinh cũng ghi nhận các kết quả tương tự, khi dùng BA ở nồng độ thích hợp sẽ kích thích tạo chồi, khi tăng cao dẫn đến tạo nhiều mô sẹo như trên cumin (thì là) ở 0,2 mg/l kích thích tạo và nhân chồi, còn 0,9 mg/l kích thích tạo mô sẹo [166]. Trên giống cam chua (Citrus aurantium) tái sinh chồi dùng BA cũng ghi nhận khi dùng BA 1 mg/l cảm ứng tạo chồi tốt nhất với 6,7 chồi/mẫu, khi tăng BA lên 2 và 3 mg/l dẫn đến khả năng cảm ứng chồi giảm còn 2,3 và 1,6 chồi/mẫu [167]. Tóm lại, trên cả 3 giống và 2 qui cách mẫu, sử dụng BA ở nồng độ 2 mg/l cho kết quả tái sinh chồi tốt nhất. Do đó nồng độ này sẽ được sử dụng cho các thí nghiệm chuyển gen ở giai đoạn nuôi chung và tái sinh chọn lọc chồi chuyển gen.
3.4. Ảnh hưởng của IBA lên sự tạo rễ của chồi in vitro
Các cụm chồi hình thành trên môi trường tái sinh bổ sung 2 mg/l BA được chuyển sang môi trường tăng trưởng thân SE. Chồi của 3 giống phát triển tốt trên môi trường SE, cao khoảng 3 cm sau 2 tuần. Các chồi này sau đó được tách riêng, cấy lên môi trường tạo rễ.
Kết quả khảo sát ảnh hưởng của IBA đến khả năng tạo rễ của chồi đậu tương in vitro của các giống MTĐ 176, HL 07-15 và OMĐN 29 được trình bày trong bảng 3.7. Ở các nghiệm thức đối chứng không bổ sung IBA, có sự tạo rễ từ chồi ở cả ba giống MTĐ 176 (53,33%), HL 07-15 (46,67%) và OMĐN 29 (43,33%). Tuy nhiên, số rễ
tạo thành ít và kém phát triển, ít rễ nhánh. Khi bổ sung 0,5-1 mg/l IBA, khả năng
74
tạo rễ của chồi tăng dần cả về tỉ lệ chồi tạo rễ và số chồi/rễ, đạt tối ưu với 1 mg/l IBA ở hai giống MTĐ 176 (93,33%; 3,93) và HL07-15 (90,00%; 3,67). Tăng nồng
độ IBA lên 1,5-2 mg/l dẫn đến chồi của hai giống MTĐ 176 và HL 07-15 giảm khả năng tạo rễ, rễ tạo thành ngắn hơn. Đối với giống OMĐN 29, khả năng tạo rễ đạt tối ưu ở 1,5 mg/l IBA, tăng nồng độ lên 2 mg/l mức độ tạo rễ cũng giảm và có sự hình thành mô sẹo (hình 3.8).

Hình 3.8. Sự tạo rễ của chồi in vitro của các giống MTĐ 176, HL 07-15 và OMĐN 29 ở các nồng độ IBA khác nhau sau 3 tuần nuôi cấy.
a, b, c, d, e. sự tạo rễ của chồi MTĐ 176 ở các nồng độ I A tương ứng: 0; 0,5; 1; 1,5; 2 mg/l. f, g. sự tạo rễ của chồi HL 07-15 ở các nồng độ IBA: 0; 1 mg/l. h, i. sự tạo rễ của chồi OMĐN 29 ở các nồng độ IBA: 0; 1,5 mg/l
Như vậy, ở cả ba giống MTĐ 176, HL 07-15 và OMĐN 29, IBA đều có tác động rõ rệt làm tăng khả năng tạo rễ của chồi in vitro. Nồng độ IBA tối ưu cho sự cảm ứng tạo rễ của giống MTĐ 176 và HL 07-15 là 1 mg/l, với giống OMĐN 29 là 1,5 mg/l. Khi nồng độ IBA cao ngược lại làm giảm khả năng tạo rễ, đồng thời có sự cảm ứng tạo nhiều mô sẹo. Nhiều nghiên cứu trên các giống đậu tương trong và ngoài nước cũng ghi nhận khả năng cảm ứng tạo rễ tốt của IBA đối với chồi đậu tương in vitro, nồng độ tối ưu của IBA khoảng 1 mg/l. Nghiên cứu của Nguyễn Thị Thu Hường và cộng sự (2009) trên 2 giống ĐT12 và ĐT84 cho thấy 1 mg/l IBA cảm ứng tạo rễ tốt nhất với tỉ lệ chồi tạo rễ ĐT12 (98%) và ĐT84 (97%), khi tăng nồng độ IBA lên 1,5-2 mg/l đều làm giảm hiệu quả tạo rễ [107]. Zia và cộng sự
75
(2010) cũng nhận thấy 1 mg/l IBA giúp cảm ứng tạo rễ tốt nhất trên cả giống NARC-4 (76,3% chồi tạo rễ; 4,7 rễ/chồi) và NARC-7 (55,3% chồi tạo rễ; 2,2 rễ/chồi), tăng nồng độ IBA dẫn đến giảm khả năng tạo rễ [103].
ảng 3.7. Ảnh hưởng của IBA đến khả năng tạo rễ của chồi đậu tương in vitro
Tỷ lệ chồi tạo rễ (%)1 | Số rễ trung bình/chồi2 | |||||
MTĐ 176 | HL 07-15 | OMĐN 29 | MTĐ 176 | HL 07-15 | OMĐN 29 | |
0,0 | 53,33 d | 46,67 c | 43,33 e | 0,67 ± 0,12 d | 0,53 ± 0,15 e | 0,50 ± 0,10 e |
0,5 | 70,00 bc | 63,33 b | 56,67 d | 2,03 ± 0,35 bc | 1,43 ± 0,15 d | 1,23 ± 0,21 d |
1,0 | 93,33 a | 90,00 a | 73,33 c | 3,93 ± 0,51 a | 3,67 ± 0,40 a | 2,20 ± 0,36 c |
1,5 | 76,67 b | 83,33 a | 96,67 a | 2,57 ± 0,35 b | 2,70 ± 0,36 b | 4,23 ± 0,40 a |
2,0 | 56,67 cd | 66,67 b | 86,67 b | 1,57 ± 0,25 c | 1,90 ± 0,26 c | 2,83 ± 0,25 b |
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 theo kiểm định thống kê LSD. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x; số liệu (2) được chuyển sang dạng log(x+1) trước khi xử lý thống kê.
Nội dung 2: Khảo sát các điều kiện thích hợp để ứng dụng trong qui trình chuyển gen tạo astaxanthin vào đậu tương
3.5. Ảnh hưởng của PPT lên khả năng tái sinh của đốt lá mầm và một nửa hạt
Đốt lá mầm của 3 giống đậu tương HL 07-15, OMĐN 29 và MTĐ 176 được tái sinh trên môi trường SI bổ sung chất chọn lọc PPT ở các nồng độ khác nhau để xác định mức độ ảnh hưởng lên khả năng tạo chồi của mẫu, từ đó chọn được nồng độ PPT thích hợp cho việc chọn lọc chồi chuyển gen. Sử dụng chất chọn lọc thích hợp là một trong những yếu tố quan trọng, góp phần quyết định tỉ lệ cây chuyển gen nhận được. Kết quả mức ảnh hưởng được ghi nhận ở bảng 3.8, hình 3.9.
Nhìn chung, các kết quả ghi nhận được cho thấy các giống khảo sát đều có đáp ứng khá nhạy cảm với PPT ở mức độ tương tự nhau trong sự hình thành chồi của đốt lá mầm. Ở nghiệm thức đối chứng không bổ sung PPT, hầu hết mẫu đốt lá mầm tạo nhiều chồi, các chồi phát triển tốt. Khi bổ sung PPT vào môi trường ở nồng độ thấp 1; 2 mg/l đã cho thấy mức độ tác động nhẹ, làm giảm khả năng tạo chồi nhưng không đáng kể. Các chồi hình thành vẫn có thể tiếp tục phát triển. Tăng nồng độ PPT lên 3; 4 mg/l đã ảnh hưởng rõ rệt, làm giảm đáng kể tỉ lệ mẫu tạo chồi
và số chồi/mẫu, chồi kém phát triển. Ở nồng độ 5 mg/l tất cả các mẫu của giống HL 07-15, OMĐN 29 đều không có khả năng tạo chồi, chỉ một số ít mẫu giống MTĐ 176 có sự hình thành chồi trong thời gian ngắn, sau đó chết dần.
ảng 3.8. Ảnh hưởng PPT lên sự tái sinh chồi của đốt lá mầm.
Tỉ lệ đốt lá mầm tái sinh chồi (%)1 | |||
MTĐ 176 | HL 07-15 | OMĐN 29 | |
0 | 90,00 a | 93,33 a | 93,33 a |
1 | 73,33 b | 66,67 b | 73,33 b |
2 | 56,67 c | 46,67 c | 66,67 c |
3 | 43,33 d | 33,33 d | 46,67 d |
4 | 26,67 e | 13,33 e | 26,67 e |
5 | 13,33 f | 0,00 f | 0,00 f |
6 | 0,00 g | 0,00 f | 0,00 f |
7 | 0,00 g | 0,00 f | 0,00 f |
8 | 0,00 g | 0,00 f | 0,00 f |
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 trong phép thử Duncan. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x trước khi xử lý thống kê.
Với các nồng độ 6; 7; 8 mg/l, tất cả các mẫu đều không còn khả năng tạo chồi, vùng đốt lá mầm bị nâu đen và chết dần. Như vậy 5 mg/l PPT đối với giống HL 07-15, OMĐN 29 và 6 mg/l PPT đối với giống MTĐ 176 là nồng độ thấp nhất có thể ức chế hoàn toàn khả năng tạo chồi của đốt lá mầm, do đó là nồng độ sẽ được sử dụng để chọn lọc thể chuyển gen. Chất chọn lọc PPT được sử dụng ở ngưỡng ức chế tái sinh trong quá trình chọn lọc thể chuyển gen nhằm hạn chế việc tạo mẫu khảm, "escape" (không chuyển gen nhưng qua được bước chọn lọc). Các kết quả ảnh hưởng của PPT lên đốt lá mầm được áp dụng cho mẫu một nửa hạt do một nửa hạt và đốt lá mầm đều có bản chất là vùng mô phân sinh nách và có đáp ứng kích thích tạo chồi tương tự nhau.