tế bào bắt đầu. Tiếp theo là giai đoạn tăng trưởng, ở giai đoạn này các tế bào phân chia và tăng khối lượng với tốc độ lớn nhất (số lượng tế bào tăng lên theo hàm số mũ). Sau giai đoạn tăng trưởng là giai đoạn cân bằng, sự sinh trưởng của tế bào diễn ra ổn định, số lượng tế bào sinh ra bằng số lượng tế bào chết đi. Cuối cùng là giai đoạn suy vong, sự sinh trưởng của tế bào giảm xuống và dẫn đến ngừng sinh trưởng nếu không được cấy chuyền [7].
Phát sinh phôi vô tính
Phôi vô tính chứa chất dinh dưỡng tương tự như phôi hữu tính, có mầm chóp rễ và chồi đỉnh nên có thể nảy mầm trực tiếp thành cây. Các mô và cơ quan sinh dưỡng nuôi cấy in vitrotạo ra phôi vô tính thông qua quá trình tạo mô sẹo trung gian. Tế bào mô sẹo có thể phân chia theo cấp số nhân, nhờ vậy, chỉ sau một thời gian ngắn có thể tạo được một số lượng phôi đáng kể. Cho đến nay, trên 200 loài cây trồng đã được nhân giống thành công bằng công nghệ phôi vô tính. Phôi vô tính có thể bảo quản lâu dài và cho nảy mầm vào thời vụ thích hợp. Công nghệ tạo phôi vô tính hiện vẫn đang là công nghệ tiên tiến trên thế giới [19].
Sự tái sinh thực vật thông qua con đường phát sinh phôi vô tính bao gồm 5 giai đoạn [10]:
- Nuôi cấy tạo phôi bằng cách chọn lựa mẫu cấy sơ cấp và cấy vào môi trường bổ sung chất điều hoà sinh trưởng, chủ yếu là auxin (đôi khi là cytokinin).
- Tăng sinh của quá trình nuôi cấy phôi trên môi trường rắn hoặc lỏng có bổ sung chất điều hoà sinh trưởng tương tự như trên.
- Giai đoạn trước khi trưởng thành của phôi trong môi trường không có chất điều hoà sinh trưởng để ngăn sự tăng sinh và kích thích sự tạo phôi.
- Giai đoạn phôi trưởng thành bằng cách nuôi cấy phôi trong môi trường bổ sung ABA và/hoặc giảm áp lực thẩm thấu.
- Sự phát triển của cây trên môi trường nuôi cấy không có chất điều hoà sinh trưởng.
Phôi vô tính được sử dụng trong các nghiên cứu phôi học và kỹ thuật di truyền. Tuy nhiên, quan trọng nhất là ứng dụng thực tiễn của chúng trong nhân giống thực vật với số lượng lớn do mô sẹo có thể tăng theo cấp số nhân hoặc có thể nuôi trong
Có thể bạn quan tâm!
-
 Nghiên cứu tác động của nano bạc và nano sắt lên chất lượng cây giống in vitro ở một số cây trồng có giá trị kinh tế - 1
Nghiên cứu tác động của nano bạc và nano sắt lên chất lượng cây giống in vitro ở một số cây trồng có giá trị kinh tế - 1 -
 Nghiên cứu tác động của nano bạc và nano sắt lên chất lượng cây giống in vitro ở một số cây trồng có giá trị kinh tế - 2
Nghiên cứu tác động của nano bạc và nano sắt lên chất lượng cây giống in vitro ở một số cây trồng có giá trị kinh tế - 2 -
 Tác Nhân Khử Trùng, Nồng Độ Kết Hợp Với Thời Gian Xử Lý Trong Khử Trùng Mẫu Cấy
Tác Nhân Khử Trùng, Nồng Độ Kết Hợp Với Thời Gian Xử Lý Trong Khử Trùng Mẫu Cấy -
 Ứng Dụng Nano Kim Loại Trong Vi Nhân Giống Thực Vật
Ứng Dụng Nano Kim Loại Trong Vi Nhân Giống Thực Vật -
 Hấp Thu, Vận Chuyển Và Chuyển Hóa Nano Kim Loại Trong Cây
Hấp Thu, Vận Chuyển Và Chuyển Hóa Nano Kim Loại Trong Cây -
 Nghiên Cứu Ảnh Hưởng Của Agnps Lên Khử Trùng Bề Mặt Và Cảm Ứng Mẫu Cấy
Nghiên Cứu Ảnh Hưởng Của Agnps Lên Khử Trùng Bề Mặt Và Cảm Ứng Mẫu Cấy
Xem toàn bộ 195 trang tài liệu này.
hệ thống bioreactor. Hơn nữa, phôi vô tính có thể được sử dụng làm phôi sinh dưỡng trong công nghệ hạt nhân tạo; hoặc được trữ lạnh, từ đó có thể thiết lập ngân hàng gene, giúp cải thiện chất lượng cây trồng (loại trừ virus, chọn lọc tế bào, tái sinh từ các thực vật chuyển gene, tạo ra các dòng đồng hợp tử và đa bội) [163].
- Sự loại trừ virus: phôi vô tính có một hệ mạch dẫn rất phát triển, tuy nhiên hệ thống này không nối với mạch dẫn của mô cấy. Điều này có nghĩa là việc tạo phôi vô tính cũng có thể giúp để tạo các dòng cây sạch virus, có thể kết hợp với biện pháp sốc nhiệt để đạt được kết quả tốt hơn.
- Sự chọn lọc tế bào: quá trình hình thành phôi vô tính cho phép tái tạo nên những cây hoàn chỉnh có nguồn gốc từ các tế bào đơn, từ đó ứng dụng trong các chương trình chọn lọc tế bào để thu nhận những đặc tính mong muốn.
- Sự tái sinh từ các thực vật chuyển gene: sự chuyển gene vào các tế bào phôi vô tính đạt hiệu quả cao, quá trình tái sinh xảy ra nhanh và dễ kiểm soát.
- Sự tạo ra các dòng đồng hợp tử và đa bội: quá trình hình thành phôi vô tính cũng tạo ra những dòng đa bội (xử lý colchicine hoặc amiprophos-methyl), hoặc nuôi cấy các mẫu cấy như hạt phấn, bào tử cũng có thể tạo ra những cây đơn bội.
Đến nay, có rất nhiều báo cáo nghiên cứu liên quan đến quá trình phát sinh hình thái trong vi nhân giống. Đặc biệt, trên các đối tượng cây salem, dâu tây và sâm Ngọc Linh các nghiên cứu này thường tập trung vào ảnh hưởng của nguồn mẫu, chất điều hòa sinh trưởng, điều kiện nuôi cấy lên quá trình cảm ứng mô sẹo, tái sinh chồi, nhân nhanh chồi, nuôi cấy huyền phù tế bào và phát sinh phôi (Bảng 1.3).
Bảng 1.3. Một số nghiên cứu phát sinh hình thái trên cây salem, dâu tây, sâm Ngọc Linh
Loài thực vật Yếu tố ảnh hưởng Vai trò Nguồn
Salem (Limonium sinuatum L. Mill.)
1 mg/L NAA;
1 mg/L BAP
Cảm ứng, tăng sinh chồi [83]
1 mg/L picloram Cảm ứng mô sẹo xốp [78] 1 mg/L picloram Nuôi cấy huyền phù tế
bào
1 mg/L zeatin Tái sinh chồi
Dâu tây (Fragaria
× ananassa Duch. “Osogrande”)
Dâu tây (Fragaria
× ananassa Duch. “Chandler, Toro, Islamabad”)
Dâu tây (Fragaria
× ananassa Duch.)
Dâu tây (Fragaria
× ananassa Duch. “Chandler”)
Sâm Ngọc Linh (Panax vietnamensis Ha et Grushv.)
0,8 mg/L Kinetin;
0,2 mg/L NAA
0,6 mg/L Kinetin;
0,2 mg/L NAA
0,5 mg/L BAP;
0,75 mg/L NAA
2 mg/L BAP;
0,25 mg/L NAA;
0,5 mg/L Kinetin
0,5 mg/L BAP;
0,5 mg/L Kinetin;
1 mg/L GA3
0,1 mg/L BA;
0,1 mg/L IAA;
2 mg/L 2,4-D;
100 mg/L myo- inositol;
25 mg/L AgNO3;
50 mg/L Fe-EDTA
1 mg/L 2,4-D;
1 mg/L BAP
2,5 mg/L BAP;
0,5 mg/L NAA
1 mg/L 2,4-D;
0,2 mg/L kinetin;
0,5 mg/L NAA;
0,1 mM spermidin;
300 mg/L proline;
50 g/L sucrose
Nhân chồi [111]
Nhân chồi
Cảm ứng mô sẹo [82] Tái sinh chồi
Phát triển chồi
Cảm ứng mô sẹo [112]
Cảm ứng mô sẹo [123] Tái sinh chồi
Phát sinh phôi vô tính [119]
0,05 mg/L TDZ Phát sinh phôi vô tính [118]
1 mg/L BA;
0,1 mg/L 2,4-D
Tái sinh chồi
1 mg/L 2,4-D Cảm ứng mô sẹo [116]
0,1 mg/L TDZ trong tối
2 mg/L NAA trong tối
1 mg/L BA trong sáng
Phát sinh phôi
Hình thành rễ bất định Tái sinh chồi
1.1.2.3. Cây hoàn chỉnh và thích nghi vườn ươm
Ra rễ in vitro
Trong vi nhân giống, ra rễ in vitro là một giai đoạn quan trọng. Đây là giai đoạn dẫn đến những thay đổi về cấu trúc lớn nhất của các mô lá như sự dày lên của lớp biểu bì và thành tế bào, cải thiện các chức năng sinh lý của khí khổng; do đó, thúc đẩy quá trình thích nghi và tăng khả năng sống sót ngoài vườn ươm của cây mô [17]. Sự hình thành rễ in vitro giúp cây đứng vững, hút nước, chất dinh dưỡng để sinh trưởng, phát triển; thích nghi ở điều kiện vườn ươm; nâng cao hiệu suất trao đổi chất, giúp cây sinh trưởng nhanh chóng và sinh sản ở giai đoạn ex vitro. Chồi in vitro nếu không được cảm ứng tạo rễ sẽ không thể sống sót khi đưa ra điều kiện vườn ươm. Vì vậy, dù các giai đoạn trước giai đoạn ra rễ được thực hiện tốt mà không trải qua giai đoạn cảm ứng hình thành rễ và thích nghi thì vi nhân giống không có ý nghĩa. Do đó đã có nhiều nghiên cứu được thực hiện trên các đối tượng cây salem, dâu tây và sâm Ngọc Linh để cải thiện khả năng ra rễ của chồi in vitro như bổ sung auxin nhân tạo, than hoạt tính hoặc cyclodextrine vào môi trường nuôi cấy (Bảng 1.4). Hầu hết các nghiên cứu này đều cho tỷ lệ ra rễ không cao, không đồng đều và bị đứt gãy khi có
tác động cơ học.
Thích nghi vườn ươm
Trong nuôi cấy in vitro, các cây con được nuôi cấy trong điều kiện tối ưu; nhưng khi thuần hoá ở giai đoạn ex vitro, các cây này gặp rất nhiều điều kiện bất lợi từ môi trường. Do đó, việc theo dõi sự sinh trưởng và phát triển của cây giống ở giai đoạn ex vitro là điều vô cùng cần thiết nhằm đánh giá được chất lượng cây giống của quá trình nuôi cấy in vitro.
Bảng 1.4. Một số nghiên cứu hình thành cây con hoàn chỉnh của cây salem, dâu tây, sâm Ngọc Linh
Loài thực vật Yếu tố ảnh hưởng Nguồn
Salem (Limonium sinuatum L. Mill.) 1 mg/L NAA [83]
0,4 mg/L NAA [59]
Salem (Limonium perezii Hubbard.) 0,5 mg/L IBA [93]
Dâu tây (Fragaria × ananassa
Duch. “Chandler”)
Dâu tây (Fragaria × ananassa
Duch.)
0,25 mg/L IBA;
20 mg/L sucrose
1 mg/L IBA;
0,2 mg/L than hoạt tính
[123]
[82]
Sâm Ngọc Linh (Panax vietnamensis
Ha et Grushv.)
2 mg/L NAA [119]
1.1.3. Một số hạn chế trong vi nhân giống thực vật
1.1.3.1. Tích luỹ khí ethylene Giới thiệu chung
Khí ethylene được biết đến nhiều nhất trong vai trò làm chín hoa quả [45]. Ngoài ra, ethylene còn là một loại hormone thực vật dạng khí có ảnh hưởng đến nhiều quá trình sinh lý thực vật bao gồm: cảm ứng mô sẹo, phát sinh phôi, nuôi cấy huyền phù tế bào, tái sinh chồi, hình thành rễ, sự rụng lá, ra hoa, lão hoá [92]. Quá trình sinh tổng hợp ethylene được điều chỉnh chặt chẽ bởi các tín hiệu nội sinh và ngoại sinh (sự tấn công từ các mầm bệnh, tạo vết thương, thiếu oxy, ozone, làm lạnh hoặc đông lạnh) [92].
Con đường sinh tổng hợp khí ethylene trong thực vật
Thực vật tổng hợp ethylene theo con đường sinh hóa được mô tả bởi Houben và Van de Poel (2019) [76]. Tiền thân của con đường sinh tổng hợp ethylene là amino acid methionine. Methionine được chuyển đổi thành SAM (S-adenosyl-L- methionine) nhờ enzyme ACS (ACC-Synthase) và cần năng lượng ATP (Adenozin triphotphat). SAM được chuyển đổi thành ACC (1-aminocyclopropane-1-carboxylic acid) và MTA (methylthioadenosine) - sản phẩm phụ của phản ứng được dùng để tái sinh methionine theo chu kỳ Yang tránh sự cạn kiệt methionine trong quá trình sản
xuất nhiều ethylene bởi enzyme ACS. Sau đó, ACC được khuếch tán đến các cơ quan, bộ phận khác nhau trong cây, và được chuyển hóa thành ethylene nhờ enzyme ACO (ACC-oxidase) (Hình 1.1).
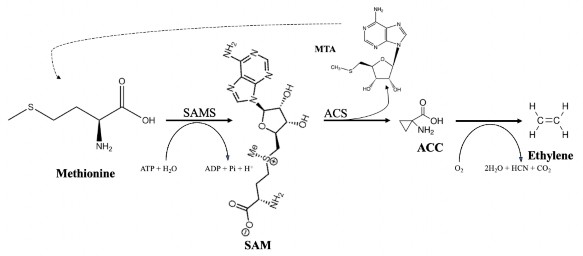
Hình 1.1. Con đường sinh tổng hợp khí ethylene trong thực vật
Con đường dẫn truyền tín hiệu ethylene trong thực vật
Con đường truyền tín hiệu ethylene trong thực vật được mô tả bởi Azhar và cộng sự (2019) [28]. Ethylene được nhận dạng bởi một nhóm 5 thụ thể trong màng tương đồng với histidine kinase của vi khuẩn liên quan đến việc nhận biết những thay đổi môi trường. ETR1 (ethylene response1) và ERS1 (ethylene response sensor1) chứa ba miền xuyên màng và một miền histidine kinase đã được chứng minh là hoạt động như các homodimers. ETR2 (ethylene response2), EIN4 (ethylene insensitive4) và ERS2 (ethylene response sensor2) có bốn vùng xuyên màng và miền histidine kinase đã bị thoái hóa. Chỉ ETR1, ETR2 và EIN4 có miền nhận tại C-terminal. Liên kết ethylene xảy ra tại miền xuyên màng N-terminal của các thụ thể, và một ion đồng (Cu) là cần thiết cho liên kết. Trong trường hợp không có tín hiệu ethylene, các CTR1 (constitutive triple response1) liên kết với các thụ thể và EIN2 (ethylene insensitive2), dẫn đến không kích hoạt được phản ứng ethylene. Trong trường hợp có ethylene liên kết với các thụ thể làm việc vô hiệu hóa CTR1, cho phép EIN2 hoạt động như một bộ điều chỉnh tích cực của con đường sinh ethylene. EIN2 chứa N-terminal tương tự như protein vận chuyển kim loại Nramp và C-terminal. EIN2 truyền tín hiệu tích cực xuống EIN3 (ethylene insensitive3) là các yếu tố phiên mã nằm trong nhân. EIN3
liên kết với gen khởi động ERF1 (ethylene response factor1) và kích hoạt quá trình phiên mã theo cách phụ thuộc ethylene. Các yếu tố phiên mã ERF1 và các EREBP (ethylene responsive element binding protein) khác có thể tương tác với các gene khởi động mục tiêu và kích hoạt phản ứng ethylene tiếp theo (Hình 1.2).
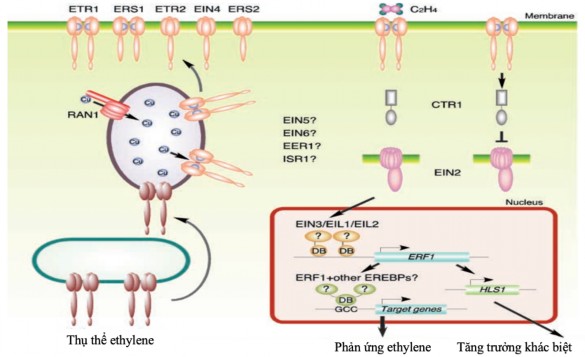
Hình 1.2. Con đường truyền tín hiệu ethylene trong thực vật
1.1.3.2. Hoá nâu mẫu cấy
Một số thực vật vi nhân giống cũng thường xuất hiện hiện tượng hóa nâu mẫu cấy cũng như hóa nâu môi trường nuôi cấy. Đôi khi tình trạng hóa nâu trở nên nghiêm trọng đến mức mẫu cấy chuyển màu nâu sẫm/đen, hoại tử và cuối cùng chết. Các nhà khoa học cho rằng sự sản sinh phenol trong suốt quá trình nuôi cấy gây oxy hóa và làm cho mẫu, môi trường hóa nâu. Các sản phẩm oxy hóa của phenol có thể là độc tố thực vật. Mức độ hóa nâu phụ thuộc vào loài thực vật nuôi cấy, kiểu gene, độ tuổi của mô cấy (mô già hơn cho thấy khả năng bị hóa nâu cao hơn), mùa nuôi cấy (nhiều hơn vào mùa đông và mùa thu) và thành phần của môi trường. Một phương pháp đơn giản để bảo vệ các mẫu cấy khỏi sự hóa nâu là cấy chuyền thường xuyên ở giai đoạn nuôi cấy ban đầu; giảm sự oxy hóa phenol bằng phương pháp nuôi cấy trong tối; giảm nồng độ muối của môi trường; bổ sung các chất bổ trợ như acid ascorbic, cystein- HCl hoặc acid citric (chất chống oxy hoá), polyvinylpyrolidone và than hoạt tính giúp
hấp thụ phenol [164], do đó kiểm soát được tình trạng hóa nâu; acid ascorbic chỉ có hiệu quả nếu nó được thêm vào bề mặt môi trường và không có hiệu quả nếu đưa vào môi trường trước khi hấp. Tuy nhiên, các chất hấp phụ này có thể hấp thu luôn cả các hợp chất cần thiết cho thực vật từ môi trường, do đó việc sử dụng loại và nồng độ của chúng nên được lựa chọn một cách thận trọng [40].
![]() NANO KIM LOẠI
NANO KIM LOẠI
1.2.1. Giới thiệu chung
Vật liệu nano được phát hiện và công nhận vào những năm đầu thập niên 50 của thế kỷ XIX, có kích thước nằm trong phạm vi từ 1 – 100 nm [60]. Dựa trên nguồn gốc có thể chia các hạt nano thành 3 loại là nano tự nhiên, nano ngẫu nhiên và nano nhân tạo. Các nano tự nhiên tồn tại kể từ khi trái đất hình thành, những hạt này có trong bụi đất, bụi mặt trăng, các khoáng vật, phản ứng quang hóa, cháy rừng và xói mòn. Nano ngẫu nhiên được tạo ra bởi quy trình công nghiệp nhân tạo như xả xăng/dầu diesel, đốt than, khói hàn và xả thải công nghiệp. Các nano nhân tạo có thể được chia thành 5 loại: nano carbon, nano kim loại, nano từ, nano dendrimers. Trong đó, nano kim loại được nghiên cứu sản xuất và ứng dụng rộng rãi trong nhiều lĩnh vực: y học, môi trường, năng lượng, điện tử, khoa học đời sống bao gồm cả khoa học cây trồng [113], [110]. Nano kim loại là các hạt nano có cấu trúc nano core-shell. Phần lõi (core) là các nguyên tử kim loại hóa trị không (như kim loại Au, Ag, Cu, Fe, Ni, Mo, Zn,...). Phần vỏ phủ (shell) có thể là các chitosan, lớp mỏng nano (nano silica, nano vàng,...), các oxide/hydroxide kim loại, carboxymethyl cellulose, glycerin, citrate, citric, polyvinylalcol, polyethylene glycol, polyvinylpyrolidone. Tùy vào phương pháp tổng hợp và đối tượng áp dụng mà có thể sử dụng các chất ổn định và vùng lõi phù hợp, giúp các hạt nano được phân tán trong môi trường đạt hiệu quả cao [121]. Do kích thước hạt nano kim loại vô cùng nhỏ (<100 nm) nên số nguyên tử nằm trên bề mặt của vật liệu nano cao hơn rất nhiều so với các vật liệu khối và mỗi nguyên tử được tự do tương tác với môi trường xung quanh đóng vai trò như các tâm hoạt động, chính vì vậy các vật liệu nano thường có hoạt tính hóa học cao [71].
Trong lĩnh vực khoa học cây trồng, vật liệu nano đã và đang là một công cụ đầy hứa hẹn thúc đẩy một kỷ nguyên mới của các phương thức canh tác cây trồng