85
khuẩn chỉ bám trên lớp biểu mô bên ngoài. Trên đậu tương, nhiều nghiên cứu chuyển gen sử dụng các loại mẫu khác nhau (lá mầm non, đốt lá mầm) đã ghi nhận xử lý thấm hút chân không giúp tăng đáng kể hiệu quả chuyển gen thông qua vi khuẩn Agrobacterium [133][134]. Ngoài ra, nghiên cứu trên các đối tượng khác như: lúa mì, lúa gạo, cà phê, cà rốt... cũng cho thấy kết quả tương tự [173][174][175][176]. Như vậy, sử dụng thấm hút chân không trong qui trình chuyển gen có thể được áp dụng nhằm cải thiện, nâng cao hơn hiệu quả chuyển gen vào thực vật bằng vi khuẩn A. tumefaciens.
Nội dung 3: Chuyển gen tạo astaxanthin vào đậu tương gián tiếp thông qua vi khuẩn A. tumefaciens và kiểm tra, đánh giá các dòng đậu tương chuyển gen.
3.10. Tạo dòng Agrobacterium tumefaciens EHA 105 chứa plasmid pITB-AST Ly trích, kiểm tra plasmid pITB-AST từ E. coli
Vi khuẩn E. coli mang plasmid pITB-AST bảo quản ở -80oC được cấy vào
đĩa petri chứa môi trường LB rắn có bổ sung kháng sinh chọn lọc kanamycin ở nồng độ 100 mg/l. Sau hai ngày ủ, một số khuẩn lạc màu trắng, rời rạc xuất hiện, cấy chuyền một khuẩn lạc phát triển tốt vào môi trường LB lỏng có bổ sung kháng sinh chọn lọc kanamycin 50 mg/ml, lắc 220 vòng/phút qua đêm ở 37oC. Dịch vi khuẩn phát triển tốt được sử dụng để ly trích plamid và kiểm tra bằng cách cắt bởi enzyme giới hạn tại một điểm (với EcoRI) hoặc 2 điểm (với EcoRI và HindIII).
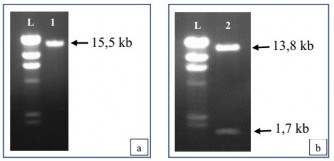
Sản phẩm sau khi cắt được điện di trên gel agarose (hình 3.14) cho thấy sản phẩm cắt plasmid tại 1 điểm là một băng DNA có kích thước khoảng 15,5 kb; sản phẩm cắt plasmid tại 2 điểm gồm 1 băng DNA có kích thước khoảng 13,8 kb và 1 băng DNA có kích thước khoảng 1,7 kb.
Có thể bạn quan tâm!
-
 Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro
Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro -
 Sự Hình Thành Chồi Của Đốt Lá Mầm Giống Mtđ 176 Ở Các Nồng Độ Ba Khác Nhau Sau 3 Tuần Nuôi Cấy.
Sự Hình Thành Chồi Của Đốt Lá Mầm Giống Mtđ 176 Ở Các Nồng Độ Ba Khác Nhau Sau 3 Tuần Nuôi Cấy. -
 Sự Tái Sinh Của Đốt Lá Mầm Giống Mtđ 176 Trên Môi Trường Có Ppt.
Sự Tái Sinh Của Đốt Lá Mầm Giống Mtđ 176 Trên Môi Trường Có Ppt. -
 Chuyển Gen Bằng Vi Khuẩn A. Tumefaciens Sử Dụng Dao Mổ Kết Hợp Sóng Siêu Âm, Thấm Chân Không Tạo Vết Thương Mẫu
Chuyển Gen Bằng Vi Khuẩn A. Tumefaciens Sử Dụng Dao Mổ Kết Hợp Sóng Siêu Âm, Thấm Chân Không Tạo Vết Thương Mẫu -
 Dòng Chuyển Gen D2 (A) Và D8 (B) Phát Triển Ngoài Vườn Ươm
Dòng Chuyển Gen D2 (A) Và D8 (B) Phát Triển Ngoài Vườn Ươm -
 So Sánh Kiểu Hình Cây Chuyển Gen Và Cây Đối Chứng.
So Sánh Kiểu Hình Cây Chuyển Gen Và Cây Đối Chứng.
Xem toàn bộ 176 trang tài liệu này.
Hình 3.14. Kết quả điện di sản phẩm cắt plasmid ly trích từ E. coli.
a: cắt plasmid tại một điểm, b: cắt plasmid tại hai điểm (L: thang chuẩn DNA - HindIII, 1, 2: plasmid được cắt bằng các enzyme cắt giới hạn)
Từ các sản phẩm cắt tương ứng với kích thước thiết kế của plasmid pITB- AST, có thể khẳng định plasmid được kiểm tra là plasmid pITB-AST.
Biến nạp plasmid pITB-AST vào vi khuẩn Agrobacterium tumefaciens
Dòng vi khuẩn Agrobacterium tumefaciens EHA 105 được thực hiện biến nạp plasmid pITB-AST và chọn lọc trên môi trường có bổ sung kháng sinh kanamycin và rifamycin ở nồng độ 50 mg/l. Kết quả thu được các dòng vi khuẩn Agrobacterium tumefaciens EHA 105 kháng kháng sinh tốt (hình 3.15).
2 mm
Hình 3.15. Các khuẩn lạc vi khuẩn Agrobacterium tumefaciens biến nạp sau khi ủ qua đêm trên môi trường có kháng sinh.
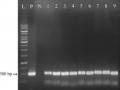
Các dòng vi khuẩn kháng kháng sinh được ly trích plasmid và kiểm tra sự hiện diện của gen hbfd1, bằng kỹ thuật PCR với các mồi đặc hiệu.
L 1 2 3
Sản phẩm PCR sau khi điện di trên gel cho thấy có sự hiện diện của băng khuếch đại DNA với kích thước 400 bp (hình 3.16) phù hợp với kích thước mục tiêu của gen hbfd1 trên plasmid pITB-AST. Kết quả này khẳng định các dòng vi khuẩn kháng đã biến nạp thành công plasmid pITB-AST và có thể sử dụng để chuyển gen vào đậu tương.
![]()
400 bp
Hình 3.16. Kết quả điện di sản phẩm PCR gen hbfd1 từ plasmid của vi khuẩn E. coli và A. tumefaciens.
L: Thang chuẩn DNA 1 kb (Promega), 1: plasmid từ E. coli, 2: mẫu nước PCR, 3: plasmid từ A. tumefaciens
3.11. Chuyển gen tạo cây đậu tương có khả năng sản xuất astaxanthin chuyên biệt ở hạt
Đậu tương là cây trồng nhận được nhiều quan tâm trong nghiên cứu cải tạo, nâng cao chất lượng giống. Các nghiên cứu chuyển gen mang nhiều đặc tính khác nhau vào giống cây trồng này đã được thực hiện bởi nhiều tác giả trên thế giới. Tuy nhiên, hiệu quả chuyển gen vào đậu tương còn thấp và phụ thuộc nhiều vào giống. Trong nghiên cứu này, một số yếu tố giúp cải thiện hiệu quả tạo vết thương, tăng khả năng tiếp xúc giữa vi khuẩn và mẫu được tối ưu hóa nhằm nâng cao khả năng chuyển gen gồm sử dụng kim châm nhiều mũi, sóng siêu âm, thấm hút chân không.
Kim châm nhiều mũi được nghiên cứu sử dụng tạo vết thương để thay thế phương pháp thông thường dùng dao mổ. Cách sử dụng kim châm được tối ưu hóa dựa trên yếu tố kết hợp giữa khả năng tạo vết thương và tần số tái sinh của mẫu đốt lá mầm. So sánh hiệu quả chuyển gen của hai phương pháp bằng số thể chuyển gen dương tính Southern blot/số mẫu xử lý.
Bên cạnh phương pháp sử dụng kim châm, các phương pháp tạo vết thương tiềm năng khác cũng được nghiên cứu, gồm sử dụng dao mổ cắt nhẹ vùng mô phân sinh 5 lần kết hợp với sóng siêu âm hoặc thấm hút chân không. Cách thức sử dụng sóng siêu âm hoặc thấm hút chân không được tối ưu bằng cách đánh giá hiệu quả chuyển gen gus vào vùng đốt lá mầm với các thông số khác nhau. Phương pháp đánh giá này chính xác hơn so với dựa vào hiệu quả tái sinh (sử dụng để tối ưu hóa cách dùng kim châm) do kết hợp thêm hiệu quả chuyển gen đánh dấu. Sau đó, các thông số tối ưu sẽ được áp dụng trong qui trình chuyển gen mục tiêu tạo astaxanthin vào đốt lá mầm đậu tương.
3.11.1. Chuyển gen bằng vi khuẩn A. tumefaciens sử dụng kim châm tạo vết thương mẫu
Thông thường, dao mổ được sử dụng để cắt nhẹ lên vùng đốt lá mầm 7-10 lần [127][177][178] để tạo vết thương, tuy nhiên việc này khó thực hiện đồng nhất và có thể gây ra những tổn thương mô lớn. Để khắc phục những hạn chế của phương pháp trên, chúng tôi nghiên cứu phương pháp sử dụng kim châm nhiều mũi tạo vết thương cho đốt lá mầm từ cây nảy mầm 5 ngày nhằm tạo được bề mặt vết thương lớn nhưng sự
tổn thương mô thấp, qua đó có thể giúp quá trình xâm nhiễm, chuyển gen của vi khuẩn
A. tumefaciens hiệu quả hơn mà vẫn giữ được khả năng tái sinh cao của mẫu.
3.11.1.1. Tái sinh chọn lọc cây kháng PPT
Đốt lá mầm của 3 giống đậu tương MTĐ 176, HL 07-15, và OMĐN 29 được tạo vết thương bằng kim châm và dao mổ trước khi gây nhiễm với vi khuẩn A. tumefaciens. Sau 4 tuần nuôi cấy trên môi trường tái sinh SI bổ sung chất chọn lọc, hầu hết mẫu đều bị chết. Một số ít có sự tạo thành chồi, tuy nhiên nhiều chồi chỉ được tạo thành và phát triển trong thời gian ngắn. Điều này có thể do những mô lân cận được biến nạp gen và bảo vệ chéo khi các chồi chưa lớn và chưa tách rời khỏi lá mầm. Khi tách khỏi lá mầm và chuyển sang môi trường tăng trưởng thân SE với 4 mg/l PPT. Đối với hai giống HL 07-15, OMĐN 29, tất cả cụm chồi còn sót lại trên môi trường SI đều chết dần và không nhận được cây chuyển gen. Với giống MTĐ 176, hầu hết các cụm chồi cũng chết dần, chỉ một số ít tiếp tục phát triển. Các chồi này khi cao khoảng 3 cm được cấy chuyền sang môi trường tạo rễ RM bổ sung 1 mg/l PPT. Sau đó, cây được chuyển ra trồng trong vườn ươm để tiếp tục theo dõi và đánh giá (hình 3.17).
a
b
c
0,5 cm
0,5 cm
2 mm
d
e
f
0,5 cm
1,5 cm
2,5 cm
Hình 3.17. Vật liệu chuyển gen và các giai đoạn phát triển cây chuyển gen.
a: vùng đốt lá mầm (mũi tên), b: kim châm gồm 10 mũi kim nhỏ, c: chồi kháng PPT 6 mg/l trên môi trường SI, d: chồi kháng PPT trên môi trường E, e: cây đậu tương chuyển gen với bộ rễ phát triển; f: cây đậu tương chuyển gen trồng ngoài vườn ươm
Kết quả chọn lọc chồi, khi sử dụng dao mổ tạo vết thương nhận được 1 cây trên 300 mẫu (dòng E1), khi dùng kim châm nhận được 3 cây trên 300 mẫu (dòng
E2, E3, E4). Các dòng E1, E2, E3, E4 được kiểm tra các gen biến nạp bằng phương pháp PCR và Southern blot.
3.11.1.2. Kiểm tra gen biến nạp ở các dòng kháng PPT
DNA được ly trích từ lá của các dòng kháng PPT được sử dụng để thực hiện phản ứng PCR nhằm kiểm tra sự hiện diện của các gen biến nạp trong bộ gen cây, DNA của cây không chuyển gen sử dụng làm đối chứng âm (NC), plasmid pITB- AST được dùng làm đối chứng dương (PC).
Kiểm tra sự hiện diện của gen bar
Phản ứng PCR được thực hiện với cặp mồi đặc hiệu khuếch đại đoạn gen bar, kích thước đặc trưng là 500 bp. Kết quả điện di sản phẩm PCR (hình 3.18) như sau:
L PC NC E1 E2 E3 E4
500 bp 500 bp
Hình 3.18. Kiểm tra sự hiện diện của gen bar ở các cây kháng PPT bằng PCR. L: thang chuẩn 1kb (Promega); PC: đối chứng dương; NC: đối chứng âm; E1, E2, E3, E4 là các dòng chuyển gen giả định
Ở mẫu đối chứng dương PC (plasmid pITB-AST) và các cây chuyển gen giả định E1, E2, E3, E4 đều có sự hiện diện của 1 băng DNA với kích thước khoảng 500 bp khi so sánh với thang chuẩn (phù hợp với kích thước đặc hiệu của đoạn DNA được khuếch đại là 500 bp), trong khi phản ứng PCR với mẫu đối chứng âm NC (DNA của cây không chuyển gen) cho kết quả âm tính. Do đó, có thể khẳng định có sự hiện diện của gen bar trong tất cả các dòng kháng PPT. Sự biểu hiện của gen bar giúp các dòng này có thể tồn tại và phát triển trên môi trường có chất chọn lọc PPT.
Kiểm tra sự hiện diện của gen hbfd1
Phản ứng PCR được thực hiện với cặp mồi đặc hiệu khuếch đại đoạn gen hbfd1, kích thước đặc trưng là 400 bp. Kết quả điện di sản phẩm PCR (hình 3.19) như sau:
Ở mẫu đối chứng dương PC (plasmid pITB-AST) và các cây chuyển gen giả định E1, E2, E3, E4 đều có sự hiện diện của 1 băng DNA với kích thước khoảng 400 bp khi so sánh với thang chuẩn (phù hợp với kích thước đặc hiệu của đoạn DNA được khuếch đại là 400 bp), trong khi phản ứng PCR với mẫu đối chứng âm NC (DNA của cây không chuyển gen) cho kết quả âm tính. Do đó, có thể khẳng định có sự hiện diện của gen hbfd1 trong tất cả các cây E1, E2, E3, E4.
L PC NC E1 E2 E3 E4
500 bp 400 bp
Hình 3.19. Kiểm tra sự hiện diện của gen hbfd1 ở các cây kháng PPT bằng PCR. L: thang chuẩn 1kb (Promega); PC: đối chứng dương; NC: cây đối chứng; E1, E2, E3, E4 là các dòng chuyển gen giả định
Kết quả phân tích PCR sử dụng các cặp mồi chuyên biệt cho gen bar, hbfd1 đã giúp khẳng định các dòng kháng PPT chọn lọc được đều mang gen biến nạp, đây không phải là các dòng không chuyển gen vượt qua được bước chọn lọc với PPT. Điều này cho thấy phương pháp chọn lọc thể chuyển gen được áp dụng có hiệu quả, giúp loại bỏ mô, chồi không chuyển gen, chỉ những dòng chuyển gen có khả năng phát triển. Nhiều nghiên cứu cũng ghi nhận PPT giúp chọn lọc hiệu quả thể chuyển gen trên các giống đậu tương khác nhau [112][124][125][126]. Tuy nhiên, việc ghi nhận có sự hiện diện của gen biến nạp chỉ là kết quả bước đầu, chưa thể kết luận hiệu quả của phương pháp chuyển gen mà cần thêm những phân tích như Southern blot, định tính, định lượng chất mục tiêu.
Phân tích Southern blot gen cbfd2
Thông qua phân tích bằng PCR đã xác định được các cây đậu tương chuyển gen. Tuy nhiên để kiểm tra sự hòa nhập bền vững của các gen này vào bộ gen của cây, đồng thời xác định dòng chuyển gen riêng biệt, phân tích Southern blot, dựa trên lai phân tử với mẫu dò là đoạn trình tự của gen cbfd2 có kích thước 500 bp đã được hiện. DNA tổng số của các dòng chuyển gen, đối chứng âm (cây không chuyển gen), được cắt bởi enzyme HindIII, đối chứng dương (plasmid pITB-AST) được cắt bởi enzyme HindIII và EcoRI.
Kết quả trên hình 3.20 cho thấy ở đối chứng dương có hiện băng lai, đối chứng âm không hiện băng lai. Ở vị trí các dòng chuyển gen đều hiện diện băng lai với các kích thước khác nhau. Điều này chứng tỏ gen biến nạp đã được gắn chèn vào bộ gen cây ở những vị trí khác nhau, do đó các dòng này là các dòng chuyển gen riêng biệt.
L PC E1
E2 E3 E4 NC
bp
23130
9416
6557
4361
Hình 3.20. Kết quả phân tích DNA cây đậu tương chuyển gen bằng Southern blot
L. Thang chuẩn HindIII; PC. đoạn DNA 13,8 kb được cắt từ plasmid pITB-AST bởi hai hai enzyme HindIII và EcoRI; NC Cây đậu tương không chuyển gen; E1, E2, E3, E4 Các dòng cây đậu tương chuyển gen.
Kết quả kiểm tra gen biến nạp trên các cây kháng PPT bằng phương pháp PCR và Southern blot đều dương tính, chứng tỏ đây là các dòng chuyển gen, riêng biệt. Hiệu quả chuyển gen khi sử dụng kim châm tạo vết thương là 1% (3 dòng chuyển gen/300 mẫu), dùng dao mổ là 0,33% (1 dòng chuyển gen/300 mẫu).
Nghiên cứu quá trình xâm nhiễm, gây bệnh của vi khuẩn A. tumefaciens trên thực vật đã cho thấy, sự tạo vết thương trên vật chủ là điều kiện cần thiết để vi khuẩn có thể xâm nhiễm và gây bệnh [169]. Những phân tử từ vết thương của thực
vật giúp cảm ứng hoạt động của các gen vir trên vi khuẩn, kích hoạt sự chuyển gen diễn ra [170]. Ngoài ra, những tế bào ở trạng thái phân chia, nhân lên do cảm ứng từ việc bị tổn thương cũng được ghi nhận có khả năng biến nạp gen cao thông qua vi khuẩn A. tumefaciens [171]. Trên đậu tương, một số cách tạo vết thương khác nhau bằng cơ học hoặc sóng siêu âm, thấm hút chân không đã được sử dụng giúp vi khuẩn xâm nhiễm, chuyển gen hiệu quả [131][132][179]. Trong khảo sát này, kim châm, dao mổ được sử dụng để tạo vết thương, kết quả ghi nhận được tần số chuyển gen khi dùng kim châm cao hơn dao mổ. Điều này có thể do đặc điểm vết thương tạo ra bởi các dụng cụ này khác nhau. Vùng đốt lá mầm đậu tương rất nhạy cảm, khi gây nhiều tổn thương sẽ dễ bị hóa nâu, chết làm ảnh hưởng đến hiệu quả chuyển gen [110][127]. Dùng dao mổ tạo vết thương bằng cách cắt nhẹ, chính xác, 7-10 lần, khi thực hiện trên nhiều mẫu dễ dẫn đến sai sót gây tổn thương mẫu quá mức. Dùng kim châm, châm nhẹ 3 lần, có thao tác đơn giản, tốn ít thời gian hơn, do đó ít sai sót mà vẫn tạo được các vết thương đồng đều, không gây tổn thương mẫu quá nhiều. Hiệu quả chuyển gen bằng phương pháp dùng kim châm tuy có tăng so với dùng dao mổ nhưng vẫn thấp hơn so với nhiều nghiên cứu khác trên thế giới như Liu và cộng sự (2014), 1,06%; Zhang và cộng sự (1999), 3%; Song và cộng sự (2013), 4,59% [112][164][177]. Điều này một phần có thể do khả năng biến nạp gen của các giống đậu tương không giống nhau.
Các dòng đậu tương chuyển gen khi tiếp tục phát triển trong vườn ươm không thể đậu trái mà nhanh chóng bị già, lá vàng, rụng, thân xuất hiện những đốm đen, cây chết dần. Do đậu tương khó nuôi cấy mô, việc tái sinh không thực hiện được trên các bộ phận cây in vitro như đốt thân, lá… ngay cả nhân cây bằng đốt thân cũng không thể trẻ hóa được cây con, nên không thể thuần hóa cây thông qua các đợt nuôi cấy chọn lọc các chồi, mô chuyển gen giả định ban đầu. Điều này dẫn đến một số cây chuyển gen có thể phát triển không ổn định và khảm sau khi trồng ra điều kiện ex vitro, các cây chuyển gen qua chọn lọc có biểu hiện tốt cũng không thể giữ giống hoặc nhân giống trong điều kiện in vitro. Mặc dù các dòng đậu tương chuyển gen đã được xác định bằng phương pháp PCR và Southern blot. Tuy nhiên do cây không thể sinh sản, tạo hạt có astaxanthin nên chưa thể xác định các gen biến nạp có biểu hiện để tạo được chất mục tiêu astaxanthin. Hiệu quả của cấu trúc