Hình 3.28. Dòng chuyển gen D2 (a) và D8 (b) phát triển ngoài vườn ươm
0,5 cm
Hình 3.29. Hạt màu đỏ của dòng D2 và D8
1, 2, 3: Hạt đậu tương màu trắng của cây đối chứng, dòng D2 và D8; 4, 5: Hạt đậu màu đỏ của dòng D2 và D8
Các chậu cây được trồng cách nhau khoảng 1 m để đảm bảo khoảng cách, ngăn sự lai chéo. Ngoài ra đậu tương là cây tự thụ phấn, đặc biệt trong điều kiện nhà kín, không có côn trùng, do đó giữa các cây được đảm bảo không có sự thụ phấn chéo [96][183].
Kiểm tra các gen biến nạp trong cây bằng PCR
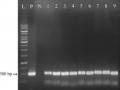
Sau khoảng 1 tháng, các cây phát triển khá tốt, vươn dài, mọc nhiều nhánh bên. Nhìn chung không có sự khác biệt đáng kể giữa cây chuyển gen và đối chứng (hình 3.30). DNA của các dòng D2-1, D2-2, D8-1, D8-2 và đối chứng được ly trích, kiểm tra sự hiện diện của các gen biến nạp bằng PCR.
Kết quả điện di sản phẩm PCR khuếch đại các gen biến nạp sử dụng các cặp mồi đặc hiệu được thể hiện trên hình 3.31 cho thấy có sự hiện diện của tất cả các băng đặc hiệu của các gen bar, cbfd2, hbfd1 và Zm-psy ở dòng D2-1 và D8-1, là các dòng phát triển từ hạt đỏ. Ngược lại, ở dòng D2-2, D8-2 (dòng phát triển từ hạt trắng) và đối chứng đều không có sự hiện diện của các băng đặc hiệu, do đó không có sự hiện diện của gen biến nạp. Các kết quả PCR chứng tỏ hai dòng D2-1 và D8-1 nhận được sự di truyền các gen biến nạp từ cây bố mẹ, trong khi dòng D2-2 và D8-2 không nhận được sự di truyền.

Hình 3.30. Các giai đoạn phát triển của cây chuyển gen trồng từ hạt
a. Hạt nảy mầm sau 4 ngày; b. cây mầm phát triển sau 7 ngày; c. cây phát triển ở giai đoạn bắt đầu ra hoa; d. cây chuyển gen ở giai đoạn trái chín.
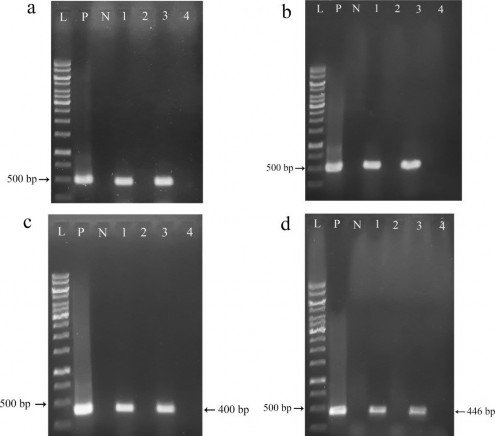
Hình 3.31. Kết quả điện di sản phẩm PCR gen biến nạp ở các dòng T1.
a. gen bar; b. gen cbfd2; c. gen hbfd1; d. gen Zm-psy; L: thang chuẩn 1kb (Promega); P: đối chứng dương pITB-AST; N: cây đối chứng không chuyển gen; 1: D2-1; 2: D2-2; 3:D8-1; 4: D8-2
Kiểm tra tính kháng của cây với thuốc diệt cỏ Basta
Dung dịch thuốc diệt cỏ Basta được sử dụng để quét lên mặt trên lá của các dòng D2-1, D2-2, D8-1, D8-2 và đối chứng. Kết quả quan sát sau 7 ngày cho thấy lá của 2 dòng D2-1, D8-1 vẫn xanh tốt, hầu như không bị ảnh hưởng, trong khi lá của dòng D2-2, D8-2 và đối chứng đều bị cháy khô ở vùng xử lý với Basta (hình 3.32). Điều này chứng tỏ dòng D2-1 và D8-1 nhận được sự di truyền của gen bar từ cây bố mẹ, sự biểu hiện của gen này giúp cây kháng lại Basta. Dòng D2-2, D8-2 không nhận được sự di truyền gen bar nên không kháng được Basta, lá bị cháy khô ở vùng xử lý.

Hình 3.32. Thử nghiệm quét Basta trên lá cây chuyển gen và đối chứng.
a cây đối chứng; b. dòng D2-2; c. dòng D8-2; d. dòng D2-1; e. dòng D8-1
Kết quả PCR và thử nghiệm Basta trên lá đều cho thấy hai dòng D2-1 và D8- 1 có sự hiện diện và biểu hiện của gen biến nạp, hai dòng D2-2 và D8-2 không có sự hiện diện của gen biến nạp. Kết quả này phù hợp với màu sắc của hạt, hai hạt D2-1 và D8-1 màu đỏ, còn hạt D2-2, D8-2 màu trắng. Như vậy màu đỏ của hạt có thể do sự biểu hiện của các gen biến nạp giúp tạo các hợp chất làm thay đổi màu sắc hạt. Do đó, màu sắc hạt có thể được sử dụng để sàng lọc bước đầu những hạt có mang gen chuyển.
Các dòng D2-1, D2-2, D8-1, D8-2 phát triển khá tốt trong vườn ươm, không có khác biệt đáng kể về kiểu hình so với đối chứng. Hạt chín được thu hoạch sau khoảng 4 tháng, số lượng hạt được ghi nhận trong bảng 3.13
ảng 3.13. Kết quả thu nhận hạt của các dòng chuyển gen D2 và D8 ở thế hệ T1
Hạt màu đỏ | Hạt màu trắng | |
D2-1 | 93 | 6 |
D2-2 | 0 | 102 |
D8-1 | 97 | 7 |
D8-2 | 0 | 112 |
Đối chứng | 0 | 109 |
Có thể bạn quan tâm!
-
 Sự Tái Sinh Của Đốt Lá Mầm Giống Mtđ 176 Trên Môi Trường Có Ppt.
Sự Tái Sinh Của Đốt Lá Mầm Giống Mtđ 176 Trên Môi Trường Có Ppt. -
 Tạo Dòng Agrobacterium Tumefaciens Eha 105 Chứa Plasmid Pitb-Ast Ly Trích, Kiểm Tra Plasmid Pitb-Ast Từ E. Coli
Tạo Dòng Agrobacterium Tumefaciens Eha 105 Chứa Plasmid Pitb-Ast Ly Trích, Kiểm Tra Plasmid Pitb-Ast Từ E. Coli -
 Chuyển Gen Bằng Vi Khuẩn A. Tumefaciens Sử Dụng Dao Mổ Kết Hợp Sóng Siêu Âm, Thấm Chân Không Tạo Vết Thương Mẫu
Chuyển Gen Bằng Vi Khuẩn A. Tumefaciens Sử Dụng Dao Mổ Kết Hợp Sóng Siêu Âm, Thấm Chân Không Tạo Vết Thương Mẫu -
 So Sánh Kiểu Hình Cây Chuyển Gen Và Cây Đối Chứng.
So Sánh Kiểu Hình Cây Chuyển Gen Và Cây Đối Chứng. -
 R.p. Mcquinn, B. Wong, J.j. Giovannoni, Atpds Overexpression In Tomato: Exposing Unique Patterns Of Carotenoid Self‐Regulation And An Alternative Strategy For The Enhancement Of Fruit
R.p. Mcquinn, B. Wong, J.j. Giovannoni, Atpds Overexpression In Tomato: Exposing Unique Patterns Of Carotenoid Self‐Regulation And An Alternative Strategy For The Enhancement Of Fruit -
 Y. Hiei, S. Ohta, T. Komari, T. Kumashiro, Efficient Transformation Of Rice (Oryza Sativa L.) Mediated By Agrobacterium And Sequence Analysis Of The Boundaries Of The T‐Dna, The Plant Journal,
Y. Hiei, S. Ohta, T. Komari, T. Kumashiro, Efficient Transformation Of Rice (Oryza Sativa L.) Mediated By Agrobacterium And Sequence Analysis Of The Boundaries Of The T‐Dna, The Plant Journal,
Xem toàn bộ 176 trang tài liệu này.
Như vậy, hạt thu được gồm hai loại màu đỏ và trắng. Trong đó, các dòng D2- 2, D8-2 và đối chứng chỉ thu được hạt trắng, dòng D2-1 và D8-1 thu được cả hạt đỏ và trắng. Hạt màu trắng là kiểu màu của hạt đối chứng, không chuyển gen. Như đã phân tích bằng PCR và tính kháng Basta, hai dòng D2-2, D8-2 không mang gen biến nạp nên toàn bộ hạt của các dòng này đều màu trắng hoàn toàn phù hợp với kết quả phân tích trước đó. Hai dòng D2-1, D8-1 nhận được sự di truyền của gen biến nạp, các cây này tạo được hạt màu đỏ, chứng tỏ có sự di truyền gen chuyển cho thế hệ sau. Ngoài ra, các dòng này cũng tạo hạt màu trắng, điều này có thể do đây chưa phải các dòng đồng hợp tử nên có sự phân ly gen biến nạp ở thế hệ tiếp theo.
Màu đỏ hạt của dòng D2-1 và D8-1 đều có sự biến thiên từ nhạt đến đậm (hình 3.33). Ngoài các yếu tố liên quan đến mức độ biểu hiện gen mang tính riêng biệt ở từng trái, vị trí trái trên cây... Sự hiện diện càng nhiều các bản sao của gen biến nạp trong bộ gen hạt có thể dẫn đến tăng cường sự biểu hiện gen và làm hạt có màu đỏ đậm hơn.
0,5 cm
Hình 3.33. Các hạt chuyển gen biểu hiện màu đỏ không đồng đều
1. Hạt màu trắng cây đối chứng; 2. Hạt màu trắng cây chuyển gen; 3. Hạt màu đỏ nhạt cây chuyển gen; 4. Hạt màu đỏ đậm cây chuyển gen
Kiểm tra khả năng di truyền và biểu hiện của gen biến nạp ở thế hệ T2
Ở mỗi dòng gieo tất cả các hạt màu trắng, 3 hạt màu đỏ đậm và 3 hạt màu đỏ nhạt trong giấy thấm nước bổ sung 100 mg/l PPT. Kết quả sau 4 ngày chỉ những hạt màu đỏ có khả năng nảy mầm, các hạt trắng chết dần, không nảy mầm. Điều này cho thấy, chỉ những hạt màu đỏ có mang gen biến nạp (gen bar), sự biểu hiện của gen này giúp hạt có khả năng kháng và nảy mầm trong môi trường có 100 mg/l PPT. Các hạt nảy mầm được trồng trong chậu đất ngoài vườn ươm. Kí hiệu các dòng T2 là: D2-1-1 (đỏ đậm), D2-1-2 (đỏ đậm), D2-1-3 (đỏ đậm), D2-1-4 (đỏ nhạt), D2-1-5 (đỏ nhạt),
D2-1-6 (đỏ nhạt) và D8-1-1 (đỏ đậm), D8-1-2 (đỏ đậm), D8-1-3 (đỏ đậm), D8-1-4
105
(đỏ nhạt), D8-1-5 (đỏ nhạt), D8-1-6 (đỏ nhạt). Sau khoảng 4 tháng, thu nhận hạt với kết quả như sau: tất cả các cây trồng từ hạt đỏ đậm ở cả hai dòng D2 và D8 đều tạo hạt màu đỏ (khoảng 100 hạt) với màu đậm nhạt khác nhau (hình 3.34). Hạt của các cây trồng từ hạt đỏ nhạt có sự phân ly màu: D2-1-4 (80 hạt đỏ, 23 hạt trắng), D2-1-5 (75 hạt đỏ, 22 hạt trắng), D2-1-6 (85 hạt đỏ, 26 hạt trắng), D8-1-4 (79 hạt đỏ, 26 hạt trắng), D8-1-5 (87 hạt đỏ, 24 hạt trắng), D8-1-6 (81 hạt đỏ, 22 hạt trắng).
1 cm
Hình 3.34. Hạt của các dòng chuyển gen T2
a. Tất cả các hạt đều màu đỏ của dòng D2-1-1; b. Hạt màu đỏ (1) và màu trắng (2) của dòng D2-1-4
Các kết quả ghi nhận được cho thấy đã có sự di truyền của gen biến nạp từ thế hệ T1 đến T2, tất cả các cây T2 đều tạo được hạt màu đỏ. Ngoài ra, mức độ màu đỏ hạt có thể do ảnh hưởng của số lượng bản sao gen biến nạp hiện diện trong bộ gen hạt, cũng như vị trí gắn chèn của gen biến nạp trong nhiễm sắc thể cây bố mẹ. Những cây phát triển từ hạt đỏ đậm không có sự phân ly màu sắc hạt (đỏ, trắng) ở thế hệ sau, có thể do số lượng bản sao của gen biến nạp trong cây bố mẹ nhiều; những cây phát triển từ hạt đỏ nhạt có sự phân ly màu sắc hạt (đỏ, trắng) ở thế hệ sau, có thể do số lượng bản sao của gen biến nạp trong cây bố mẹ ít hơn. Do đó màu sắc hạt có thể được sử dụng để hỗ trợ việc xác định thể đồng hợp tử, từ đó tạo dòng di truyền ổn định gen biến nạp. Nhiều nghiên cứu chuyển gen đã ghi nhận số lượng bản sao của gen biến nạp có thể ảnh hưởng đến mức biểu hiện chung của tính trạng, đặc điểm quan tâm. Shirsat và cộng sự (1989) nhận thấy hàm lượng protein ngoại lai legA trong cây N. plumbaginifolia đạt được ở các mức cao với số lượng bản sao
106
gen biến nạp lớn hơn 1 (khoảng 2-4), chứng tỏ hàm lượng protein legA có thể là kết quả của nhiều sự biểu hiện các bản sao gen [184]. Mức độ biểu hiện của gen gfp trên lúa gạo trong nghiên cứu chuyển gen của Zhou và cộng sự (2013) cũng cho thấy có sự tương quan trong sự biểu hiện của gen biến nạp với số lượng bản sao, với các dòng có số lượng bản sao cao (2-5) thường có biểu hiện gfp cao hơn các dòng có một bản sao. Tuy nhiên, kết quả không hoàn toàn tuyến tính do sự biểu hiện gen chuyển còn phụ thuộc vào vị trí gắn chèn trong nhiễm sắc thể [185]. Nghiên cứu chuyển các gen mã hóa enzyme ferredoxin-hydrogenase và Gaussia-Luciferase vào tảo Chlamydomonas reinhardtii của Shahar và cộng sự cũng ghi nhận các kết quả tương tự [186].
Tóm lại, kết quả từ các thí nghiệm trên cho thấy các gen biến nạp đã được di truyền và biểu hiện ổn định qua nhiều thế hệ. Tuy nhiên, hai dòng chuyển gen T0 ban đầu (D2 và D8) đều mang hai bản sao của gen biến nạp và chỉ tạo được hai hạt. Do đó không thể phân tích qui luật di truyền của các gen biến nạp ở thế hệ tiếp theo. Ngoài ra, việc thu nhận các dòng thuần, đồng hợp tử gen biến nạp có thể được thực hiện bằng việc gieo các hạt màu đỏ đậm nhất qua nhiều thế hệ để thu nhận dòng tạo được các hạt đỏ đậm, đồng đều.
3.11.2.6. Phân t ch hàm lượng astaxanthin trong hạt chuyển gen.
Hàm lượng astaxanthin trong hạt đậu màu đỏ của hai dòng chuyển gen D2-1 và D8-1 được xác định bằng phương pháp sắc ký lỏng ghép khối phổ LC-MS tại Trung tâm phân tích trường ĐH Khoa học Tự nhiên tp. HCM.
Mẫu ly trích từ hạt của hai dòng D2-1 và D8-1 đều có sự hiện diện peak ở tỉ số khối lượng/điện tích (m/z) đặc trưng của astaxanthin là 597,39 [187][188][189][190], đồng thời ở mẫu đối chứng không chuyển gen không có sự hiện diện của peak này, chứng tỏ trong hạt của hai dòng D2-1 và D8-1 đều có astaxanthin (hình 3.35, 3.36, 3.37). Kết quả xác định hàm lượng astaxanthin trong hạt được trình bày trong bảng 3.14.
ảng 3 14 Kết quả định lượng astaxanthin trong hạt của các dòng chuyển gen
Dòng đậu tương | Hàm lượng astaxanthin (µg/g) | |
01 | Đối chứng | Không phát hiện |
02 | D2-1 | 0.31 |
03 | D8-1 | 0.77 |
Astaxanthin được xác định hiện diện trong hạt của các dòng đậu tương chuyển gen, điều này cho thấy cấu trúc ba gen Zm-psy, cbfd2, hbfd1 biến nạp vào đậu tương đã hoạt động: enzyme ZM-PSY giúp tăng cường con đường chuyển hóa carotenoids (hạt đậu tương chuyển gen đậm màu hơn so với đối chứng); enzyme CBFD2, HBFD1 phối hợp hoạt động qua ba bước, giúp chuyển hóa β-carotene thành astaxanthin. Như vậy, con đường chuyển hóa tạo astaxanthin ở cây hoa Adonis aestivalis đã được ứng dụng thành công vào đậu tương. Tuy nhiên, hàm lượng astaxanthin trong hạt của hai dòng D2-1 và D8-1 đều tương đối thấp (lần lượt đạt 0,31 và 0,77 µg/g) so với nghiên cứu chuyển gen tạo astaxanthin trên một số đối tượng khác như ngô đạt 16,77 µg/g [31]; gạo với 16,23 µg/g [8]; đậu tương với 2-7
µg/g [63]… cũng như so với ly trích từ nguồn tự nhiên như tảo Haematococcus pluvialis 20 -50 mg/g trọng lượng khô [53][191]; nấm men Xanthophyllomyces dendrorhous 1,14 – 2,57 mg/g trọng lượng khô tế bào [192][193]. Điều này có thể do nhiều nguyên nhân như khác biệt về nguồn gen sử dụng, loại cây biến đổi gen, hơn nữa các cây chuyển gen chưa phải thể đồng hợp tử, khả năng hoạt động của gen biến nạp phụ thuộc vào vị trí gắn chèn trong bộ nhiễm sắc thể. Do đó, việc tạo thêm nhiều dòng chuyển gen có thể giúp tìm được dòng có khả năng tổng hợp astaxanthin tối ưu hơn. Ngoài ra, con đường chuyển hóa β-carotene thành astaxanthin xúc tác bởi CBFD và HBFD bị cạnh tranh với một enzyme nội sinh khác trong cây là β-ring carotene hydroxylase chuyển hóa β-carotene thành β-cryptoxanthin và zeaxanthin, những hợp chất không thể sử dụng bởi các enzyme CBFD, HBFD. Đây cũng có thể là nguyên nhân ảnh hưởng đến khả năng hoạt động của CBFD, HBFD làm giảm sự tạo thành astaxanthin. Tuy nhiên, để chứng minh, cần thêm những nghiên cứu như ức chế hoặc bất hoạt gen mã hóa β-ring carotene hydroxylase [6][19][21].
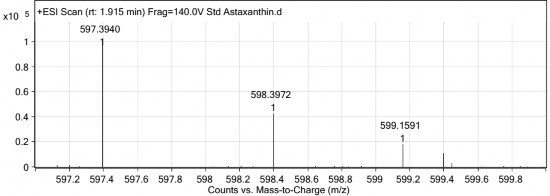
Hình 3.35. Phổ ESI-MS của chuẩn astaxanthin
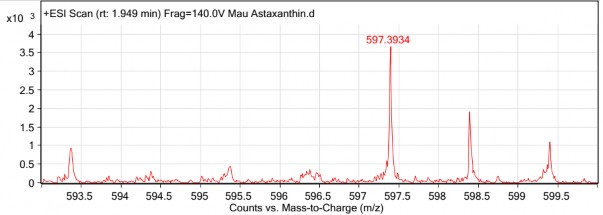
Hình 3.36. Phổ ESI-MS của mẫu ly trích từ hạt dòng D2-1
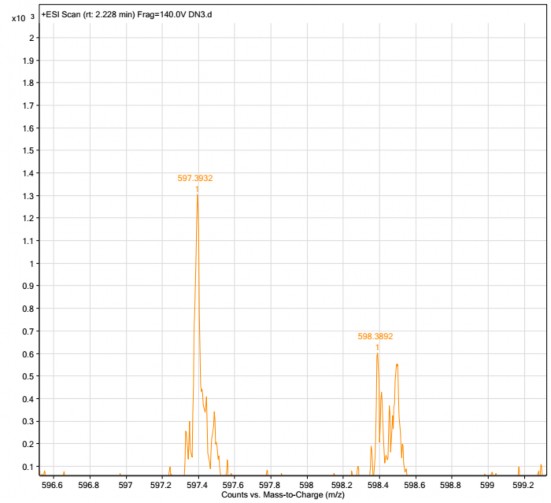
Hình 3.37. Phổ ESI-MS của mẫu ly trích từ hạt dòng D8-1
3.11.2.7. Đánh giá sự sinh trưởng cây chuyển gen T0, T1 trong điều kiện ex vitro
Nhìn chung cây đậu tương chuyển gen T0 trồng trong vườn ươm đạt kích thước tối đa lúc cây ra hoa, đậu quả, có kiểu hình các bộ phận tương tự với cây đối