1 cm
a
b
c
d
e
f
g
h
i
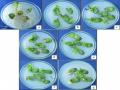
Hình 3.9. Sự tái sinh của đốt lá mầm giống MTĐ 176 trên môi trường có PPT.
a, b, c, d, e, f, g, h, i: đốt lá mầm giống MTĐ 176 trên môi trường có 0; 1; 2; 3; 4; 5; 6; 7; 8 mg/l PPT.
Nhiều nghiên cứu của các tác giả khác cho thấy nồng độ PPT thích hợp để chọn lọc thể chuyển gen phụ thuộc nhiều vào giống đậu tương. Zhang và cộng sự (1999) chuyển gen thành công vào giống đậu tương A3237 Mỹ, sử dụng 5 mg/l PPT, trong khi Zeng và cộng sự (2004) chuyển gen trên giống Williams 82 (Mỹ) sử dụng 8 mg/l PPT [112][124]. Kim và cộng sự (2012) chuyển gen thành công vào giống đậu Kwangan (Hàn Quốc) khi sử dụng 10 mg/l PPT [168]. Các nghiên cứu của Paz và cộng sự (2004), sử dụng 6 mg/l PPT, Xue và cộng sự (2006) dùng 5 mg/l PPT [125][129].
3.6. Ảnh hưởng của PPT lên sự sinh trưởng của chồi in vitro
Đối với cả 3 giống, ảnh hưởng của PPT lên chồi in vitro khá giống nhau. Khi quan sát ở tuần thứ 4 cho thấy, ở nồng độ 1; 2 mg/l, rễ hình thành trong thời gian đầu, sau đó tăng trưởng chậm và dừng lại, phần ngọn tăng trưởng chậm nhưng không chết. Ở nồng độ 3; 4 mg/l PPT, rễ đã không thể hình thành, dù ở một số chồi phần ngọn vẫn sống và có thể tiếp tục tăng trưởng. Ở nồng độ 5 mg/l PPT, chồi hoàn toàn không tăng trưởng thêm và chết dần trên môi trường (bảng 3.9, hình 3.10).
Mặc dù chồi chuyển gen có mang gen bar giúp giải độc PPT, tuy nhiên ở nồng độ cao PPT cũng có thể làm giảm sức sống, phát triển của chồi. Do đó ảnh hưởng của PPT lên sự sinh trưởng của chồi in vitro cần được kiểm tra, từ đó xác định nồng độ PPT thích hợp giúp duy trì áp lực chọn lọc, nhưng đảm bảo sự sinh trưởng phát triển tốt của chồi chuyển gen, tạo thuận lợi cho quá trình chuyển cây chuyển gen từ in vitro ra điều kiện ex vitro. Kết quả ghi nhận từ thí nghiệm cho thấy ở nồng độ 1 mg/l, PPT đã tạo được áp lực chọn lọc đối với sinh trưởng của chồi đậu tương in vitro. Do đó, nồng độ PPT từ 1 mg/l có thể được dùng để tạo áp lực chọn lọc trong giai đoạn phát triển cây chuyển gen in vitro.
ảng 3.9. Ảnh hưởng của PPT lên khả năng sống của chồi in vitro.
Tỉ lệ chồi sống (%)1 | |||
HL 07-15 | OMĐN 29 | MTĐ 176 | |
0 | 93,33 a | 93,33 a | 96,67 a |
1 | 86,67 a | 80,00 b | 86,67 b |
2 | 46,67 b | 33,33 c | 43,33 c |
3 | 33,33 c | 26,67 c | 30,00 d |
4 | 6,67 d | 6,67 d | 6,67 e |
5 | 0,00 d | 0,00 d | 0,00 e |
Có thể bạn quan tâm!
-
 Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt
Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt -
 Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro
Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro -
 Sự Hình Thành Chồi Của Đốt Lá Mầm Giống Mtđ 176 Ở Các Nồng Độ Ba Khác Nhau Sau 3 Tuần Nuôi Cấy.
Sự Hình Thành Chồi Của Đốt Lá Mầm Giống Mtđ 176 Ở Các Nồng Độ Ba Khác Nhau Sau 3 Tuần Nuôi Cấy. -
 Tạo Dòng Agrobacterium Tumefaciens Eha 105 Chứa Plasmid Pitb-Ast Ly Trích, Kiểm Tra Plasmid Pitb-Ast Từ E. Coli
Tạo Dòng Agrobacterium Tumefaciens Eha 105 Chứa Plasmid Pitb-Ast Ly Trích, Kiểm Tra Plasmid Pitb-Ast Từ E. Coli -
 Chuyển Gen Bằng Vi Khuẩn A. Tumefaciens Sử Dụng Dao Mổ Kết Hợp Sóng Siêu Âm, Thấm Chân Không Tạo Vết Thương Mẫu
Chuyển Gen Bằng Vi Khuẩn A. Tumefaciens Sử Dụng Dao Mổ Kết Hợp Sóng Siêu Âm, Thấm Chân Không Tạo Vết Thương Mẫu -
 Dòng Chuyển Gen D2 (A) Và D8 (B) Phát Triển Ngoài Vườn Ươm
Dòng Chuyển Gen D2 (A) Và D8 (B) Phát Triển Ngoài Vườn Ươm
Xem toàn bộ 176 trang tài liệu này.
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 trong phép thử Duncan. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x trước khi xử lý thống kê.
1 cm
a
b
c
d
e
f
Hình 3.10. Sự sinh trưởng đoạn thân giống MTĐ 176 trên môi trường có PPT.
a, b, c, d, e, f: đoạn thân trên môi trường có 0; 1; 2; 3; 4; 5 mg/l PPT.
3.7. Ảnh hưởng việc tạo vết thương bằng kim châm lên khả năng tái sinh của đốt lá mầm
Thí nghiệm được thực hiện nhằm tối ưu việc sử dụng kim châm để tạo vết thương phù hợp cho nghiên cứu chuyển gen. Kết quả ghi nhận được cho thấy đốt lá mầm của ba giống đậu tương có đáp ứng khá giống nhau với sự tạo vết thương của kim châm. Ở nghiệm thức đối chứng và các nghiệm thức có số lần châm từ 1 đến 3, tỉ lệ mẫu tái sinh cao, khoảng 90% trở lên, giữa các nghiệm thức không khác biệt về thống kê. Điều này cho thấy vùng đốt lá mầm bị tác động, tạo vết thương nhưng chưa ảnh hưởng lớn đến khả năng tái sinh. Khi tăng số lần châm lên 4, 5 tỉ lệ mẫu tái sinh đã giảm đáng kể, đều dưới 70% (bảng 3.10). Ở các nghiệm thức này vùng đốt lá mầm đã bị tổn thương lớn hơn dẫn tới làm mất khả năng tái sinh ở nhiều mẫu (hình 3.11). Trong thí nghiệm chuyển gen, việc tạo vết thương cho mẫu là yếu tố cần thiết giúp vi khuẩn A. tumefaciens xâm nhiễm, chuyển đoạn T-DNA vào bộ gen tế bào thực vật [169][170][171]. Tuy nhiên, gây tổn thương quá mức sẽ dẫn đến vùng mô phân sinh bị dập nát, mất hoặc giảm khả năng phục hồi, tái sinh, từ đó giảm đáng kể hiệu quả chuyển gen. Sử dụng kim châm 3 lần trong thí nghiệm này giúp gây tổn thương đáng kể đến mẫu mô, tuy nhiên mô vẫn có khả năng phục hồi, tái sinh là điều kiện phù hợp để chuẩn bị mẫu mô cho thí nghiệm chuyển gen, do đó được chọn cho các thí nghiệm tiếp theo.
ảng 3 10. Kết quả khảo sát ảnh hưởng của việc sử dụng kim châm lên khả năng tái sinh của đốt lá mầm
Tỉ lệ mẫu tái sinh (%)1 | |||
MTĐ 176 | HL 07-15 | OMĐN 29 | |
0 | 96,67 a | 96,67 a | 96,67 a |
1 | 93,33 a | 93,33 a | 93,33 a |
2 | 93,33 a | 90,00 a | 93,33 a |
3 | 90,00 a | 86,67 a | 86,67 a |
4 | 66,67 b | 63,33 b | 56,67 b |
5 | 43,33 c | 36,67 c | 40,00 c |
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 trong phép thử Duncan. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x trước khi xử lý thống kê.
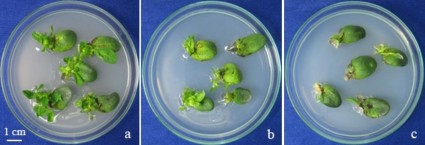
Hình 3.11. Ảnh hưởng của số lần châm đến khả năng tái sinh của đốt lá mầm giống MTĐ 176
a. châm 3 lần; b. Châm 4 lần; c. châm 5 lần
3.8. Ảnh hưởng của việc tạo vết thương bằng dao mổ kết hợp sóng siêu âm lên hiệu quả chuyển gen gus vào đậu tương (giống MTĐ 176)
Một nửa mẫu sau khi đồng nuôi cấy được rửa sạch vi khuẩn và nhuộm với dung dịch X-Gluc để kiểm tra biểu hiện tạm thời của gen gus.
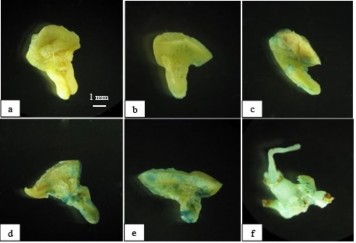
Kết quả nhuộm GUS tạm thời với đốt lá mầm sau 5 ngày đồng nuôi cấy với vi khuẩn cho thấy tất cả các nghiệm thức đều có mẫu biểu hiện GUS+, tuy nhiên tỉ lệ mẫu và mức độ biểu hiện GUS có sự khác biệt. Nhìn chung mức độ biểu hiện GUS tăng theo thời gian xử lý sóng siêu âm từ 0s đến 60s (bảng 3.11, hình 3.12).
81
Ở nghiệm thức đối chứng không xử lý sóng siêu âm, tỉ lệ mẫu GUS+ (56,67%) và mức độ biểu hiện GUS đều khá thấp, chỉ xuất hiện một số đốm nhỏ màu xanh đặc trưng. Các nghiệm thức có xử lý mẫu bằng sóng siêu âm, tỉ lệ mẫu GUS+ và mức độ biểu hiện GUS đều tăng. Sử dụng sóng siêu âm ở 15s làm tăng đáng kể biểu hiện GUS với 86,67% mẫu dương tính. Tăng thời gian siêu âm mẫu lên 30s, 45s, 60s tỉ lệ mẫu có GUS+ đều đạt tối đa 100%, đồng thời mức độ biểu hiện GUS, diện tích vùng nhuộm xanh cũng tăng cao. Đặc biệt, ở các nghiệm thức xử lý mẫu với 45s và 60s, hầu hết toàn bộ mẫu đều nhuộm màu xanh đặc trưng, cho thấy ảnh hưởng của sóng siêu âm lên hầu hết các phần của mẫu.
Kết quả trên thể hiện khả năng biểu hiện GUS tạm thời của mẫu sau 5 ngày đồng nuôi cấy với vi khuẩn. Để đánh giá chính xác hơn ảnh hưởng của xử lý sóng siêu âm đến hiệu quả chuyển gen cần xem xét thêm khả năng kháng chất chọn lọc, tái sinh tạo chồi trên môi trường chọn lọc.
Kết quả chọn lọc tái sinh chồi trên môi trường có 6 mg/l PPT như sau: nghiệm thức đối chứng nhận được 1 chồi kháng, có GUS+ (1 chồi/60 mẫu, 1,67%). Nghiệm thức xử lý 15s nhận được 4 chồi kháng trong đó 3 chồi có GUS+ (3 chồi/60 mẫu, 5%). Nghiệm thức xử lý 30s nhận được 7 chồi kháng trong đó 6 chồi có GUS+(6 chồi/60 mẫu, 10%). Nghiệm thức xử lý 45s và 60s, không nhận được chồi kháng PPT. Trong quá trình nuôi cấy trên môi trường tái sinh chọn lọc, ở các nghiệm thức xử lý sóng siêu âm từ 30s trở lên có hiện tượng mẫu bị nhiễm lại vi khuẩn, cụ thể tỷ lệ mẫu nhiễm lại ở các nghiệm thức như sau, nghiệm thức 30s: 16,67%; nghiệm thức 45s: 86,67%; nghiệm thức 60s: 100%. Như vậy, khi tăng thời gian xử lý mẫu với sóng siêu âm có thể làm tăng mức độ biểu hiện GUS tạm thời, tuy nhiên mức độ tổn thương của mẫu cũng gia tăng dẫn đến nhiều mẫu mất khả năng phục hồi, tái sinh và bị nhiễm lại vi khuẩn trong quá trình tái sinh chọn lọc.
Với kết quả biểu hiện GUS tạm thời sau 5 ngày đồng nuôi cấy và chọn lọc chồi sau 4 tuần cho thấy xử lý mẫu với sóng siêu âm có khả năng giúp tăng hiệu quả chuyển gen vào đậu tương, thời gian xử lý 30s được ghi nhận giúp tăng hiệu quả chuyển gen tối ưu. Khả năng tăng hiệu quả chuyển gen của sóng siêu âm là do sóng siêu âm gây nhiều vết thương nhỏ trên bề mặt cũng như tạo những vết thương sâu đến những lớp tế bào bên dưới, đặc biệt là các tế bào phân sinh do đó giúp vi khuẩn A.
tumefaciens tiếp xúc tốt hơn với các tế bào này tạo thuận lợi cho quá trình chuyển gen. Ngoài ra, sóng siêu âm tạo rất nhiều vết thương nhỏ cả trên và dưới bề mặt mô, dẫn đến việc tiết nhiều hơn các hợp chất phenol tự nhiên từ mẫu thực vật, kích thích quá trình chuyển gen của vi khuẩn A. tumefaciens [172]. Trên đậu tương một số nghiên cứu cũng cho thấy khả năng tăng hiệu quả chuyển gen đáng kể khi sử dụng sóng siêu âm. Các tác giả sử dụng loại mẫu khác nhau, tuy nhiên thời gian xử lý sóng siêu âm tối ưu thường không quá dài, như với mô có khả năng sinh phôi là 30s, lá mầm non (2s), đốt lá mầm (20s) [131][134][136].
ảng 3 11. Tỉ lệ mẫu dương tính GUS khi xử l sóng siêu âm ở các thời gian khác nhau
Tỉ lệ mẫu dương tính GUS (%)1 | |
0 | 56,67 a |
15 | 86,67 b |
30 | 100,00 c |
45 | 100,00 c |
60 | 100,00 c |
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 dựa theo kiểm định thống kê LSD. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x trước khi xử lý thống kê.
nh 3 12. Mẫu dương tính GUS khi xử l sóng siêu âm ở các thời gian khác nhau. a, b, c, d, e tương ứng với thời gian xử lý lần lượt: 0s; 15s; 30s; 45s; 60s f: chồi dương t nh sau 4 tuần nuôi cấy trên môi trường chọn lọc
3.9. Ảnh hưởng của việc tạo vết thương bằng dao mổ kết hợp thấm hút chân không lên hiệu quả chuyển gen gus vào đậu tương
Tương tự như khảo sát trên, một nửa mẫu sau khi đồng nuôi cấy được rửa sạch vi khuẩn và nhuộm với dung dịch X-Gluc để kiểm tra biểu hiện tạm thời của gen gus. Ở tất cả các nghiệm thức đều có mẫu biểu hiện GUS+, tuy nhiên tỉ lệ mẫu và mức độ biểu hiện GUS ở các nghiệm thức có sự khác biệt rõ ràng. Nhìn chung khả năng chuyển gen, biểu hiện GUS tăng theo thời gian xử lý thấm chân không từ 0s đến 60s (bảng 3.12, hình 3.13).
Nghiệm thức đối chứng không xử lý thấm chân không, tỉ lệ mẫu GUS+(60%)
và mức độ biểu hiện GUS đều khá thấp. Trên mẫu chỉ xuất hiện một số đốm nhỏ màu xanh đặc trưng (hình 3.13 a). Như vậy, có thể thấy khả năng chuyển gen vào mẫu trong trường hợp này khá hạn chế.
Các nghiệm thức có xử lý mẫu bằng thấm chân không, tỉ lệ mẫu GUS+ tăng
từ 66,67 - 100%, đồng thời với mức độ biểu hiện GUS+. Kết quả biểu hiện GUS cao nhất với 100% mẫu GUS+, vùng mẫu nhuộm xanh cũng nhiều nhất, đạt được ở nghiệm thức xử lý mẫu trong môi trường áp lực âm với thời gian 60s (hình 3.13 e).
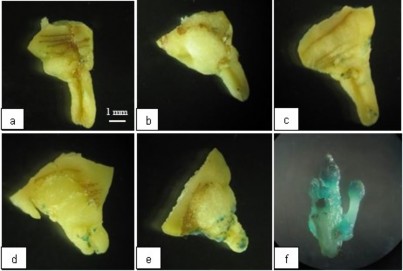
nh 3 13 Mẫu dương tính GUS khi xử l áp lực âm ở các thời gian khác nhau. a, b, c, d, e tương ứng với thời gian xử lý lần lượt: 0s; 15s; 30s; 45s; 60s f: chồi dương t nh sau 4 tuần nuôi cấy trên môi trường chọn lọc
Kết quả trên thực hiện với mẫu đốt lá mầm sau thời gian đồng nuôi cấy 5 ngày với vi khuẩn, là kết quả biểu hiện GUS tạm thời, nhằm đánh giá mức độ tiếp xúc, thâm nhập, cũng như khả năng chuyển gen của vi khuẩn A. tumefaciens vào
các tế bào của mẫu đốt lá mầm. Tuy nhiên cần xem xét thêm khả năng kháng chất chọn lọc, tái sinh trên môi trường mới kết luận chính xác ảnh hưởng của phương pháp xử lý ở các nghiệm thức khác nhau tới hiệu quả chuyển gen.
Kết quả tái sinh chồi trên môi trường chọn lọc tương đối phù hợp với kết quả nhuộm GUS tạm thời với mẫu đốt lá mầm. Số lượng chồi kháng 6 mg/l PPT, có GUS+ nhận được ở các nghiệm thức như sau: Nghiệm thức đối chứng và xử lý chân không 15s nhận được 2 chồi kháng, tuy nhiên chỉ 1 chồi có GUS+(1 chồi/60 mẫu, 1,67%). Nghiệm thức xử lý với thời gian 30s và 45s nhận được 4 chồi kháng, trong đó 3 chồi có GUS+ (3 chồi/60 mẫu, 5%). Nghiệm thức xử lý với thời gian 60s nhận được 6 chồi kháng trong đó 5 chồi GUS+ (5 chồi/60 mẫu, 8,33%).
Như vậy ở cả kết quả biểu hiện GUS tạm thời sau 5 ngày đồng nuôi cấy và chọn lọc chồi sau 4 tuần đều cho thấy khả năng tăng hiệu quả chuyển gen đáng kể của xử lý thấm chân không, kết quả tối ưu nhận được khi xử lý mẫu với thời gian 60s.
ảng 3 12. Tỉ lệ đốt lá mầm dương tính GUS khi xử l áp lực âm ở các thời gian khác nhau.
Tỉ lệ mẫu dương tính GUS (%)1 | |
0 | 60,00 a |
15 | 66,67 a |
30 | 80,00 b |
45 | 88,33 b |
60 | 100,00 c |
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 theo kiểm định thống kê LSD. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x trước khi xử lý thống kê.
Khả năng tăng hiệu quả chuyển gen bằng xử lý thấm chân không là do khi ngâm mẫu trong dung dịch vi khuẩn A. tumefaciens, được đặt trong môi trường có áp suất giảm dần, dẫn đến các chất khí bên trong mẫu thoát ra ngoài. Sau đó tăng áp suất đột ngột, làm cho dung dịch vi khuẩn xâm nhập thay thế những khí đã thoát ra. Việc này làm tăng mức độ tiếp xúc của vi khuẩn A. tumefaciens với những tế bào ở lớp bên trong mô thực vật, tạo thuận lợi hơn cho quá trình chuyển gen so với khi vi