- Hiệu suất thu hồi: 60120%.
Giới hạn định lượng (LOQ) của phương pháp được tính theo theo công thức sau:
LOQ 10 LOD
3
2.5 Hóa chất và thiết bị
2.5.1 Hóa chất
Pha dung dịch chuẩn
(2.20)
Dung dịch chuẩn MEAC: Cân chính xác 0,0600 gam thuốc thử MEAC cho vào cốc 50 mL, thêm từ từ dung môi MeOH, khuấy đều. Sau đó, chuyển dung dịch vào bình định mức 100 mL, định mức tới vạch bằng dung môi MeOH, thu được dung dịch thuốc thử có nồng độ 10-3M.
Dung dịch chuẩn DEAC: Cân chính xác 0,0776 gam thuốc thử DEAC rồi cho vào cốc 50 mL, thêm từ từ dung môi MeOH vào cốc, khuấy đều. Sau đó, chuyển dung dịch vào bình định mức 100 mL, định mức tới vạch bằng dung môi MeOH, thu được dung dịch thuốc thử có nồng độ 10-3M.
Dung dịch chuẩn TEAC: Cân chính xác 0,1129 gam thuốc thử TEAC cho cốc 50 mL, thêm từ từ dung dịch MeOH vào cốc, khuấy đều. Cho dung dịch vào bình định mức 100 mL, định mức đến vạch bằng dung môi MeOH, thu được dung dịch thuốc thử có nồng độ 10-3M.
Các dung dịch Th(IV), Pb(II), Cr(III), Eu(III); La(III); Ni(II), Fe(III), Sm(III)...
được pha từ muối nitrat tương ứng sau khi đã sấy đến khối lượng không đổi để loại bỏ độ ẩm.
Dung dịch nghiên cứu: Cho một lượng thuốc thử vào bình định mức 25 mL và thêm dung dịch chứa ion kim loại vào bình sao cho nồng độ của thuốc thử và ion kim loại sau khi định mức là 2.10-5M. Thêm dung dịch đệm điều chỉnh pH của hệ, sau đó định mức đến vạch.
Dung dic̣ h so sánh: Hỗn hợp dung môi dùng đề hòa tan thuốc thử hoặc dung dịch TEAC cùng nồng độ ở cùng giá trị pH với phức.
Dung dịch đệm: Dùng các dung dịch CH3COOH/CH3COONa và Na2HPO4/ NaOH.
Dung dịch chuẩn so sánh MES-05-HG-1: Gồm các nguyên tố (Ag, Al, As, B, Ba, Bi, Ca, Cd, Co, Cr, Cu, Fe, K, Li, Mg, Mn, Mo, Na, Ni, P, Pb, Zn…) của Merck được cung cấp bởi Trung Tâm Phân tích Công Nghệ Cao- Hoàn Vũ.
Chất chuẩn dạng rắn SL-1 và SOIL-7: được cung cấp bởi Trung tâm phân tích-Viện Nghiên cứu hạt nhân.
Các hóa chất khác: Axit nitric HNO3 nồng độ 65%; metanol (MeOH), axetonitril (MeCN), P.A, Merck. Th(NO3)4.5H2O; UO2(NO3)2.3H2O; La(NO3)3.6H2O; Eu(NO3)3.5H2O; Sm(NO3)3.6H2O, P.A; Fe(NO3)3.9H2O; Pb(NO3)2 ,P.A; Cr(NO3)3;
Ni(NO3)2; CH3COOH; NaOH rắn; NaNO3 rắn; P.A Merck. Các hóa chất sử dụng đều đạt độ tinh khiết phân tích.
2.5.2. Thiết bị
(1) Thiết bị UV-VIS hai chùm tia Lambda 25 của hãng Perkin Elmer (Mỹ)
(2) Thiết bị cộng hưởng từ 1H-NMR DPX 400 và phổ 1C-NMR Bruker ADVANCE-600
(3) Thiết bị FT-IR 1000 của hãng Perkin Elmer (Mỹ).
(4) Hệ thiết bị IC-ICP-MS Elan 6000 của hãng Perkin Elmer
(5) Hệ thiết bị HPLC-MS của hãng Perkin Elmer
(6) Hệ phổ kế gamma đa kênh nối với detector siêu tinh khiết HP-Ge; độ phân giải 1,9 keV tại đỉnh 1173 keV và 1332 keV của 60Co
(7) Máy cất nước 2 lần của hãng Hamilton (Anh); cân phân tích Afcoset, độ nhạy 10-5 gam (Ấn Độ), máy đo pH Thermo Orion- 290 (Mỹ). Các dụng cụ thủy tinh: pipet các loại từ 1 -25 mL, ống đong, bình định mức, bình tam giác, cốc, phễu chiết các loại, phễu lọc, chén platin, micropipet các loại, các bình, lọ polyetylen (PE) đựng mẫu…được mua từ hãng Merck; Cộng hòa Liên bang Đức.
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Khảo sát tương tác của MEAC, DEAC và TEAC với ion kim loại
3.1.1. Khảo sát ảnh hưởng của dung môi và pH đến phổ hấp thụ của thuốc thử
3.1.1.1. Ảnh hưởng của dung môi
Ba thuốc thử hữu cơ sử trong luận án này là MEAC, DEAC và TEAC đều chứa một số lượng lớn các nhóm kị nước (nhân thơm và nhóm este). Do đó, các thuốc thử này rất ít tan trong nước. Ngược lại, chúng lại tan tốt trong các dung môi hữu cơ, nhất là các dung môi có độ phân cực thấp.
Phổ hấp thụ của các thuốc thử hữu cơ nói chung và azocalixaren nói riêng đều phụ thuộc vào tính chất (tính axit, bazơ, trơ), hằng số điện môi, độ phân cực của dung môi [10]. Dựa vào đặc điểm này, chúng tôi lựa chọn 4 dung môi MeOH, MeCN, Tetrahydrofuran (THF) và cloroform để khảo sát phổ hấp thụ của các thuốc thử. Dung môi MeOH được xếp vào loại dung môi có tính axit, nghĩa là nó có khả năng tự proton hóa để tách ion H+ (K =2.10-17, hằng số điện môi = 32,6). Dung môi MeCN là dung môi trơ, nhưng có hằng số điện môi lớn ( = 37,5), có khả năng hình thành liên kết hidro với các chất tan chứa H linh động. Dung môi cloroform cũng là dung môi trơ và có hằng số điện môi nhỏ ( = 4,8). Trong khi đó, THF là dung môi có tính bazơ do trong phân tử của nó chứa nguyên tử O còn 2 cặp electron tự do.
Phổ hấp thụ của MEAC, DEAC và TEAC ở nồng độ 2.10-5M được khảo sát trong khoảng bước sóng từ 300700 nm với dung dịch so sánh là dung môi dùng để hòa tan thuốc thử. Kết quả được trình bày ở hình 3.1 cho thấy phổ hấp thụ của MEAC trong MeCN, MeOH, THF và cloroform có cực đại lần lượt ở các bước sóng 410, 385, 455 và 460 nm. Kết quả khảo sát ở hình 3.2 cho thấy trong dung môi khác nhau, phổ hấp thụ của DEAC có cực đại hấp thụ thay đổi tùy theo độ phân cực của dung môi. Trong dung môi MeCN, hợp chất này có max= 425 nm, với dung môi
phân cực như MeOH, giá trị này là 355 nm. Phổ hấp thụ của TEAC và các cực đại hấp thụ của nó cũng được trình bày ở hình 3.3 và bảng 3.1.
Hình 3.1. Phổ hấp thụ của MEAC trong các dung môi khác nhau: (1) MeOH, (2) MeCN, (3) THF; (4) CHCl3.
Hình 3.2. Phổ hấp thụ của DEAC trong các dung môi khác nhau: (1) MeCN,
(2) MeOH, (3) THF; (4) CHCl3.
Hình 3.3. Phổ hấp thụ của thuốc thử TEAC trong các dung môi khác nhau.
Bảng 3.1. Ảnh hưởng của dung môi đến phổ hấp thụ của TEAC
Tính chất | Hằng số điện môi () | max(1) (nm) Dạng Azo-enol | max(2) (nm) Dạng Keto-hydrazo | |
MeOH | Lưỡng proton | 32,6 | 385 | - |
MeCN | Trơ | 37,5 | 355 | 470 |
THF | Bazơ | 7,5 | 345 | 470 |
CHCl3 | Trơ | 4,8 | 350 | 470 |
H2O | Lưỡng proton | 80,4 | - | - |
Có thể bạn quan tâm!
-
 Vài Nét Về Hóa Học Siêu Phân Tử Và Phức Host-Guest
Vài Nét Về Hóa Học Siêu Phân Tử Và Phức Host-Guest -
 Một Số Thuốc Thử Hữu Cơ Dùng Để Xác Định Chì
Một Số Thuốc Thử Hữu Cơ Dùng Để Xác Định Chì -
 Phân Tích Định Lượng Ion Kim Loại Theo Phương Pháp Đường Chuẩn
Phân Tích Định Lượng Ion Kim Loại Theo Phương Pháp Đường Chuẩn -
 Khảo Sát Sự Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại
Khảo Sát Sự Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại -
 Khảo Sát Các Yếu Tổ Ảnh Hưởng Đến Sự Hình Thành Hệ Phức Teac- Th(Iv), Teac-Cr(Iii) Và Teac-Pb(Ii)
Khảo Sát Các Yếu Tổ Ảnh Hưởng Đến Sự Hình Thành Hệ Phức Teac- Th(Iv), Teac-Cr(Iii) Và Teac-Pb(Ii) -
 Tính Toán Mật Độ Điện Tích Cân Bằng Của Các Nhóm Chức
Tính Toán Mật Độ Điện Tích Cân Bằng Của Các Nhóm Chức
Xem toàn bộ 130 trang tài liệu này.
Theo các nghiên cứu của Deligoz [46,47], Karci [80] và Sener [136], sự thay đổi màu sắc cũng như phổ hấp thụ của các azocalixaren là do sự chuyển dịch cân bằng giữa hai loại đồng phân hỗ biến azo-enol và keto-hydrazo. Do đó, cơ chế thay đổi phổ hấp thụ của MEAC, DEAC và TEAC trong dung môi cũng có thể được giải thích tương tự như sau: Trong dung môi, các thuốc thử này tồn tại một cân bằng hai dạng azo-enol và keto-hydrazo (xem hình 3.4). Khi một proton H tách ra khỏi nhóm OH và chuyển vị đến nhóm azo, toàn bộ phân tử có sự chuyển dịch điện tích từ nguyên tử oxi đến các
nguyên tử N. Sự thay đổi này làm cho phân tử chuyển dịch mạch liên hợp từ dạng azo- enol sang dạng keto-hydrazo. Chính mạch liên hợp gồm các nhóm –C=O và nhóm
C=N tạo nên hiệu ứng bathorchromic nên xuất hiện cực đại hấp thụ thứ hai ở khoảng bước sóng 470-480 nm (tương ứng với bước nhảy của các electron từ n*).
Chẳng hạn như MeOH là dung môi có khả năng cho proton và có hằng số điện môi cao ( = 32,6). Vì thế, trong dung môi này, khả năng nhường proton của các azocalixaren giảm đi, cân bằng azo-enol ⇌ keto-hydrazo chuyển dịch theo chiều nghịch. Do đó, các thuốc thử này tồn tại chủ yếu ở dạng azo-enol và phổ hấp thụ của chúng trong dung môi MeOH chính là phổ của dạng azo-enol. Dung môi MeCN được xếp vào nhóm dung môi chuyển tiếp, có tính bazơ nên ảnh hưởng đến quá trình trao đổi proton của các azocalixaren bằng cách hình thành liên kết hydro với các proton của nhóm –OH. Do đó khả năng tách proton H tăng, giúp cân bằng dịch chuyển theo chiều tạo ra keto-hydrazo. Tương tự THF thuộc loại dung môi bazơ, do đó khả năng tách proton của các dẫn xuất này tăng lên, cân bằng tạo keto-hydrazo ưu thế hơn nên phổ hấp thụ của thuốc thử trong dung môi này tách thành pic mới rõ rệt ở 470490 nm. Trong khi đó, CHCl3 là dung môi trơ và hằng số điện môi thấp, khả năng phân cực kém nên không ảnh hưởng; vì thế trong dung môi này thường tồn tại cả 2 dạng trên.
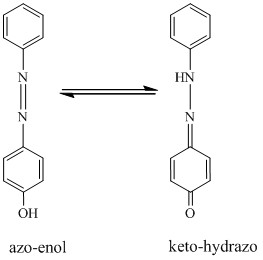
Hình 3.4. Hai dạng tồn tại của azocalixaren (chỉ biểu diễn một mạch liên hợp).
3.1.1.2. Ảnh hưởng của pH
Ảnh hưởng của pH đến phổ hấp thụ của MEAC, DEAC và TEAC cũng đã được khảo sát. Kết quả được trình bày tóm tắt ở bảng 3.2 cho thấy trong môi trường axit, các azocalixaren có các cực đại hấp thụ trong khoảng 350385 nm, trong môi trường bazơ cực đại mới xuất hiện trong khoảng 470500 nm. Hiện tượng này cũng được giải thích là do ảnh hưởng của sự xuất hiện ion H+, ion OH- trong dung dịch dẫn đến cân bằng
azo-enol ⇌ keto-hydrazo thay đổi.
Bảng 3.2. Cực đại hấp thụ của MEAC, DEAC và TEAC ở các môi trường khác nhau
MEAC | DEAC | TEAC | ||||
Dung môi | max(1) (nm) | max(2) (nm) | max(1) (nm) | max(2) (nm) | max(1) (nm) | max(2) (nm) |
MeOH +HCl | 385 | - | 350 | - | 385 | - |
MeOH+KOH | 375 | 510 | 345 | 490 | 375 | 490 |
MeCN +HCl | 382 | - | 360 | - | 380 | 470 |
MeCN+KOH | 375 | 488 | 355 | 500 | 355 | 490 |
THF+HCl | 410 | 352 | 345 | 470 | ||
THF+KOH | 400 | 515 | 345 | 510 | 350 | 495 |
Hình 3.5 biểu diễn sự thay đổi phổ hấp thụ của TEAC ở các giá trị pH khác nhau trong dung môi MeOH+H2O. Ở giá trị pH thấp, TEAC có cực đại hấp thụ ở khoảng 375 nm, ở pH bazơ, xuất hiện cực đại hấp thụ ở 370 nm và ở 490 nm. Các đường cong này giao nhau ở một điểm uốn 455 nm, đây chính là điểm đẳng quang của thuốc thử tự do. Sự thay đổi phổ hấp thụ của TEAC theo pH được chứng minh qua quá trình chuyển dịch cấu trúc phân tử TEAC ở hình 3.6.
1.0
0.8
0.6
0.4
0.2
(d)
(c)
(b)
(a)
0.0
300 350 400 450 500 550 600 650 700
Wavelenght(nm)
Absorbance
Hình 3.5. Phổ hấp thụ của TEAC trong MeOH+H2O ở các giá trị pH khác nhau: (a), pH =1,2; (b), pH =3,4; (c), pH =7,5; (d) pH =11,8.
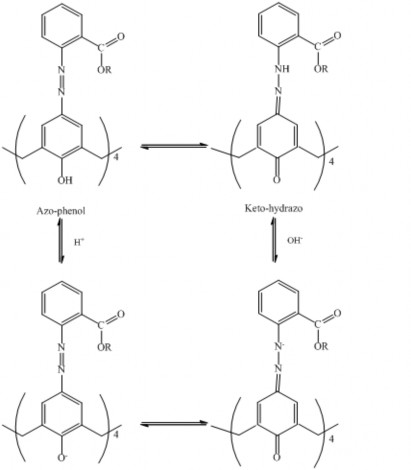
Hình 3.6. Ảnh hưởng của pH đến quá trình dịch chuyển cấu trúc của TEAC.