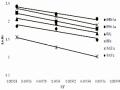
khuấy hay tốc độ khuếch tán ngoài không ảnh hưởng đến khả năng hấp phụ. Trên cơ sở chỉ ra trong Bảng 3.24, tốc độ khuấy 170 vòng/phút được chọn để nghiên cứu các quy luật hấp phụ.
Bảng 3.24. Hiệu suất hấp phụ Hx(%) của anion phốtphat trên bentonit biến tính sau 120 phút khuấy
H150(%) | H170(%) | H200(%) | H240(%) | |
B40-La | 39,77 | 41,74 | 41,84 | 41,94 |
B90-La | 45,12 | 48,37 | 48,44 | 48,27 |
BAl | 59,73 | 61,42 | 61,40 | 61,54 |
BFe | 65,57 | 68,79 | 69,93 | 69,33 |
BAlLa | 53,24 | 56,79 | 56,98 | 57,40 |
BAlFe | 67,17 | 70,07 | 70,63 | 72,74 |
Có thể bạn quan tâm!
-
 Nghiên Cứu Điều Chế Bentonit Biến Tính Nhôm Và Sắt
Nghiên Cứu Điều Chế Bentonit Biến Tính Nhôm Và Sắt -
 Đánh Giá Đặc Tính Lý Hoá Của Vật Liệu Bal Và Bfe
Đánh Giá Đặc Tính Lý Hoá Của Vật Liệu Bal Và Bfe -
 Giản Đồ Xrd Của Mẫu A) Balla-Tx Và B) Balfe-Tx Điều Chế Ở Nhiệt Độ
Giản Đồ Xrd Của Mẫu A) Balla-Tx Và B) Balfe-Tx Điều Chế Ở Nhiệt Độ -
 Các Tham Số Nhiệt Động Học Hấp Phụ Phốtpho Trên Bentonit Biến Tính
Các Tham Số Nhiệt Động Học Hấp Phụ Phốtpho Trên Bentonit Biến Tính -
 Thành Phần Hoá Học Và Tính Chất Bề Mặt Của Vật Liệu Sau Khi Hấp Phụ
Thành Phần Hoá Học Và Tính Chất Bề Mặt Của Vật Liệu Sau Khi Hấp Phụ -
 Sự Biến Đổi Nồng Độ Pht Trong Cột Đối Chứng Và Cột Xử Lý Với Tỉ Lệ B90- La:p Là 230:1, 340:1 Và 450:1.
Sự Biến Đổi Nồng Độ Pht Trong Cột Đối Chứng Và Cột Xử Lý Với Tỉ Lệ B90- La:p Là 230:1, 340:1 Và 450:1.
Xem toàn bộ 213 trang tài liệu này.
3.5.1.2. Xác định thời gian đạt cân bằng hấp phụ
Ảnh hưởng của thời gian đến khả năng hấp phụ phốtpho dưới dạng phốtphat lên bentonit biến tính được nghiên cứu trong điều kiện: nồng độ phốtphat là 10 mgP/l (đối với B40-La, B90-La) và 15 mgP/l (đối với BAl, BFe, BAlLa và BAlFe), lượng chất hấp phụ 1 g/L, pH = 6, nhiệt độ 25oC, tốc độ khuấy 170 vòng/phút. Tiến hành lấy mẫu sau các khoảng thời gian trong vòng 8 giờ và phân tích nồng độ phốtpho còn lại trong dung dịch. Kết quả khảo sát ảnh hưởng của thời gian đến khả
năng hấp phụ phốtphat của vật liệu bentonit không biến tính và bentonit biến tính
được trình bày trong Hình 3.24.
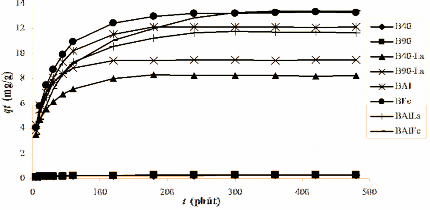
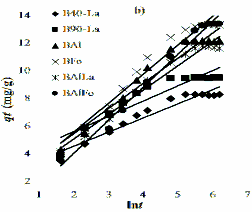
Hình 3.24. Sự phụ thuộc của dung lượng hấp phụ phốtpho của bentonit biến tính theo thời gian.
Từ kết quả trình bày trên Hình 3.24 cho thấy, quá trình hấp phụ phốtpho trên bentonit biến tính xảy ra nhanh trong thời gian 1 giờ đầu, sau đó giảm dần khi thời gian tăng và đạt cân bằng sau 4 giờ. Bentonit chưa biến tính (B40, B90) dùng làm nguyên liệu để điều chế bentonit biến tính có khả năng hấp phụ phốtpho rất ít (qe < 0,32 mg/g). Bentonit biến tính có khả năng hấp phụ anion phốtphat lớn hơn rất nhiều so với bentonit nguyên liệu, bởi vì số tâm hoạt động trong bentonit biến tính tăng lên khi tác nhân biến tính được đưa vào lớp giữa của bentonit thông qua quá trình trao đổi giữa chúng với cation hiđrat lớp xen giữa. Như vậy, bentonit biến tính có khả năng hấp phụ phốtphat trong dung dịch tốt hơn bentonit không biến tính là do các tác nhân biến tính La, Al, Fe, Al/La và Al/Fe chứa trong cấu trúc vật liệu. Từ Hình 3.24 cho biết, khả năng hấp phụ phốtphat giảm theo thứ tự sau: BAlFe > BFe > BAl > BAlLa > B90-La > B40-La.
3.5.1.3. Ảnh hưởng của pH
Tiến hành thí nghiệm khảo sát ảnh hưởng của pH đến khả năng hấp phụ phốtpho như mô tả ở mục 2.5 trong phần thực nghiện. Dung lượng hấp phụ phốtpho trên bentonit biến tính La, Al, Fe, Al/La và Al/Fe ở pH dung dịch khác nhau được trình bày trong Hình 3.25.
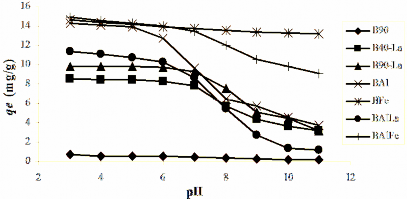
Hình 3.25. Sự phụ thuộc của dung lượng hấp phụ phốtpho của bentonit biến tính vào pH dung dịch.
Từ Hình 3.25 nhận thấy rằng, pH có ảnh hưởng đáng kể đến khả năng hấp phụ P trên vật liệu bentonit biến tính. Theo Zhu [161] và Shin [117], pH có ảnh hưởng đến khả năng hấp phụ của các ion trên bề mặt của pha rắn, đặc biệt là pha rắn với điện tích bề mặt thay đổi, chẳng hạn như: oxit nhôm, oxit sắt, các loại
khoáng sét. P hấp phụ trên oxit Fe/Al và khoáng đất sét chủ yếu thông qua cơ chế trao đổi phối tử với nhóm chức bề mặt, chẳng hạn Al-OH/OH2, Fe-OH/OH2, La-OH/OH2 [55, 130, 153, 157, 161].
Dung lượng hấp phụ phốtphat thay đổi không nhiều trong khoảng pH từ 3
đến 6. pH thích hợp cho quá trình hấp phụ phốtpho trên bentonit biến tính từ 3 đến
2-
6. Dung lượng hấp phụ phốtpho giảm khi pH tăng. Kết quả này cho thấy, pH của dung dịch có ảnh hưởng đến sự tồn tại của các thành phần ion phốtphat trong dung dịch. Các loại ion phốtphat khác nhau tồn tại trong dung dịch có pH khác nhau được tính toán từ chương trình Visual Minteq [62] được chỉ ra trong Hình 3.26 cho thấy rằng, trong khoảng pH từ 3 đến 6 tồn tại chủ yếu loại ion đihyđrophốtphat (H2PO4-). Ion hyđrophốtphat (HPO4 ) tồn tại ở pH cao từ 8 đến 11.

Hình 3.26. Thành phần ion phốtphat trong dung dịch ở pH khác nhau.
Dung lượng hấp phụ phốtpho (qe) tăng lên khi nồng độ anion H2PO4- tăng (Hình 3.25). Điều này cho thấy rằng các tác nhân biến tính (La, Al, Fe, Al/La, Al/Fe) có ái lực lớn với ion đihyđrophốtphat (H2PO4-). Ở môi trường pH thấp (pH 3
– 6) các nhóm hyđroxyl bề mặt của M – OH (M là Al, Fe, La) có thể được proton
hoá tạo thành nhóm mang điện tích dương. Quá trình proton hoá có thể xảy ra theo phương trình sau: ≡M – OH + H+ ↔ ≡M – OH2+. Khi đó, nhóm M – OH không mang điện tích tạo thành nhóm M – OH2+ mang điện tích dương. Nhóm này có thể tương tác với anion đihyđrophốtphat trong dung dịch dễ dàng [55, 157]. Điều này
cho thấy, ion phốtphat đơn hoá trị có thể phản ứng với các tâm hoạt động của
bentonit biến tính dễ dàng hơn. Vì vậy, một lý do khác khác giải thích hiệu quả hấp phụ phốtphat của vật liệu bentonit biến tính ở pH thấp là do bản chất của các loại anion phốtphat tồn tại trong dung dịch [55, 124, 129].
Khi pH tăng từ 7 đến 11 thì dung lượng hấp phụ phốtpho giảm mạnh. Nguyên nhân ảnh hưởng của pH đến quá trình hấp phụ phốtphat trên bentonit biến tính được giải thích như sau: ở pH cao, bề mặt vật liệu hấp phụ mang điện tích âm hơn và do đó xuất hiện tương tác đẩy mạnh hơn giữa các ion mang điện tích âm trong dung dịch (anion phốtphat) với điện tích âm nằm trên bề mặt lớp sét bentonit, dẫn đến khả năng
hấp phụ giảm. Hơn nữa, trong khoảng pH cao, nồng độ ion OH- là khá cao, dẫn đến
sự cạnh tranh hấp phụ giữa ion OH- và các loại anion phốtphat trong dung dịch đối với các tâm hấp phụ của vật liệu bentonit biến tính tăng lên [63].
Tuy nhiên, hấp phụ phốtphat trên các vật liệu BFe, BAlFe ít phụ thuộc vào pH của dung dịch. So sánh với các giá trị hấp phụ phốtphat cực đại của BFe và BAlFe ít hơn khoảng 10% và 38% ở các giá trị pH khác nhau. Theo Zhu [161], sự có mặt của polyoxocation sắt trong lớp xen giữa của bentonit biến tính có khả năng tăng cường ái lực hấp phụ của các tâm hoạt động với anion phốtphat trong dung dịch.
3.5.1.4. Động học hấp phụ phốtpho trên bentonit biến tính
Tiến hành khảo sát động học hấp phụ phốtpho trên bentonit biến tính mô tả ở mục 2.5 trong phần thực nghiệm. Mô hình động học biểu kiến bậc 2 (2.8) và mô hình Elovich (2.10) thường được sử dụng mô tả động học hấp phụ phốtpho trên bentonit biến tính [55, 130, 148]. Đồ thị tuyến tính theo mô hình động học biểu kiến bậc 2 (2.8) và mô hình Elovich (2.10) được trình bày trong Hình 3.27.
Tính toán các tham số trong mô hình động học biểu kiến bậc 2 và mô hình Elovich trong Hình 3.27 được trình bày trong Bảng 3.25. Từ kết quả cho trong Bảng
3.25 nhận thấy rằng, tất cả các hệ số tương quan của phương trình động học biểu kiến bậc 2 đều lớn hơn so với phương trình Elovich, điều đó có nghĩa là phương trình động học biểu kiến bậc 2 mô tả tốt quy luật động học hấp phụ phốtpho trên bentonit biến tính ở 25oC với hệ số tương quan cao (R2 > 0,99). Kết quả này phù hợp với nghiên cứu động học hấp phụ phốtpho trên bentonit biến tính của một số tác giả [130,
161]. Bentonit biến tính có khả năng hấp phụ phốtpho nhanh trong 1 giờ đầu, trong bước hấp phụ này xảy ra quá trình trao đổi phối tử giữa anion phốtphat và nhóm OH-
/OH2 của tác nhân biến tính (La-OH-/OH2, Al-OH-/OH2, Fe-OH-/OH2), cũng như tương tác tĩnh điện của tâm hoạt động có trong bentonit biến tính [55, 148, 157, 161]. Dung lượng hấp phụ phốtpho thay đổi phụ thuộc vào tác nhân biến tính lớp xen giữa bentonit biến tính và được sắp xếp theo thứ tự tăng dần như sau: qe(B40-La) < qe(B90- La) < qe(BAlLa) < qe(BAl) < qe(BFe) < qe(BAlFe). Hằng số tốc độ hấp phụ (k) của B90-La và B40-La lớn hơn nhiều so với các mẫu bentonit biến tính còn lại và mẫu BAlFe có hằng số tốc độ hấp phụ thấp nhất (k = 0,0026 g/mg.phút).
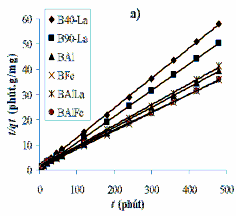
Hình 3.27. Động học hấp phụ phốtphat của bentonit biến tính: (a) Dạng tuyến tính của phương trình động học biểu kiến bậc 2; b) Dạng tuyến tính của phương trình Elovich.
Chất hấp phụ | Mô hình động học biểu kiến bậc 2 t = 1 t + 1 q q kq2 | Mô hình Elovich q = 1 ln t + 1 ln (αβ ) t β β | ||||
k (g/mg.phút) | qe (mg/g) | R2 | α (mg/g.phút) | β (g/mg) | R2 | |
B40-La | 0,0142 | 8,4459 | 0,9997 | 12,0449 | 0,9774 | 0,9326 |
B90-La | 0,0169 | 9,6712 | 0,9999 | 25,5317 | 0,9107 | 0,8635 |
BAl | 0,0064 | 12,5628 | 0,9977 | 4,9414 | 0,5466 | 0,9445 |
BFe | 0,0049 | 13,8313 | 0,9998 | 3,3579 | 0,4372 | 0,9751 |
BAlLa | 0,0055 | 12,1507 | 0,9995 | 4,2613 | 0,5657 | 0,9729 |
BAlFe | 0,0026 | 14,2248 | 0,9988 | 1,7954 | 0,4194 | 0,9886 |
Bảng 3.25. Các tham số động học hấp phụ phốtpho của bentonit biến tính
t e e
Như đề cập trong Bảng 3.25, thống số α là tốc độ hấp phụ ban đầu trong mô hình Elovich, do đó có thể xem là tốc độ động học ở bước hấp phụ nhanh trong khoảng thời gian 1 giờ của vật liệu bentonit biến tính. Giá trị α của B90-La và B40-La cao hơn rất nhiều so với các mẫu BAl, BFe, BAlLa và BAlFe, kết quả phân tích phù hợp chỉ ra trong Hình 3.24.
3.5.1.5. Đường đẳng nhiệt hấp phụ
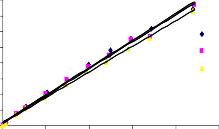
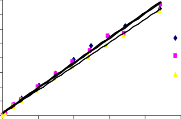
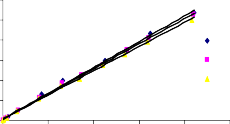
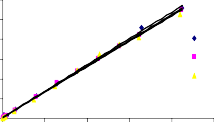
Tiến hành khảo sát đường đẳng nhiệt hấp phụ như mô tả trong mục 2.5 ở phần thực nghiệm. Các điều kiện tiến hành hấp phụ ở nhiệt độ 25oC, 30oC và 35oC, nồng độ phốtpho từ 2,5 mg/l đến 100 mg/l, lượng chất hấp phụ 1 g/l, pH 5, tốc độ khuấy 170 vòng/phút. Đường đẳng nhiệt hấp phụ phốtpho trên vật liệu rắn, khoáng phyllosilicat và oxit kim loại [130, 148, 150, 161] thường mô tả theo phương trình Langmuir (2.12) và Freundlich (2.13). Đồ thị tuyến tính theo phương trình Langmuir (2.12) và Freundlich (2.13) được trình bày trong Hình 3.28 và 3.29.
Các dữ kiện đường đẳng nhiệt hấp phụ P trên bentonit biến tính là phù hợp với phương trình Langmuir và Freundlich, tính toán các tham số đặc trưng chỉ ra cho Bảng 3.26. Từ kết quả chỉ ra trong Bảng 3.26 nhận thấy rằng, tất cả các hệ số tương quan của phương trình Langmuir đều lớn hơn (R2 > 0,97) so với phương trình Freundlich, điều đó có nghĩa là phương trình đẳng nhiệt Langmuir mô tả quá trình
hấp phụ phốtpho trên bentonit biến tính phù hợp hơn so với phương trình Freundlich trong khoảng nhiệt độ 25oC đến 35oC.
Từ kết quả chỉ ra trong Bảng 3.26 cho thấy, dung lượng hấp phụ bão hoà đơn lớp (qm) tỉ lệ thuận với nhiệt độ, nghĩa là dung lượng hấp phụ phốtphat trên bentonit biến tính tăng khi nhiệt độ tăng và quá trình hấp phụ là thu nhiệt. Giá trị qm tăng đi kèm với nhu cầu năng lượng cao cho quá trình hấp phụ phốtphat trên các vật liệu hấp phụ khảo sát. Giá trị qm và KL trình bày trong Bảng 3.26 cho thấy, dung lượng hấp phụ cực đại và ái lực của bentonit biến tính đối với phốtpho trong dung dịch được sắp xếp theo thứ tự: B40-La < B90-La < BAlLa < BAl < BFe < BAlFe. Dung lượng hấp phụ phốtpho của vật liệu BAl, BFe, BAlFe cao hơn B40-La, B90-La và BAlLa, phù hợp với kết quả chỉ ra trong phương trình Langmuir. Các kết quả này phù hợp với các báo cáo trước đó về sự hấp phụ phốtphat trong dung dịch nước trên chất hấp phụ có chứa nhôm, sắt hoặc lantan [41, 55, 130, 148, 161].
a)
8
7
25°C
30°C
35°C
(g /L )
6
5
C e /q e
4
3
2
1
0
0 20 40 60 80 100
Ce (mg/L)
b)
8
7
25°C
30°C
35°C
( g /L )
6
5
C e /q e
4
3
2
1
0
0 20 40 60 80 100
Ce (mg/L)
c)
6
25°C
30°C
35°C
(g /L )
5
4
C e /q e
3
2
1
0
0 20 40 60 80 100
Ce (mg/L)
d)
6
25°C
30°C
35°C
(g /L )
5
4
C e /q e
3
2
1
0
0 20 40 60 80 100
Ce (mg/L)

8 e)
7
Ce/qe (g/L)
6
25°C
30°C
35°C
5
4
3
2
1
0
0 20 40 60 80 100
Ce (mg/L)
5 f)

C e /q e (g /L )
4
25°C
30°C
35°C
3
2
1
0
0 20 40 60 80 100
Ce (mg/L)
Hình 3.28. Dạng tuyến tính theo phương trình đẳng nhiệt Langmuir của quá trình hấp phụ phốtphat trên a) B40-La, b) B90-La, c) BAl, d) BFe, e) BAlLa, f) BAlFe.
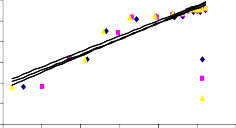
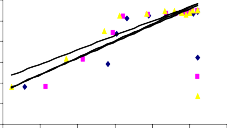
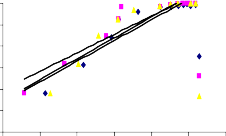
Trong phương trình Freundlich, KF và 1/n là các hằng số có liên quan đến khả năng hấp phụ và cường độ hấp phụ tương ứng. Giá trị KF của các mẫu BAl, BFe, BAlFe (8,41; 8,54 và 8,97 ở 35oC) lớn hơn so với B40-La, B90-La và BAlLa (4,50; 6,51 và 5,94 ở 35oC). Theo các kết quả này cho thấy, dung lượng hấp phụ của
các mẫu BAl, BFe và BAlFe lớn hơn so với các mẫu B90-La, B40-La, BAlLa có giá trị KF thấp. Hầu như giá trị KF tăng lên khi tăng nhiệt độ, điều này cho thấy dung lượng hấp phụ phốtpho trên vật liệu bentonit biến tính tăng khi nhiệt độ tăng. Giá trị 1/n nằm trong khoảng từ 0 đến 1, cho thấy quá trình hấp phụ phốtpho trên bentonit biến tính đạt hiệu quả cao.
3
2.5
L n q e
2
1.5
1
0.5
0
3
2.5
L nq e
2
1.5
1
0.5
0
a)
25°C
30°C
35°C

-4 -2 0 2 4 6
LnCe
c)
25°C
30°C
35°C
-6 -4 -2 0 2 4 6
LnCe
3
2.5
L nq e
2
1.5
1
0.5
0
3
2.5
L nq e
2
1.5
1
0.5
0
b)
25°C
30°C
35°C

-4 -2 0 2 4 6
LnCe
d)
25°C
30°C
35°C
-6 -4 -2 0 2 4 6
LnCe
3
2.5
L nq e
2
1.5
1
0.5
0
e)
25°C
30°C
35°C

-2 0 2 4 6
LnCe
3
2.5
L n q e
2
1.5
1
0.5
0
f)
25°C
30°C
35°C
-6 -4 -2 0 2 4 6
LnCe
Hình 3.29. Dạng tuyến tính theo phương trình đẳng nhiệt Freundlich của quá trình hấp phụ phốtphat trên a) B40-La, b) B90-La, c) BAl, d) BFe, e) BAlLa, f) BAlFe.