Bảng 3.26. Các tham số phương trình Langmuir và Freundlich của quá trình hấp phụ phốtpho trên bentonit biến tính ở 25oC, 30oC và 35oC
Nhiệt độ | Langmuir Ce = Ce + 1 qe qm KL .qm | Freundlich ln q = 1 ln C + ln K e n e F | |||||
KL (L/mg) | qm (mg/g) | R2 | 1/n | KF (L/g) | R2 | ||
B40-La | 25oC | 0,3492 | 7,994 | 0,9850 | 0,1515 | 4,1745 | 0,9347 |
30oC | 0,4283 | 8,562 | 0,9924 | 0,1569 | 4,4440 | 0,9062 | |
35oC | 0,4722 | 9,191 | 0,9783 | 0,1472 | 4,9973 | 0,9112 | |
B90-La | 25oC | 0,4284 | 11,494 | 0,9935 | 0,1721 | 5,6820 | 0,8564 |
30oC | 0,5346 | 11,587 | 0,9959 | 0,1744 | 5,7973 | 0,8673 | |
35oC | 0,6293 | 12,195 | 0,9982 | 0,1572 | 6,5097 | 0,8832 | |
BAl | 25oC | 1,2514 | 14,993 | 0,9990 | 0,1866 | 7,8264 | 0,8980 |
30oC | 1,3784 | 15,337 | 0,9995 | 0,1983 | 7,7493 | 0,8938 | |
35oC | 1,4737 | 15,528 | 0,9966 | 0,1857 | 8,4090 | 0,9045 | |
BFe | 25oC | 0,8616 | 15,601 | 0,9976 | 0,1987 | 7,3126 | 0,8395 |
30oC | 0,9385 | 15,974 | 0,9986 | 0,2028 | 7,5172 | 0,8515 | |
35oC | 0,9526 | 16,584 | 0,9987 | 0,1733 | 8,5361 | 0,8738 | |
BAlLa | 25oC | 0,2804 | 12,837 | 0,9837 | 0,2583 | 4,5254 | 0,6893 |
30oC | 0,3622 | 13,680 | 0,9912 | 0,2488 | 5,1469 | 0,7383 | |
35oC | 0.6231 | 14,265 | 0,9939 | 0,2351 | 5,9405 | 0,7534 | |
BAlFe | 25oC | 1,6226 | 19,379 | 0,9996 | 0,2412 | 8,2780 | 0,8789 |
30oC | 1,8679 | 20,202 | 0,9997 | 0,2149 | 9,7484 | 0,8770 | |
35oC | 1,9289 | 20,492 | 0,9997 | 0,2425 | 8,9863 | 0,8569 |
Có thể bạn quan tâm!
-
 Đánh Giá Đặc Tính Lý Hoá Của Vật Liệu Bal Và Bfe
Đánh Giá Đặc Tính Lý Hoá Của Vật Liệu Bal Và Bfe -
 Giản Đồ Xrd Của Mẫu A) Balla-Tx Và B) Balfe-Tx Điều Chế Ở Nhiệt Độ
Giản Đồ Xrd Của Mẫu A) Balla-Tx Và B) Balfe-Tx Điều Chế Ở Nhiệt Độ -
 Sự Phụ Thuộc Của Dung Lượng Hấp Phụ Phốtpho Của Bentonit Biến Tính Theo Thời Gian.
Sự Phụ Thuộc Của Dung Lượng Hấp Phụ Phốtpho Của Bentonit Biến Tính Theo Thời Gian. -
 Thành Phần Hoá Học Và Tính Chất Bề Mặt Của Vật Liệu Sau Khi Hấp Phụ
Thành Phần Hoá Học Và Tính Chất Bề Mặt Của Vật Liệu Sau Khi Hấp Phụ -
 Sự Biến Đổi Nồng Độ Pht Trong Cột Đối Chứng Và Cột Xử Lý Với Tỉ Lệ B90- La:p Là 230:1, 340:1 Và 450:1.
Sự Biến Đổi Nồng Độ Pht Trong Cột Đối Chứng Và Cột Xử Lý Với Tỉ Lệ B90- La:p Là 230:1, 340:1 Và 450:1. -
 Nồng Độ N-No2- (Mg/l) Của Khu Vực Xử Lý Và Khu Vực Đối Chứng Trong Thời Gian Thử Nghiệm: (♦) Khu Vực Xử Lý, (■) Khu Vực Đối Chứng.
Nồng Độ N-No2- (Mg/l) Của Khu Vực Xử Lý Và Khu Vực Đối Chứng Trong Thời Gian Thử Nghiệm: (♦) Khu Vực Xử Lý, (■) Khu Vực Đối Chứng.
Xem toàn bộ 213 trang tài liệu này.
So sánh dung lượng hấp phụ phốtpho trên các chất hấp phụ khác được chỉ ra trong Bảng 3.27. Do sự khác nhau về điều kiện thực nghiệm như nồng độ phốtpho ban đầu, pH, nhiệt độ và ảnh hưởng của các ion cản, nên sự so sánh dung lượng hấp phụ phốtpho của các chất hấp phụ chỉ mang tính chất tương đối.
Nói chung dung lượng hấp phụ phốtpho của bentonit biến tính La, Al, Fe, Al/La và Al/Fe nằm trong khoảng 8 ÷ 20 mg/g cao hơn nhiều so với các loại đất sét chưa biến tính (montmorillonit, kaolinit, Illit) nhưng thấp hơn vật liệu Alclast, La10-
meso-SiO2 [63, 92] và gần bằng palygorskit [150]. Khả năng hấp phụ của bentonit biến tính lantan trong nghiên cứu này (qm trong Bảng 3.26 là 7,99 – 12,19 mg/g) phù hợp với báo cáo của Haghseresht [55]. Dung lượng hấp phụ cực đại của BAl trong nghiên cứu này cao hơn giá trị qm của BAl và giá trị qm của BAlLa nhỏ hơn nghiên cứu của Tian [130]. Trong khi đó giá trị qm của BFe và BAlFe cao hơn kết quả nghiên cứu của một số tác giả khác [148, 161]. Từ kết quả nghiên cứu này cho thấy rằng, khả năng hấp phụ phốtpho trên chất hấp phụ phụ thuộc vào nguồn gốc các loại khoáng sét và quá trình điều chế sản phẩm. Như vậy, các loại tác nhân biến tính (La, Al, Fe, Al/La, Al/Fe) tăng cường khả năng hấp phụ loại bỏ phốtpho trong dung dịch nước có hiệu quả.
Bảng 3.27. So sánh dung lượng hấp phụ phốtphat của một số chất hấp phụ
pH | Nồng độ phốtphat (mgP/L) | Dung lượng hấp phụ (mgP/g) | Tài liệu tham khảo | |
Montmorillonit | 7,6 | 2,5-25 | 0,746 | [43] |
Kaolinit | 7 – 8 | 3,4 – 40 | 0,091 | [43] |
Illit | 7,5 | 10 – 30 | 2,51 | [43] |
Alclast | 3 – 4 | 99,2 | 20,46 – 26,97 | [63] |
La10-meso-SiO2 | 3 | 31,31 | 23,1 | [92] |
Palygorskit | 4,46 | 600 | 8,31 | [150] |
3.5.1.6. Các tham số nhiệt động học hấp phụ phốtpho trên bentonit biến tính
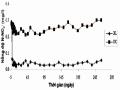
Khảo sát ảnh hưởng của nhiệt độ đến quá trình hấp phụ, cũng như tính toán các đại lượng nhiệt động học, thay đổi nhiệt độ khảo sát từ 298 đến 308K. Thí nghiệm được tiến hành như mô tả ở mục 2.5 trong phần thực nghiệm. Để tính nhiệt động học của quá trình hấp phụ, sử dụng phương trình (2.16). Giá trị KC được tính từ phương trình (2.15) và KL (tính từ phương trình đẳng nhiệt Langmuir) ở các nhiệt độ khác nhau được chỉ ra trong Bảng 3.28.
Hồi quy tuyến tính các giá trị thực nghiệm (lnKC, 1/T) theo phương trình (2.17) được biểu diễn trong Hình 3.30. Về nguyên tắc thì giá trị KC và KL trong Bảng 3.28 đều có thể áp dụng để tính toán các tham số động học. Kết quả thu được
từ đường hồi quy tuyến tính lnKC và 1/T đều cho giá trị dương
∆H và ∆S
dương và
không đổi trong khoảng nhiệt độ đang nghiên cứu. Tuy nhiên, trong nghiên cứu
này, sử dụng giá trị KC tính từ phương trình (2.15) chỉ ra trong Bảng 3.28. Đây là giá trị thực nghiệm cụ thể tại các nhiệt độ khác nhau. Từ độ dốc của đường hồi quy
và điểm cắt của đường hồi quy với trục tung tính được giá trị
∆H và ∆S . Tất cả các
tham số nhiệt động học tính toán từ Hình 3.30 được liệt kê trong Bảng 3.29.
Bảng 3.28. Giá trị KC và KL ở các nhiệt độ 298K, 303K và 308K
Chất hấp phụ | ||||||
B40-La | 4,479 | 0,3492 | 6,084 | 0,4283 | 6,547 | 0,4722 |
B90-La | 6,082 | 0,4284 | 7,380 | 0,5346 | 9,417 | 0,6293 |
BAl | 5,337 | 1,2514 | 7,013 | 1,3784 | 7,961 | 1,4737 |
BFe | 6,740 | 0,8616 | 8,482 | 0,9385 | 10,755 | 0,9526 |
BAlLa | 2,787 | 0,4333 | 3,600 | 0,5652 | 4,809 | 0,6313 |
BAlFe | 7,939 | 1,6226 | 9,190 | 1,8679 | 11,315 | 1,9289 |
298K
KC KL KC
303K
KL KC
308K
KL
Hình 3.30. Đồ thị biểu diễn lnKC qua 1/T của bentonit biến tính.
Giá trị âm của ∆G
và giá trị dương của ∆H
cho thấy hấp phụ phốtphat trên
B90-La, B40-La, BAl, BFe, BAlLa, BAlFe tự xảy ra trong điều kiện nhiệt động và thu nhiệt. Khả năng hấp phụ phốtphat tăng khi nhiệt độ tăng, thể hiện qua giá trị
∆G càng giảm khi tăng nhiệt độ. Giá trị của ∆G giảm –3,715 đến –4,812 kJ/mol
(B40-La), –4,473 đến –5,742 kJ/mol (B90-La), –4,149 đến –5,312 kJ/mol (BAl), –
4,727 đến –6,083 kJ/mol (BFe), –2,539 đến –4,022 kJ/mol (BAlLa) và –5,881 kJ/mol đến –6,213 kJ/mol (BAlFe) trong khoảng nhiệt độ 298 – 308 K. Kết quả này phù hợp với kết quả nghiên cứu về quá trình hấp phụ ion phốtphat trong môi trường nước trên vật liệu bentonit biến tính bởi một số tác giả khác [148, 152].
Từ Bảng 3.29 nhận thấy rằng, giá trị
∆H đủ lớn để đảm bảo tương tác mạnh
giữa các ion phốtphat trong dung dịch và chất hấp phụ bentonit biến tính. Giá trị
∆H của B40-La, B90-La, BAl, BFe, BAlLa và BAlFe lần lượt là 110,29; 126,79;
116,69; 135,50; 148,13 và 107,77 kJ/mol. Các giá trị dương của ∆S ở đây được giải
thích do ion phốtphat bị hấp phụ lên bề mặt tương tác rắn – lỏng được phân tán đồng thời giữa 2 pha, do vậy entropy cao hơn trong dung dịch [148]. Dung lượng hấp phụ của bentonit biến tính tăng ở nhiệt độ cao có thể nguyên nhân gây ra bởi kích thước lỗ xốp hoặc bản chất của tâm hoạt động trong chất hấp phụ [81, 148].
Bảng 3.29. Các tham số nhiệt động học của quá trình hấp phụ phốtphat lên bentonit biến tính
T (K) | KC | ∆ G (kJ/mol) | ∆ S (J/mol.K) | ∆ H (kJ/mol) | |
B40-La | 298 | 4,479 | -3,715 | 29,06 | 110,29 |
303 | 6,084 | -4,549 | |||
308 | 6,547 | -4,812 | |||
B90-La | 298 | 6,082 | -4,473 | 33,33 | 126,79 |
303 | 7,380 | -5,035 | |||
308 | 9,417 | -5,742 | |||
BAl | 298 | 5,337 | -4,149 | 30,57 | 116,69 |
303 | 7,013 | -4,907 | |||
308 | 7,961 | -5,312 | |||
BFe | 298 | 6,740 | -4,727 | 35,66 | 135,50 |
303 | 8,482 | -5,386 | |||
308 | 10,755 | -6,083 | |||
BAlLa | 298 | 2,787 | -2,539 | 41,62 | 148,13 |
303 | 3,600 | -3,227 | |||
308 | 4,809 | -4,022 | |||
BAlFe | 298 | 7,939 | -5,881 | 27,01 | 107,77 |
303 | 9,190 | -5,993 | |||
308 | 11,315 | -6,213 |
3.5.1.7. Ảnh hưởng của một số ion cản
Tiến hành thí nghiệm ảnh hưởng của các ion cản đến khả năng hấp phụ phốtphat của vật liệu bentonit biến tính được mô tả ở mục 2.5 trong phần thực nghiệm với nồng độ ion cản là 0,5 mmol/L, pH 5, nồng độ phốtpho là 6,5 mgP/L, lượng chất hấp phụ 1 g/L. Phần trăm phốtpho bị hấp phụ trên bentonit biến tính được trình bày trong Bảng 3.30.
2- - -
Từ Bảng 3.30 nhận thấy rằng, phần trăm hấp phụ phốtpho của bentonit biến tính giảm khi có mặt của ion cản. Các anion cản có ảnh hưởng khác nhau đến khả năng hấp phụ phốtpho của bentonit biến tính và được sắp xếp theo thứ tự giảm dần như sau: HCO3- > Cl- > SO4 > NO3 . Trong số các anion, HCO3 có ảnh hưởng mạnh nhất đến khả năng hấp phụ phốtpho trên bentonit biến tính. Với nồng độ 0,5 mmol/l, HCO3- có thể làm giảm khả năng loại bỏ phốtphat từ 98,67% xuống 80,37% (B40-La), 99,63 % xuống 82,17% (B90-La), 98,60% xuống 77,83% (BAl),
99,82% xuống 88,26% (BFe), 99,37% xuống 81,50% (BAlLa) và 99,80% xuống 89,45% (BAlFe). Trong sự có mặt của mỗi loại anion, phần trăm loại bỏ phốtpho trên BFe, BAlFe lớn hơn B40-La, B90-La, BAl, BAlLa.
Bảng 3.30. Phần trăm phốtpho bị hấp phụ của bentonit biến tính với nồng độ PO43- (6,5mg/l) và nồng độ ion cản (NO3-, Cl-, SO42-, HCO3-) là 0,5 mmol/l
Phần trăm phốtpho bị hấp phụ (%) | ||||||
B40-La | B90-La | BAl | BFe | BAlLa | BAlFe | |
3- PO4 | 98,67 | 99,63 | 99,60 | 99,82 | 99,37 | 99,80 |
3- - PO4 + NO3 | 92,64 | 93,56 | 94,50 | 95,50 | 94,85 | 96,20 |
3- - PO4 + Cl | 91,69 | 92,47 | 92,44 | 94,43 | 92,67 | 95,37 |
3- 2- PO4 + SO4 | 83,11 | 86,02 | 88,14 | 90,23 | 87,66 | 92,17 |
3- - PO4 + HCO3 | 80,37 | 82,17 | 77,83 | 88,26 | 81,50 | 89,45 |
Phản ứng thường xảy ra trong quá trình hấp phụ phốtpho của bentonit biến tính là phản ứng trao đổi ion. Trong đó, có sự trao đổi xảy ra giữa các ion phốtphat và nhóm hyđroxyl định vị tại tâm mang điện tích dương của vật liệu [43, 55]. Vì vậy, khả năng hấp phụ phốtpho của bentonit biến tính giảm khi có mặt các ion cản được giải thích trên cơ chế trao đổi ion. Quá trình trao đổi xảy ra do sự thay thế nhóm OH- trong mạng lưới bằng ion phốtphat. Khi có các ion cản thì các ion này có
thể cạnh tranh với ion phốtphat trong việc liên kết với các tâm hấp phụ có trong bentonit biến tính. Các anion khác nhau ảnh hưởng đến khả năng hấp phụ phốtphat của bentonit biến tính là khác nhau, là do ái lực của các tâm hấp phụ với các anion này là khác nhau [63, 130, 149].
3.5.1.8. Khả năng lưu giữ phốtpho của bentonit biến tính
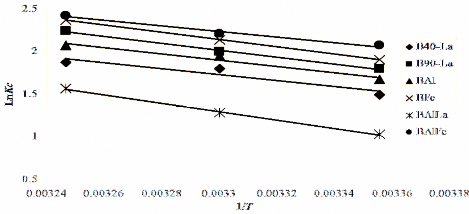
Tiến hành thí nghiệm như mục 2.5 trong phần thực nghiệm. Phần trăm phốtpho hấp phụ bị giải phóng trong khoảng pH khảo sát được chỉ ra trong Hình
3.31 cho thấy, ở pH càng cao phốtpho bị giải phóng tăng song phần trăm phốtpho bị giải phóng là không lớn, ở pH 9 giá trị này chỉ đạt 0,77% (B40-La), 0,57% (B90- La), 1,33% (BAl), 1,10% (BFe), 1,00% (BAlLa) và 0,99% (BAlFe) (Phụ lục P12– P17). Nồng độ phốtpho sau khi giải hấp thấp hơn nhiều so với nghiên cứu Zeng
[153] về sự giải hấp phụ P của oxit sắt. Như vậy có thể khẳng định phốtpho bị khóa trong cấu trúc của lớp aluminosilicat và giữ chặt chúng không cho phát sinh trở lại môi trường. Phần trăm phốtpho bị hấp phụ giải phóng tăng khi pH tăng, điều này được giải thích như sau: ở pH cao có sự cạnh tranh của ion OH- trong dung dịch với ion phốtphat đã hấp phụ làm một lượng nhỏ phốtpho bị đẩy ra.
Hình 3.31. Phần trăm phốtpho bị hấp phụ giải phóng phụ thuộc vào pH.
3.5.1.9. Cơ chế hấp phụ phốtpho của bentonit biến tính
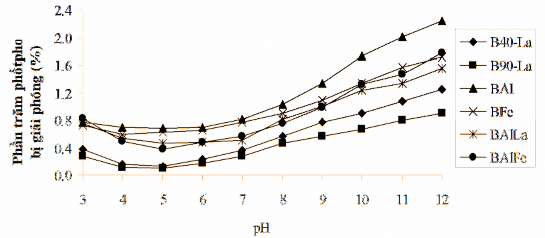
Để khảo sát cơ chế hấp phụ phốtpho trên bentonit biến tính, tiến hành thí nghiệm như mô tả ở mục 2.5. Sự biến đổi giá trị pH của dung dịch phốtpho trong thời gian thí nghiệm được chỉ ra trong Hình 3.32.
Hình 3.32. Sự biến đổi pH dung dịch theo thời gian hấp phụ phốtpho trên vật liệu bentonit biến tính.
Từ Hình 3.32 nhận thấy rằng, giá trị pH của tất cả các dung dịch nước hấp phụ phốtpho tăng nhanh trong thời gian đầu, sau đó giảm dần. Theo một số nghiên cứu trước đây [55, 63, 94, 149, 157] cho thấy, quá trình hấp phụ phốtphat trên vật liệu bentonit biến tính có liên quan đến nhóm M–OH/OH2 (M là La, Al, Fe).. Đối với mẫu vật liệu bentonit biến tính có chứa 2 loại nhóm OH (hoặc H2O) trong cấu trúc: nhóm OH phối trí với nguyên tử kim loại M – loại nhóm OH (b); và nhóm OH phối trí đôi với nguyên tử kim loại M – loại nhóm OH (a). Cả 2 nhóm này đều xảy ra quá trình hấp phụ anion phốtphat.
Quá trình thuỷ phân hợp chất của M trong môi trường nước được chỉ ra trong phương trình (3.1) và sơ đồ mô tả quá trình hấp phụ phốtphat trên nhóm OH (a) được trình bày trong phương trình (3.2) đến (3.4). Để hiểu rõ hơn về phản ứng hấp phụ phốtpho trên bentonit biến tính, viết phương trình hấp phụ cho hai loại anion
phốtphat cho mỗi loại ở các vị trí của nhóm OH (a). Phương trình (3.1) và phương trình (3.2) phát sinh ra ion H+, phương trình (3.3) và phương trình (3.4) phát sinh ra OH-. Hơn nữa trong phương trình (3.2) mô tả hai phản ứng đồng thời: (i) phản ứng trao đổi phối tử của giữa ion đihiđrophốtphat và nhóm OH; và (ii) phản ứng axit – bazơ giữa ion đihiđrophốtphat với nhóm hyđroxyl để tạo ra hiđrophốtphat và nước.
Loại nhóm OH (b) cũng tham gia vào quá trình hấp phụ với các ion phốtphat theo các cách khác nhau được trình bày trong phương trình (3.5) đến (3.7). Trong các phương trình từ (3.5) đến (3.7) chỉ ra quá trình phốtphat hấp phụ ở mỗi vị trí nhóm OH (b) và tạo ra môi trường kiềm, nghĩa là phát sinh ra ion hyđroxy đi kèm với phản ứng hấp phụ.
OH (b) OH (b)
(a)
OH (b) OH (b)
(a) (a)
(3.1)
M OH M
+ H2O
M OH HO M
+ H+
OH (b) OH (b)
(a)
M
+ KH PO
M HPO K + H O
(3.2)
OH 2 4 4 2
OH (b) OH (b)
(a)
M + KH PO
M H PO
+ KOH
(3.3)
OH 2 4 2 4
OH (b) OH (b)
(a)
M OH
+ K2HPO4
M HPO4K + KOH
(3.4)
O
OH (b) OH (b)
HO P OH
OH (b) O
(a)
M OH M
+ KH2PO4
(a)
M OH M
O
+ KOH
(3.5)
OH (b) OH (b)
HO P OK
OH (b) O
M
(a) OH
M
+ KH2PO4
(a)
M
OH M
+ H2O
(3.6)
O
OH (b) OH (b)
HO P OK
OH (b) O
M
(a) OH
M
+ K2HPO4
(a)
M
OH M
+ KOH
(3.7)