X (%) =-× 100
Trong đó: m1: Khối lượng mẫu trước khi sấy m2: Khối lượng mẫu sau khi sấy
m: Khối lượng mẫu trước khi sấy
2.5.4. Xác định hàm lượng cellulose
Mẫu được nghiền nhỏ thích hợp, sau đó xử lý lần lượt bằng dung dịch axit sulfuric và dung dịch natrihydroxit đun sôi. Cặn được tách bằng cách lọc, rửa, sấy khô, cân sau đó tro hóa. Sự hao hụt khối lượng sau khi tro hóa được gọi là cellulose [90]
Cân 2 - 3g mẫu cho vào bình hình cầu dung tích 1 lit, thêm vào 200ml dung dịch H2SO4 1,5%, lắp sinh hàn sau đó gia nhiệt đến sôi trong khoảng 30 phút. Lọc dung dịch qua giấy lọc và rửa lại nhiều lần bằng nước cất đun sôi cho đến khi không còn axit, dùng giấy pH để thử. Tiếp tục dùng 200ml dung dịch NaOH nồng độ khoảng 2-5% và gia nhiệt đến sôi trong vòng 30 phút để tiếp tục thủy phân. Thêm 2-3 giọt chất chống tạo bọt và tiến hành quá trình như xử lý. Lọc dung dịch sau đó rửa bã nhiều lần bằng nước cất và HCl 1% đến khi hết kiềm, dùng giấy pH để thử.
Chuyển toàn bộ xơ bã vào một chén nung đã sấy khô, cân bì. Sấy chén có xơ bã trong tủ sấy ở nhiệt độ 1050C trong 1 giờ, để nguội, cân. Sấy lại cho đến khối lượng không đổi.
Chuyển chén nung vào lò nung, nung đến tro trắng, làm nguội trong bình hút ẩm, cân. Nung đến khối lượng không đổi.
Hàm lượng cellulose thô còn được tính bằng % theo khối lượng chất khô như
sau:
X (%) =
Trong đó:
Mo – Khối lượng của mẫu, tính bằng g;
M1 - khối lượng chất xơ và cặn sau khi sấy, tính bằng g;
M2 – Khối lượng chất xơ và cặn sau khi đốt nóng trong lò nung, tính bằng g Wo - Hàm lượng chất khô của mẫu, biểu thị theo %
Kết quả là trung bình cộng của kết quả 2 lần xác định song song, tính chính xác đến 0,01%.
Chênh lệch kết quả 2 lần xác định song song không được quá 0,02%.
2.5.5. Xác định hàm lượng lignin
Thủy phân bằng kiềm
Cân 0,3g mẫu vào ống nghiệm, ghi lại khối lượng mẫu (chính xác đến 0,1mg). Thêm 3ml NaOH 2M, dùng đũa thủy tinh khuấy nhẹ nhàng sau đó để luôn đũa trong ống. Ủ 30°C, 60±5 phút. Mỗi 5-10 phút lại khuấy 1 lần, chú ý không nhấc đũa ra khỏi ống nghiệm.
Chuẩn bị các mẫu đối chứng đường (glucose, xylose, galacyose, arabinose, mannose) có nồng độ gần nhất với nồng độ ước tính có trong mẫu phân tích để hiệu chỉnh lượng đường bị phân hủy trong quá trình thủy phân bằng kiềm. Pha 10ml dung dịch đường với nồng độ yêu cầu, thêm 348µl NaOH 2M. Chuyển sang các ống nghiệm thủy tinh và đậy kín. Hấp 121°C, 1h các mẫu đường đối chứng và mẫu phân tích sau đó để nguội tự nhiên.
Xác định hàm lượng lignin không tan trong kiềm(AIL)
Nung chén ở 575±25°C đến khối lượng không đổi (sai lệch khối lượng không vượt quá 0.3mg sau 60 phút nung), ghi lại khối lượng chén.
Sấy giấy lọc không tro ở 105°C đến khối lượng không đổi, ghi lại khối lượng mo. Lọc dịch thủy phân thu được ở bước giấy lọc không tro với hệ thống hút chân không. Thu khoảng 50ml dịch lọc vào falcon để xác định hàm lượng lignin không tan trong acid và carbonhydrate. Mẫu dịch có thể bảo quản tối đa 2 tuần trong vòng 6h kể từ khi kết thúc quá trình thủy phân.
Dùng 50ml nước deion để rửa phần bã còn lại trên giấy lọc. Dùng nước nóng có thể giúp quá trình lọc diễn ra nhanh hơn.
Sấy phần rắn đến khối lượng không đổi, ít nhất 4h ở 105°C. (khối lượng sau sấy là m1=khối lượng giấy lọc + khối lượng lignin không tan trong kiềm + khối lượng tro không tan trong kiềm). Chuyển toàn bộ giấy lọc không tro và bã sau sấy vào chén nung đã biết trước khối lượng. Nung ở 600°C ± trong 24h ± 6h đến khối lượng không đổi (khối lượng sau nung là m2 = khối lượng chén nung + khối lượng tro không tan trong kiềm).
Lượng tro không tan trong kiềm: mAIR = m2 - m chén nung (g)
Lượng lignin không tan trong kiềm:
mail =m1 - mgiấy lọc - mAIR (g)
Hàm lượng lignin không tan trong kiềm của nguyên liệu đã trích ly:
%AIL=100×mAIL / mo
Với:
Mo (g) là khối lượng khô tuyệt đối của nguyên liệu đem đi phân tích M1 (g) là tổng khối lượng sau khi sấy ở 105°C
M2 (g) là tổng khối lượng sau khi nung ở 600°C
Phân tích hàm lượng lignin tan trong kiềm(ASL)
Sử dụng máy đo UV-VIS, set blank bằng nước deion hoặc NaOH
Đo mẫu dịch lọc thu được ở bước sóng thích hợp, chú ý pha loãng bằng chính dung dịch set blank sao cho giá trị độ hấp thụ nằm trong khoảng 0.7 đến 1.0
Hàm lượng lignin tan trong kiềm của nguyên liệu đã trích ly:
%ASL = (100×OD×V dịch lọc×F) / ( ε ×λ× m ) Trong đó :
OD: giá trị độ hấp phụ trung bình của ít nhất 2 lần đo (sai lệch nhỏ hơn 0.05) V dịch lọc : 86,73 ml
F : độ pha loãng mẫu khi tiến hành đo quang
ε : độ hấp thụ của nguyên liệu ở bước sóng λtương ứng. Với gỗ cao su, ε= 12, λ= 240nm
m: lượng mẫu đem đi phân tích tính theo khối lượng khô tuyệt đối (mg)
Hàm lượng lignin tổng trong nguyên liệu đã trích ly được tính theo công thức
%L = %AIL + %ASL [91]
2.5.6. Phương pháp xác định lượng đường trong mẫu thủy phân bằng sắc ký lỏng cao áp (HPLC- High Performance Liquid Chromatography)
Phân tích sắc ký được thực hiện trên hệ thống HPLC dòng Agilient 1200 (Agilent Technologies, Hoa Kỳ) được trang bị bộ khử khí chân không, một máy bơm nhị phân, bộ lấy mẫu tự động, bộ điều khiển nhiệt tĩnh.
Dịch thủy phân và mẫu kiểm chứng của cơ chất được lọc qua màng lọc 0,2µm, sau đó được đưa lên cột sắc ký Aminex 87H (300mm x 7,8mm, 9µm) với dung môi H2SO4 10mM, tốc độ dòng 0,5 mL/phút ở nhiệt độ 60oC. Mẫu đi qua cột được phát hiện bằng chỉ số khúc xạ
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Phân lập vi khuẩn từ ruột mối và tuyển chọn chủng có hoạt tính cellulase cao
Các mẫu mối được thu thập từ tổ mối trên cây gỗ và mía đã mục, trên thân cây ở các địa điểm khác nhau của các huyện Thanh Chương, Nghi Lộc thuộc địa bàn thành phố Vinh và trường Đại học Bách Khoa Hà nội (Bảng 2.1). So sánh đặc điểm hình thái của mối, đặc điểm của tổ mối với tài liệu định danh cho thấy các mẫu mối thu nhận đều có đặc điểm của loài mối gỗ khô Coptotermes.
Ở Việt nam, qua điều tra nhiều năm người ta thấy loại phổ biến nhất thường phá hoại các công trình 95-97% (Nguyễn Quốc Huy, 2017) là giống mối Coptotermes thuộc loài Rhinotermitidae [92]. Tổ mối trong gỗ thường thấy ở loài mối khô, tổ nằm gọn trong thanh gỗ không có liên hệ gì với đất, tổ có kết cấu đơn giản, quần thể không lớn thường có các lỗ thông từ hang này đến hang khác hoặc thông ra ngoài

Hình 3.1. Hình ảnh mẫu mối thu thập
Khả năng phân giải cellulose của chủng được đánh giá thông qua tỷ lệ đường kính vòng thủy phân với đường kính khuẩn lạc D/d [93][94][95].
Kết quả chi tiết đặc điểm khuẩn lạc và khả năng tạo vòng thủy phân của các chủng phân lập từ ruột mối được trình bày ở phụ lục 1 (Bảng PL1-5). Số lượng chủng phân lập từ các mẫu mối và khả năng tạo vòng thủy phân trên môi trường nhuôm congo 1% của các chủng phân lập đươc tổng hợp ở bảng 3.1.
Bảng 3.1 Thống kê kết quả phân lập vi khuẩn từ ruột mối
Số lượng chủng phân lập | Tỷ lệ D/d | |||
≤2 | 2-5 | ≥5 | ||
01 | 16 | 5 | 9 | 2 |
02 | 10 | 5 | 5 | 0 |
Có thể bạn quan tâm!
-
 Ứng Dụng Giải Trình Tự Genome Để Phát Hiện Tiềm Năng Vi Khuẩn Sinh Tổng Hợp Cellulase Trong Phân Giải Lignocellulose
Ứng Dụng Giải Trình Tự Genome Để Phát Hiện Tiềm Năng Vi Khuẩn Sinh Tổng Hợp Cellulase Trong Phân Giải Lignocellulose -
 Phương Pháp Phân Lập Và Tuyển Chọn Chủng Sinh Tổng Hợp Cellulase
Phương Pháp Phân Lập Và Tuyển Chọn Chủng Sinh Tổng Hợp Cellulase -
 Khảo Sát Khả Năng Thủy Phân Rơm Sử Dụng Cellulase Thu Nhận Từ Vi Khuẩn
Khảo Sát Khả Năng Thủy Phân Rơm Sử Dụng Cellulase Thu Nhận Từ Vi Khuẩn -
 Đặc Điểm Hình Thái, Sinh Lý Của 11 Chủng Vi Khuẩn Tuyển Chọn
Đặc Điểm Hình Thái, Sinh Lý Của 11 Chủng Vi Khuẩn Tuyển Chọn -
 Bề Mặt Đáp Ứng Của Quá Trình Sinh Tổng Hợp Cmcase Từ Bacillus G4 Cho Thấy Sự Tương Tác Giữa (A) Hàm Lượng Bột Đậu Tương Và Tinh Bột . (B) Hàm
Bề Mặt Đáp Ứng Của Quá Trình Sinh Tổng Hợp Cmcase Từ Bacillus G4 Cho Thấy Sự Tương Tác Giữa (A) Hàm Lượng Bột Đậu Tương Và Tinh Bột . (B) Hàm -
 Ảnh Hưởng Của Môi Trường Nuôi Cấy Tới Khả Năng Sinh Enzym
Ảnh Hưởng Của Môi Trường Nuôi Cấy Tới Khả Năng Sinh Enzym
Xem toàn bộ 138 trang tài liệu này.
18 | 11 | 7 | 0 | |
04 | 18 | 9 | 6 | 3 |
05 | 10 | 9 | 0 | 1 |
06 | 7 | 6 | 1 | 0 |
07 | 17 | 10 | 3 | 4 |
08 | 12 | 11 | 0 | 1 |
Tổng | 108 | 66 | 31 | 11 |
03
Kết quả bảng 3.1 cho thấy số lượng vi khuẩn phân lập được từ các mẫu tương đối lớn 108 chủng vi khuẩn. Tuy nhiên tỷ lệ các chủng có tỷ lệ đường kính vòng thủy phân/đường kính khuẩn lạc (D/d) cao lại không nhiều. Số lượng chủng có D/d ≥ 5 là 11/108 chiếm 10,2%, số lượng chủng có D/d trong khoảng 2-5 là 31 chủng chiếm 28,7%. Còn lại phần lớn các chủng có tỷ lệ D/d ≤ 2 chiếm tỷ lệ cao nhất 61,1%.
Các chủng vi khuẩn phân lập từ các môi trường làm giàu có thành phần khác nhau cũng không giống nhau. Các mẫu mối 1, 2, 3, 4 được làm giàu cùng lúc trên 5 loại môi trường M1, M2, M3, M4 và M5 được tổng kết trên bảng 3.2.
Bảng 3.2 Số lượng các chủng vi khuẩn phân lập được trên các môi trường làm giàu
Môi trường làm giàu | Số chủng | Tỷ lệ (%) | Cơ chất CMC | Cơ chất giấy lọc | |
1 | M1 | 16 | 25,81% | 8 | 8 |
2 | M2 | 13 | 20,97% | 7 | 6 |
3 | M3 | 19 | 30,65% | 8 | 11 |
4 | M4 | 8 | 12,90% | 2 | 6 |
5 | M5 | 6 | 9,68% | 3 | 3 |
Tổng | 62 | 28 | 34 | ||
Kết quả bảng 3.2, cho thấy các môi trường làm giàu M1 và M3 là môi trường khoáng nghèo dinh dưỡng cho số lượng chủng loại lớn hơn so với các môi trường còn lại. Môi trường M4 và M5 là môi trường M3 bổ sung thêm glucose và M2 là môi trường có pepton nhưng lại cho số lượng chủng loại vi khuẩn phân lập được thấp hơn, điều này có thể được giải thích là do môi trường giàu dinh dưỡng kích thích các loại vi khuẩn sinh trưởng nhanh phát triển làm lấn át các chủng vi khuẩn sinh trưởng chậm hơn dẫn đến mặc dù số lượng khuẩn lạc lớn hơn nhưng số chủng loại lại ít hơn.
Các chủng có khả năng sinh cellulase cao là những chủng có tỷ lệ D/d > 5 [71]. Trong nghiên cứu này để đảm bảo lựa chọn được các chủng có hoạt độ cellulase cao vừa đảm bảo tính đa dạng, các chủng có tỷ lệ D/d từ 4,8 trở lên, có hình thái khuẩn lạc khác nhau từ các mẫu mối, trên môi trường làm giàu và cơ chất làm giàu khác nhau được lựa chọn và tổng hợp ở bảng 3.3. Có thể thấy chủng có tỷ lệ D/d cao nhất đạt giá trị 10 là chủng G4.
Kết quả bảng 3.3 khi so sánh với nghiên cứu của Pratima Gupta và cộng sự (2011) cho thấy có sự tương đương, trong nghiên cứu của Gupta đã phân lập được 4 chủng vi khuẩn có khả năng phân giải cellulose từ ruột mối trên môi trường khoáng, nghèo dinh dưỡng trong thời gian 7 ngày, các chủng phân lập có tỷ lệ đường kính vòng thủy phân/ đường kính khuẩn lạc D/d dao động từ 4,32 đến 5,49 và tỷ lệ D/d lớn nhất là 9 [94]. Trong một nghiên cứu khác của tác giả NYI Merkar Saptarini khi tiến hành phân lập trên mối và nguồn cacbon chủ yếu là lõi ngô. Kết quả phân lập được 3 chủng có tỷ lệ D/d trong khoảng 5,02 – 5,24 [71]. So với các nghiên cứu đã công bố thì kết quả của chúng tôi là khả quan khi có 2 chủng với tỷ lệ D/d trong khoảng từ 8-10.
Bảng 3.3 Các chủng có tỷ lệ (D/d) cao được chọn lựa
Cơ chất sử dụng cho quá trình làm giàu | Mẫu mối | Môi trường làm giàu | Tên chủng | Tỷ số D/d | |
1 | CMC | 01 | M5 | G4 | 10 |
2 | 05 | M2 | T2-11 | 8 | |
3 | 06 | M1 | TM1-7-1 | 4,8 | |
4 | 07 | M1 | D1-8 | 5 | |
5 | 07 | M1 | D1-12 | 5,5 | |
6 | 08 | M2 | CM2-4 | 6,6 | |
7 | Giấy lọc | 04 | M1 | MP1 | 7,5 |
8 | 04 | M3 | MP3 | 6,5 | |
9 | Cơ chất tự nhiên cám gạo, đậu tương | 07 | M6 | CG2 | 4,8 |
10 | 07 | M6 | CG4 | 5,0 | |
11 | 07 | M6 | CG4-1-2- | 6,3 |
Các chủng vi khuẩn có tỷ lệ đường kính vòng thủy phân cao tiếp tục được nuôi trên môi trường lỏng LB với cơ chất CMC và bã mía 0,5%, ở nhiệt độ 370C, lắc 150 vòng/phút. Kết quả xác định hoạt độ enzym tương ứng (Bảng 3.4 và Hình 3.2).
Bảng 3.4 Hoạt độ cellulase và xylanase của các chủng vi khuẩn lựa chọn
Ký hiệu chủng | Hoạt độ CMCase (U/mL) | Hoạt độ FPU (U/mL) | Hoạt độ Xylanase (U/mL) | Hoạt độ β- glucosidase (U/mL) | Hoạt độ Acevilase (U/mL) | |
1 | TM1-7.1 | 0,144±0,011 | 0,016±0,008 | 0,041±0,003 | 0,165±0,012 | ND |
2 | MP3 | 0,440±0,024 | 0,020±0,003 | 0,12±0,012 | 0,098±0,005 | 0,0051±0,0006 |
3 | MP1 | 0,652±0,033 | 0,057±0,005 | 0,23±0,016 | 0,153±0,005 | 0,0038±0,0007 |
4 | CG2 | 0,197±0,012 | 0,020±0,004 | 0.041±0,011 | 0,117±0,009 | 0,0044±0,0004 |
5 | G4 | 0,754±0,046 | 0,026±0,006 | 0,170±0,012 | 0,124±0,005 | 0,0046±0,0005 |
6 | CG4 | 0,144±0,010 | 0,024±0,004 | 0,034±0,001 | 0,117±0,004 | 0,0034±0,0001 |
7 | T2-11 | 0,526±0,021 | 0,041±0,007 | 0,231±0,001 | 0,194±0,008 | 0,0046±0.0001 |
8 | CM2-4 | 0,177±0,013 | 0,028±0,004 | 0,130±0,001 | 0,069±0,005 | ND |
9 | D1-8 | 0,143±0,012 | 0,017±0,005 | 0,037±0,002 | 0,073±0,005 | ND |
10 | D1-12 | 0,133±0,011 | 0,023±0,006 | 0,041±0,009 | 0,205±0,005 | ND |
11 | CG4-1-2 | 0,290±0,018 | 0,024±0,003 | 0,042±0,010 | 0,098±0,007 | ND |
ND- Không xác định
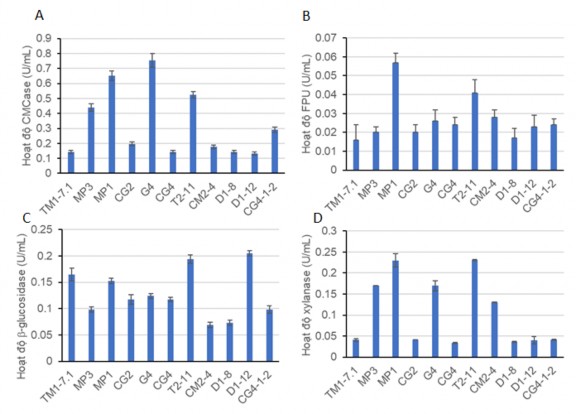
Hình 3.2 Hoạt độ enzym các chủng vi khuẩn từ ruột mối
Các chủng lựa chọn có hoạt độ CMCase dao động trong khoảng từ 0,124 U/ml đến 0,752 U/mL. So sánh với hoạt độ của các vi khuẩn phân lập từ ruột mối theo công bố của Sharma và cộng sự cho thấy các vi khuẩn phân lập được từ ruột mối ở Nepal thuộc các loài Bacillus, Cellulomonas và Enterobacter cũng có hoạt độ CMCase từ 0,07 U/ml – 0,2 U/ml [96]. Các vi khuẩn phân lập được từ mối bậc cao theo Sreeremya và cộng sự cũng đã xác định được là các chủng Pseudomonas fluorescens, Bacillus subtilis, E.coli và Serratia marscens có hoạt độ từ CMCase 0,05 U/ml -0,9 U/ml [34].
Các chủng phân lập được ngoài hoạt tính CMCase còn có hoạt tính các hoạt tính khác như FPU, β-glucosidase, acevilase và xylanase. Trong các thí nghiệm này do chưa tối ưu điều kiện sinh tổng hợp enzym nên hoạt độ các enzym còn tương đối thấp. Chủng có hoạt độ CMCase cao nhất là G4 sau đó là MP1 và T2-11 tương ứng với 3 chủng cho tỷ lệ D/d cao nhất (Bảng 3.3). Đặc biệt chủng MP1 có hoạt độ FPU và xylanase cao nhất trong các chủng, hứa hẹn tiềm năng khai thác để thủy phân lignocellulase.
3.2. Đặc điểm hình thái và đặc tính sinh lý, sinh hóa của các chủng lựa chọn
3.2.1. Đặc điểm hình thái và đặc tính sinh lý, sinh hóa
Đặc điểm hình thái và đặc điểm khuẩn lạc của các chủng vi khuẩn lựa chọn được tổng kết ở bảng 3.5.