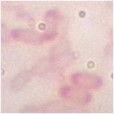
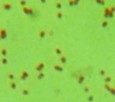
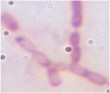
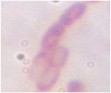
Bảng 3.5. Đặc điểm hình thái, sinh lý của 11 chủng vi khuẩn tuyển chọn
Ký hiệu chủng | Gra m | Bào tử | Cata lase | Đặc điểm khuẩn lạc | Hình thái tế bào | Ảnh tế bào (x1000) | |
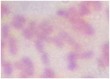
1 | CM2-4 | + | + | + | Mọc lan dạng không điển hình, mép lượn sóng, bề mặt phẳng màu trắng trong | Trực khuẩn to, riêng lẻ |
|
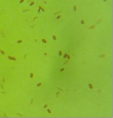
2 | CG2 | - | - | + | Mọc yếu, mép phẳng, trắng trong | Trực khuẩn nhỏ, ngắn, đầu tròn, đứng riêng lẻ |
|
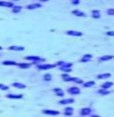
3 | CG4 | - | - | + | Khuẩn lạc tròn, trắng, mép phẳng, bề mặt phẳng, lồi ở giữa dạng nón | Trực khuẩn nhỏ, ngắn, đầu tròn, đứng riêng lẻ |
|
4 | CG4-1- 2 | + | - | + | Mọc yếu, trắng ngà, mép tua rua, bề mặt phẳng | Trực khuẩn to, dài, |
|
5 | D1-8 | + | + | - | Khuẩn lạc to màu trắng đục, lồi, bề mặt nhẵn | Trực khuẩn, tạo chuỗi |
|
6 | D1-12 | + | + | - | Khuẩn lạc to mọc lan, màu trắng đục hơi vàng, bề mặt ráp, mép tua rua | Trực khuẩn, tạo chuỗi |
|
Có thể bạn quan tâm!
-
 Phương Pháp Phân Lập Và Tuyển Chọn Chủng Sinh Tổng Hợp Cellulase
Phương Pháp Phân Lập Và Tuyển Chọn Chủng Sinh Tổng Hợp Cellulase -
 Khảo Sát Khả Năng Thủy Phân Rơm Sử Dụng Cellulase Thu Nhận Từ Vi Khuẩn
Khảo Sát Khả Năng Thủy Phân Rơm Sử Dụng Cellulase Thu Nhận Từ Vi Khuẩn -
 Phương Pháp Xác Định Lượng Đường Trong Mẫu Thủy Phân Bằng Sắc Ký Lỏng Cao Áp (Hplc- High Performance Liquid Chromatography)
Phương Pháp Xác Định Lượng Đường Trong Mẫu Thủy Phân Bằng Sắc Ký Lỏng Cao Áp (Hplc- High Performance Liquid Chromatography) -
 Bề Mặt Đáp Ứng Của Quá Trình Sinh Tổng Hợp Cmcase Từ Bacillus G4 Cho Thấy Sự Tương Tác Giữa (A) Hàm Lượng Bột Đậu Tương Và Tinh Bột . (B) Hàm
Bề Mặt Đáp Ứng Của Quá Trình Sinh Tổng Hợp Cmcase Từ Bacillus G4 Cho Thấy Sự Tương Tác Giữa (A) Hàm Lượng Bột Đậu Tương Và Tinh Bột . (B) Hàm -
 Ảnh Hưởng Của Môi Trường Nuôi Cấy Tới Khả Năng Sinh Enzym
Ảnh Hưởng Của Môi Trường Nuôi Cấy Tới Khả Năng Sinh Enzym -
 Xác Định Đặc Tính Di Truyền Và Các Gen Mã Hóa Enzym Thủy Phân Cellulose Của Chủng C. Cellulans Mp1
Xác Định Đặc Tính Di Truyền Và Các Gen Mã Hóa Enzym Thủy Phân Cellulose Của Chủng C. Cellulans Mp1
Xem toàn bộ 138 trang tài liệu này.
T2-11 | + | - | - | Khuẩn lạc dạng không điển hình, bề mặt trắng đục ở giữa, mép nhăn và trong | Trực khuẩn nhỏ |
| |
8 | TM1- 7-1 | + | - | + | Mọc yếu, khuẩn lạc tròn, trắng đục bóng, lỗi lên ở giữa | Trực khuẩn ngắn, tròn |
|
9 | G4 | + | + | _ | Khuẩn lạc màu trắng đục, lồi,bề mặt nhẵn, to | Trực khuẩn |
|
10 | MP1 | + | - | + | Khuẩn lạc tròn, trơn, lồi và có màu trắng ngả vàng nhạt. | Quan sát dưới kính hiển vi tế bào hình que ngắn hoặc cầu |
|
11 | MP3 | + | - | + | Khuẩn lạc tròn, trơn, lồi và có màu trắng ngả vàng nhạt. | Quan sát dưới kính hiển vi tế bào hình que ngắn |
|
7
Kết quả nhuộm Gram, khả năng tạo bào tử và quan sát hình thái tế bào, hình thái khuẩn lạc cho thấy có 7/11 ( 63,6%) chủng lựa chọn là CM2-4, CG4-1-2, G4, D1-8, D1-12, T2-11, G4 có nhiều đặc điểm giống chi Bacillus như trực khuẩn gram dương, tạo bào tử và sinh catalase. Kết quả này tương đồng với các kết quả đã công bố là Bacillus chiếm tỉ lệ cao trong hệ vi sinh vật ruột mối [25][6][9]. Các chủng Bacillus thường có khả năng sinh tổng hợp cellulase cao và do vậy là điều dễ hiểu khi chiếm tỷ lệ lớn trong các chủng lựa chọn.
Sử dụng 2 loại kit là Kit 20E và Kit 50 CHB để xác định các đặc tính sinh hóa của các chủng lựa chọn. Kết quả thể hiện ở bảng phụ lục 1 bảng 6 và bảng 7
Sau khi đã có bảng đặc tính của các chủng vi khuẩn chúng tôi tiếp tục phân tích trình tự 16S rDNA để định tên các vi khuẩn đã lựa chọn.
3.2.2. Định tên các vi khuẩn ruột mối
Kết hợp phương pháp định tên bằng 16S RNA và các đăc điểm sinh lý sinh hóa vi khuẩn, dựa trên tham khảo tài liệu định tên theo Bergey [97]. Chúng tôi đã có kết quả định tên các chủng vi khuẩn như trên bảng 3.8
Bảng 3.6 Kết quả định tên các chủng vi khuẩn lựa chọn từ ruột mối
Ký hiệu chủng | Định tên | ID (API)/Mừc độ tương đồng trình tự (%) | Phương pháp định tên | |
1 | CM2-4 | Bacillus lentus | 99,9 | API 50CHB |
2 | CG2 | Trabulsiella guamensis | 99,63 | 16S rDNA |
3 | CG4 | Klebsiella variicola | 100 | 16S rDNA |
4 | CG4-1-2 | Bacillus firmus | 97,2 | API 50CHB |
5 | T2-11 | Bacillus sonorensis | 100% | 16S rDNA |
Không tìm được độ tương đồng | API 50CHB | |||
6 | TM1-7-1 | Pseudomonas aeruginosa | 99,9 | 16S rDNA |
7 | G4 | Bacillus subtilis/amyloliquefaciens | 99,7 | API 50CHB |
Bacillus subtilis | 97,14 | 16S rDNA | ||
8 | MP1 | Cellulosimicrobium sp. | 99,93 | 16S rDNA |
9 | MP3 | Cellulosimicrobium funkei | 100 | 16S rDNA |
Có thể thấy các chủng vi khuẩn phân lập được tương đối đa dạng, hầu hết các loài phân lập được trong nghiên cứu cũng đã từng được công bố trước đây, như công bố của Sreeremya và cộng sự cũng đã phân lập được các vi khuẩn Pseudomonas fluorescens, Bacillus subtilis, E.colivà Serratia marscens từ ruột mối bậc cao ở Ấn Độ [34]. Công bố khác của Wenzel và cộng sự cho biết đã áp dụng điều kiện nuôi cấy hiếu khí và phân lập được 119 chủng vi khuẩn cellulolytic từ ruột mối Zootermopsis angusticollis, các chủng này thuộc các nhóm Cellulomonas, Microbacterium, Bacillus, Rhizobium, Pseudomonas [9]. Kết quả phân lập vi khuẩn từ ruột mối ở Nepan cũng cho thấy các chủng phân lập được xác định là Bacillus, Cellulomonas và Enterobacter [96].
Tại Việt Nam theo công bố của Nguyễn Thị Thảo và cộng sự cho thấy số loài vi khuẩn có khả năng sinh cellulase chủ yếu trong ruột mối thuộc ngành Firmicutes (15/24 loài), phần lớn thuộc lớp Clostridia, bộ Clostridiales. Loài chiếm ưu thế nhất có khả năng sinh cellulase là Pseudomonas fluorescens thuộc bộ Pseudomonadaceae. Trong 18 loài sinh hemicellulase, loài chiếm ưu thế nhất là Clostridium thermocellum thuộc ngành Firmicutes, sau đó 3 loài thuộc ngành Bacterroidetes. Các vi khuẩn có khả năng sinh cellulase, hemicellulase được ước đoán là C.thermocellum, Ruminococus flavefacien và Bacilus subtilis [39].
Bacillus subtilis là chủng thuộc loài đã được nghiên cứu nhiều trên thế giới và ở Việt Nam, được ứng dụng nhiều trong thực tế. B. subtilis đã từng được phân lập từ ruột mối và các nguồn khác, như phân lập từ ruột tằm công bố của A.Anand và cộng sự (2021) [98], phân lập từ ruột mối theo công bố như của tác giả Tarayre C và cộng sự (2014) khi nghiên cứu trên loài mối Reticulitermes santonesis [99]. Kết quả tương tự, các tác giả khác cũng đã phân lập được vi khuẩn thuộc giống Bacillus khi tiến hành phân lập trên các loại mối khác nhau như Zootermopis angusticollis, Reticultermes Hesperus, Coptotermes curvignathus, Reticulitermes speratus [75]. Với những chủng thuộc giống Bacillus phân lập được hầu như đều sinh Endoglucanase, số ít có thêm hoạt lực β-glucosidase và hoạt lực tổng FP- cellulase.
Các nghiên cứu phân lập về Klebsiella còn rất hạn chế. Năm 2010, khi Cho M-J cùng cộng sự (2010) tiến hành nghiên cứu trên đối tượng là loài mối Reticulitermes speratus đã phân lập được chủng vi khuẩn sinh tổng hợp cellulase thuộc loài Klebsiella sp, ông cũng chứng minh được chúng có khả năng sinh tổng hợp ba loại enzym: cellobiohydrolase, β-glucosidase và Endoglucanase [3]. Trong một nghiên cứu khác của Mattéotti C và cộng sự (2011) chủng vi khuẩn phân lập được thuộc loài Klebsiella sp có hoạt tính β-glucosidase [100] .
Trabulsiella guamensis, là một thành viên của chi Gammaproteobacteria trong họ Enterobacteriaceae. Năm 2007, nghiên cứu của Chou và cộng sự, đã phân lập được chủng Trabulsiella odontotermitis [10]. Tuy nhiên, chưa có nghiên cứu nào công bố về khả năng phân giải cellulose của chủng này.
Trong nghiên cứu của tác giả Mark Silby và cộng sự (2011) đã phân lập được chủng vi khuẩn thuộc loài Pseudomonas sp từ ruột mối Micocerotermes diversus [101]. Pseudomonas cũng là chi có khả năng sinh endoglucanase và FP- cellulase trong một nghiên cứu gần đây của tác giả Bholay A.D, và cộng sự (2014) khi nghiên cứu phân lập vi khuẩn từ ruột mối [15]. Khi tiến hành phân lập vi khuẩn từ ruột mối Pourramezan đã tuyển chọn được chủng Pseudomonas aeruginosa cho
hoạt tính cellulase cao nhất ở pH 7.0 và 30ºC [43]. Đây cũng là loài có mặt chiếm tỷ lệ nhiều nhất trong mối Coptotermes gestroi ở Việt Nam của Đỗ Thị Huyền và cộng sự [17].
Cellulosimicrobium đã từng được phân lập từ ruột mối được công bố bởi tác giả Agapia và cộng sự (2002) và trong các công bố khác như của Yon 2007, Liu 2015 và Huang 2012 [102][103][12]. Tuy nhiên các nghiên cứu về hệ enzym thủy phân cellulose cũng như các nghiên cứu về thu nhận, ứng dụng cellulase từ loài vi khuẩn này còn rất hạn chế.
Từ kết quả các nghiên cứu trên kết hợp với các tài liệu đã được công bố chúng tôi nhận thấy Bacillus và Cellulosimicrobium là nhóm có mặt với xác suất cao trong vi khuẩn ruột mối, 2 nhóm này cũng đã được chứng minh có hoạt tính cellulase cao và ngoài hoạt tính CMCase còn có thêm các các hoạt tính khác có khả năng phân giải cellulose hiệu quả, tiếp đến 2 nhóm này thuộc nhóm vi khuẩn Gram (+) nên ít mang các yếu tố gây bệnh hơn so với các chủng Gram (-). Chính vì những lý do đó chúng tôi đã lựa chọn 2 chủng là Bacillus subtilis G4 và Cellulosimicrobium sp MP1 để nghiên cứu thu nhận cellulase và đánh giá tiềm năng phân giải cellulase của chủng.
3.3. Nghiên cứu thu nhận cellulase từ vi khuẩn Bacillus subtilis G4
3.3.1. Nghiên cứu lựa chọn môi trường và điều kiện thích hợp cho quá trình sinh tổng hợp cellulase
3.3.1.1. Lựa chọn môi trường sinh tổng hợp cellulase
2
1.5
1
0.5
0
LB
M1
M2
M6
Môi trường sinh tổng hợp
Hoạt độ CMCase(U/ml)
Bacillus subtilis G4 được nuôi cấy trên các môi trường LB, M1 M2 và M6 trong thời gian 48 giờ ở 37C, tốc độ lắc 100 vòng/phút, sau đó xác đinh hoạt tính CMCase trên các môi trường tương ứng, kết quả thu được như trên Hình 3.3
Hình 3.3 Hoạt độ CMCase của chủng B. subtlis G4 trên các môi trường nuôi cấy
Kết quả hình 3.3 cho thấy, với các môi trường nuôi cấy khác nhau thì khả năng sinh CMCase của G4 cũng khác nhau, trong đó M6 là môi trường thích hợp
nhất cho quá trình sinh CMCase. M6 là môi trường có các thành phần cám gạo, bột đậu tương và casein, đây là môi trường mà các thành phần có nguồn gốc tự nhiên, có thể thấy chủng G4 phát triển tốt hơn so với các môi trường mà các thành phần là hóa chất tinh khiết. Môi trường M6 cũng là môi trường được Li và cộng sự đã sử dụng nuôi cấy để thu nhận endo-cellulase từ vi khuẩn Bacillus subtilis YJ1[75]. Chúng tôi lựa chọn M6 làm môi trường sinh tổng hợp cellulase cho các nghiên cứu tiếp theo. Trên môi trường M6 chủng vi khuẩn phân lập từ ruột mối đã được công bố bởi Sreena và cộng sự. có hoạt tính từ 0,4 U/mg – 1,2 U/mg trên môi
trường chưa tối ưu hóa [5].
3.3.1.2 Ảnh hưởng của các thông số lên men đến hoạt độ CMCase
Để thu nhận được enzym có hoạt độ cao trên môi trường M6, các yếu tố như nhiệt độ, tốc độ lắc, thời gian lên men và pH môi trường đã được nghiên cứu. Kết quả thu được như hình 3.4
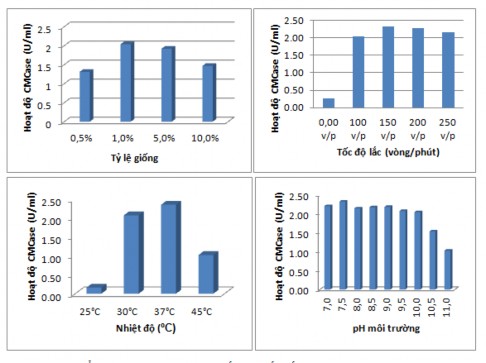
Hình 3.4. Ảnh hưởng của các thông số nuôi cấy đến hoạt độ CMCase của B. subtilis G4. Tỷ lệ giống (A), tốc độ lắc (B), Nhiệt độ (C) và pH môi trường (D).
Từ các kết quả trên cho thấy các yếu tố tỷ lệ cấp giống, tốc độ lắc, nhiệt độ môi trường và pH môi trường có ảnh hưởng rất lớn tới hoạt độ enzym, bằng phương pháp nghiên cứu đơn yếu tố kết quả cho thấy hoạt độ enzym thu được đạt cao nhất khi tỷ lệ cấp giống 1%, tốc độ lắc 150 vòng/phút, nhiệt độ môi trường nuôi cấy 37ºC, pH môi trương 7.
pH = 7,0 cũng là pH phù hợp nhất cho quá trình sinh enzym của Bacillus sp S3B8 phân lập từ ruột mối [104]. Tuy nhiên, công bố của Sreeremya và cộng sự cũng cho biết, các chủng Bacillus phân lập từ ruột mối hoạt độ cellulase lớn nhất ở 40ºC, pH từ 9 -10 [34]
Quá trình sinh tổng hợp enzym tồn tại khoảng thời gian có hoạt độ enzym cao nhất, qua thời điểm này hoạt tính enzym sẽ giảm do các yếu tố sinh lý tác động. Vì vậy thời gian thu nhận enzym là yếu tố quan trọng trong quá trình sinh tổng hợp enzym.
3.00
2.50
2.00
1.50
1.00
0.50
0.00
24h 48h 72h 96h
Thời gian nuôi cấy (giờ)
Hoạt độ CMCase (U/ml)
Chủng vi khuẩn G4 được nuôi trong các điều kiện lựa chọn ở trên, thay đổi thời gian khác nhau để xác định thời điểm có hoạt độ CMCase cao nhất. Kết quả thu được như Hình 3.5
Hình 3.5 Ảnh hưởng của thời gian nuôi cấy đến sinh tổng hợp CMCase từ vi khuẩn G4
Kết quả xác định hoạt độ ở các thời điểm khác nhau cho thấy với thời gian nuôi cấy là 72 giờ là thời gian thích hợp nhất cho quá trình sinh enzym từ vi khuẩn G4. Với các vi khuẩn thuộc loài Bacillus từ ruột mối và một số các nguồn phân lập khác đã được nghiên cứu đều có thời gian thích hợp nhất cho quá trình sinh enzym là từ 60 giờ đến 72 giờ [34][105][106].
Hoạt độ enzym thu được từ vi khuẩn G4 cũng tương đương với hoạt độ của các vi khuẩn phân lập từ ruột mối trên môi trường nuôi cấy sau khi được nghiên cứu các thông số ảnh hưởng theo công bố của Screena và cộng sự, hoạt độ các vi khuẩn dao động từ 2,52-6,01 U/mg [25]. Tuy nhiên, hoạt độ cellulase từ vi khuẩn G4 cao hơn rất nhiều so với các vi khuẩn Bacillus subtillis phân lập từ các nguồn khác như các công bố của Reka và cộng sự đã phân lập được các chủng Bacillus subtilis từ đất ngập mặn cao nhất đạt 0,62 UI/ml [107], công bố khác của Ariffin và cộng sự cũng đã phân lập chủng Bacillus pumilus EB3 từ vỏ cây cọ với hoạt tính CMCase cao nhất đạt được 0,079U/ml [108]. Chủng Bacillus subtilis phân lập từ rừng nguyên sinh ở Ấn Độ cũng có hoạt tính CMCase cao nhất 0,48 U/ml (công bố của Ramalingam và cộng sự, 2014) [109].
3.3.1.3. Ảnh hưởng các nguồn dinh dưỡng đến quá trình sinh tổng hợp cellulase
Ngoài các yếu tố vật lý thì việc thay đổi các nguồn dinh dưỡng trong môi trường nuôi cấy cũng làm ảnh hưởng lớn tới hoạt độ của enzym. Trong nghiên cứu này ảnh hưởng của các nguồn dinh dưỡng nito, cacbon và nguồn bột đậu tương, một thành phần cơ bản trong môi trường M6 đến hoạt độ CMCase sẽ được nghiên cứu. Kết quả thu được trình bày trên Hình 3.6
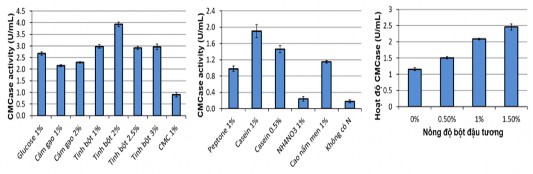
Hình 3.6 . Ảnh hưởng của nguồn cacbon (A), nito (B) và bột đậu tương lên hoạt độ CMCase của B. subtilis G4
Kết quả Hình 3.6 (A) cho thấy tinh bột là nguồn cacbon tốt nhất cho quá trình sinh tổng hợp cellulase của chủng B. subtilis G4. Hoạt tính CMCase tăng 1,4 lần so với cám gạo với cùng nồng độ 1%. Nếu tiếp tục tăng nồng độ tinh bột từ 1% lên 2% hoạt tính CMCase tiếp tục tăng lên gấp 1,3 lần tuy nhiên nếu tiếp tục tăng nồng độ tinh bột lên 2,5% hoặc 3% hoạt độ CMCase bị giảm. Đáng chú ý là CMC cho hoạt tính CMCase thấp hơn so với các nguồn cacbon khác. Trong nghiên cứu của Y.Lugani, R.Singla và cộng sự hay của Behera, Mishra (2016) thì CMC lại cho hoạt tính CMCase cao hơn so với các nguồn cacbon khác đối với B. licheniformis và Bacillus sp Y3 và B. licheniformis CDB12 [110][107].
Kết quả này cho thấy nguồn cacbon là tinh bột có ảnh hưởng rất lớn tới quá trình sinh CMCase của B. subtilis G4. Tác dụng tích cực của tinh bột lên quá trình sinh tổng hợp cellulase của B. subtilis G4 có thể giải thích là do các gen mã hóa các enzym thủy phân tinh bột và cellulose đều chung một gen điều khiển trong hệ gen vi khuẩn G4.
Kết quả nghiên cứu Hình 3.6 (B) cho thấy Casein là nguồn nitơ tốt nhất và có tác động lớn quá trình sinh cellulase đối với chủng G4. Kết quả này giống với công bố của Sing và cộng sự 2014, casein lại nguồn nitơ tốt hơn cao nấm men và các nguồn nitơ khác đối với quá trình sinh cellulase của Bacillus VITRKHB [111]. Tuy nhiên nghiên cứu của Abou-Taleb và cộng sự 2009 lại cho thấy cao nấm men