CHƯƠNG 2: VẬT LIỆU VÀ PHƯƠNG PHÁP
2.1. Vật liệu
2.1.1. Mẫu mối
Mối thu thập tại các thân cây gỗ, mía mục tại huyện Thanh Chương, Nghi Lộc, núi Quyết thành phố Vinh, các tổ mối tại khuôn viên trong trường Đại học Bách khoa Hà nội trong khoảng thời gian từ tháng từ 2014 -2016.
Bảng 2.1. Thông tin các mẫu mối
Tổ mối trên cây | Địa điểm, Thời gian lấy mẫu | Cơ chất hoạt hóa | Ký hiệu chủng phân lập | |
01 | Gỗ mục | Núi quyết, Thành phố Vinh Nghệ An. Tháng 9/2014 | CMC | GC |
Giấy lọc | GP | |||
02 | Gỗ mục | Xã Thanh Mỹ, Huyện Thanh Chương, Nghệ An. Tháng 9/2014 | CMC | TC |
Giấy lọc | TP | |||
03 | Tổ mối trên cây Xoài | Trường Đại học Vinh, Tháng 6/2015 | CMC | HC |
Giấy lọc | HP | |||
04 | Cây mía mục | Xã Thanh Mỹ, Huyện Thanh Chương, Nghệ An. Tháng 9/2016 | CMC | MC |
Giấy lọc | MP | |||
05 | Tổ mối trên cây bằng lăng | Trường Đại học Bách Khoa Hà Nội. Tháng 10/2014 | CMC | T |
06 | Tổ mối trên cây phượng | Trường Đại học Bách Khoa Hà Nội. Tháng 6/2015 | CMC | TM |
07 | Trường Đại học Bách Khoa Hà Nội. Tháng 8/2015 | CMC | D | |
Cám gạo | CG | |||
08 | Tổ mối trên cây sấu | Trường Đại học Bách Khoa Hà Nội. Tháng 6/2015 | CMC | CM |
Giấy lọc | G |
Có thể bạn quan tâm!
-
![Đặc Tính Của Cellulose Và Xylanase Từ C.cellulans [18]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Đặc Tính Của Cellulose Và Xylanase Từ C.cellulans [18]
Đặc Tính Của Cellulose Và Xylanase Từ C.cellulans [18] -
![Tính Bền Nhiệt Của Cellulase Và Xylanase Từ C.cellulans [18].](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Tính Bền Nhiệt Của Cellulase Và Xylanase Từ C.cellulans [18].
Tính Bền Nhiệt Của Cellulase Và Xylanase Từ C.cellulans [18]. -
 Ứng Dụng Giải Trình Tự Genome Để Phát Hiện Tiềm Năng Vi Khuẩn Sinh Tổng Hợp Cellulase Trong Phân Giải Lignocellulose
Ứng Dụng Giải Trình Tự Genome Để Phát Hiện Tiềm Năng Vi Khuẩn Sinh Tổng Hợp Cellulase Trong Phân Giải Lignocellulose -
 Khảo Sát Khả Năng Thủy Phân Rơm Sử Dụng Cellulase Thu Nhận Từ Vi Khuẩn
Khảo Sát Khả Năng Thủy Phân Rơm Sử Dụng Cellulase Thu Nhận Từ Vi Khuẩn -
 Phương Pháp Xác Định Lượng Đường Trong Mẫu Thủy Phân Bằng Sắc Ký Lỏng Cao Áp (Hplc- High Performance Liquid Chromatography)
Phương Pháp Xác Định Lượng Đường Trong Mẫu Thủy Phân Bằng Sắc Ký Lỏng Cao Áp (Hplc- High Performance Liquid Chromatography) -
 Đặc Điểm Hình Thái, Sinh Lý Của 11 Chủng Vi Khuẩn Tuyển Chọn
Đặc Điểm Hình Thái, Sinh Lý Của 11 Chủng Vi Khuẩn Tuyển Chọn
Xem toàn bộ 138 trang tài liệu này.
2.1.2. Các chủng vi khuẩn
Các chủng phân lập được lưu giữ trong glycerol 15% ở -20°C. Trong thời gian làm thí nghiệm, chủng được giữ ở 4ºC, định kỳ cấy chuyền tại phòng thực
hành vi sinh thuộc trung tâm thực hành thí nghiệm Đại học Vinh, và phòng thí nghiệm Bộ môn Công nghệ sinh học, Đại học Bách Khoa Hà nội.
2.2. Thiết bị và hóa chất
2.2.1 Thiết bị
Nồi hấp thanh trùng (Hirayama, Nhật Bản), Kính hiển vi chụp ảnh (Optia - Italia); Máy đo mật độ quang UV-VIS (BIOVUAVEII – Mỹ), Máy đo pH (PL-600- MRC - Israel); Tủ cấy vô trùng (ESSCONG4A4-F8 - Singapore); Tủ nuôi lắc (SV 22 –Đức); Tủ lưu mẫu; Cân phân tích -PA 214-Ohaus - Mỹ - 2017, Vortex 2017 (Italia); Máy ly tâm lạnh (Hetich – Đức)- Thiết bị phân tích HPLC (Agilent, Mỹ)
Các thiết bị và các phần mềm trong nghiên cứu sinh học phân tử. Phiến 96 giếng (SPL Life Sciences, Hàn Quốc); Buồng đếm hemocytometer; Máy đọc ELISA (ELISA Bio-Rad machine, Mỹ); Máy PCR (Applied Biosystem 9700, Mỹ); máy ổn nhiệt (Labnet, Mỹ); bộ điện di agarose; máy soi gel (Bio-radMỹ); kính hiển vi quét (JSM-5410; JEOL, Tokyo); Máy giải trình tự ABI PRISM®3100-Avant Genetic Analyzer (Applied Biosystem, USA); máy quang phổ NanoDrop Spectrophotometer (Thermo Fisher Scientific Inc., Waltham MA, USA); máy đọc trình tự IonTorrent PGM (Life Technologies, Carlsbad, Mỹ) (Viện công nghệ sinh học); Máy tính chủ tính toán hiệu năng cao với bộ vi xử lý gồm 24 CPU Intel(R) Xeon (R) CPU X5650@2.67GHz, dung lượng RAM là 188 GB, dung lượng lưu trữ là 8TB và được cấu hình trên hệ điều hànhUbuntu phiên bản 15.04 Vivid với các phần mềm tin sinh học (Mọi phân tích thí nghiệm đều được thực hiện trên máy chủ hiệu suất cao của phòng Tin sinh học, Viện Công nghệ sinh học – Viện Hàn Lâm Khoa học và Công nghệ Việt Nam)
2.2.2. Hóa chất
Các hóa chất cao nấm men (Merk), CMC (Sigma), peptone (Merk), agar (Việt nam), cellulose thô (giấy lọc Whatman No1, Sigma), DNS (Trung Quốc), Congo đỏ (Trung Quốc).
Các loại muối khoáng có chất lượng dùng cho phân tích có xuất xứ Trung Quốc: NaCl, NaNO3, K2HPO4, MgSO4, CaCl2, NaOH,
Sodium dodecyl sulfate (SDS); axit ethylene diamine tetra-acetic (EDTA) (BioLabs, Mỹ)
Taq DNA polymerase (Thermo scientific, Mỹ); d-NTPs (Fermentas, Mỹ), bộ kit tinh sạch DNA từ gel agarose; bộ kit tách hệ gen của vi khuẩn PureLink®Genomic DNA kit (Thermo Fisher Scientific, Inc.Mỹ).
Kit API 20E, API 20NE và API 50 CHB (Biomerieux, Pháp)
2.3. Các môi trường nuôi cấy
2.3.1. Môi trường làm giàu vi khuẩn sinh cellulase
Môi trường M1: NaNO3 2,5g/l, KH2PO4 2g/l, CaCl2.6H2O 0,1g/l, NaCl 0,1g/l MgSO4: 0,2g/l, CMC 5g/l, hoặc giấy lọc 5g/l[71].
Môi trường M2: NaNO3 2,5g/l, KH2PO4 1 g/l, KCl 2 g/l, Peptone 2g/l, MgSO4 0,5g/l, CMC 5g/l, hoặc giấy lọc 5g/l [71].
Môi trường M3: K2HPO4 2,2g/l, KH2PO4 1,5g/l, (NH4)2SO4 1,3g/l, CaCl2 0,02g/l, FeSO4 0,001g/l, MgCl2 0,1g/l, CMC 5g/l, hoặc giấy lọc 5g/l.
Môi trường M4: Gồm môi trường M3 + Glucose: 0,2g/l Môi trường M5: Gồm môi trường M3 + Peptone: 0,2g
Môi trường M6: Cám gạo 2%, bột đậu nành 1%, casein 1%, NaCl 0.1%.
2.3.2. Môi trường giữ giống, nhân giống và phân lập
Môi trường D5: NaNO3 2g/l, K2HPO4 1g/l, MgSO4 2g/l, KCl 1g/l, Pepton 2g/l, CMC 5g/l, Agar 18g/l, pH 7 [71].
2.3.3. Môi trường sinh tổng hợp enzyme
Môi trường LB có bổ sung cơ chất: Tryptone 10g/l, Yeast extract 5g/l, NaCl 5g/l, NaCl 5g/l, CMC 5g/l hoặc giấy lọc 5g/l.
Môi trường M6: giống với môi trường hoạt hóa.
Môi trường M3 (Giống với môi trường hoạt hóa) [72].
Môi trường D6: Pepton 2g/l; CMC 10g/l; K2HPO4 4g/l, MgSO4 0,06g/l; (NH4)2SO4 0,5g/l; Gelatin 0,4g/l [8].
2.4. Phương pháp nghiên cứu
Phương pháp nghiên cứu trong luận án được thực hiện theo Sơ đồ nghiên cứu mô tả trên Hình 2.1.
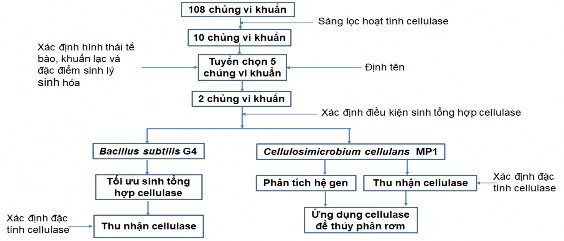
Hình 2.1 Sơ đồ nghiên cứu trong luận án
2.4.1. Phương pháp phân lập và tuyển chọn chủng sinh tổng hợp cellulase
2.4.1.1. Phân lập vi khuẩn sinh cellulase từ ruột mối
Quá trình làm giàu vi khuẩn sinh cellulase được thực hiện theo nghiên cứu của Sreena và cs., 2015 [25]. Lấy 1g mối sau khi thu nhận từ các thân cây gỗ mục, từ rơm, thân cây mía được rửa sạch, khử trùng bề mặt bằng ethanol 70% sau đó cắt bỏ đầu, giữ lại phần thân, sau đó cho vào ống nghiệm, nghiền nhỏ và thêm 5ml nước muối sinh lý vô trùng. Sau khi trộn đều, hút 1ml dịch mối nghiền cho vào bình tam giác có chứa môi trường làm giàu (M1, M2, M3, M4 và M5 và đem nuôi lắc ở nhiệt độ phòng. sau 3 ngày đối với môi trường CMC và 14 ngày đối với cơ chất giấy lọc. Quá trình hoạt hóa kết thúc khi môi trường bị đục hoặc cơ chất giấy lọc bị phân giải. Quá trình phân lập được tiến hành trên môi trường rắn trên đĩa thạch (D5), pha loãng mẫu mối đã được hoạt hóa với hệ số pha loãng từ 10-4 đến 10-7, hút 0,1ml cấy lên môi trường rắn và chang đều, nuôi ở 30ºC trong 2-7 ngày cho đến khi thấy xuất hiện khuẩn lạc, quan sát hình thái khuẩn lạc, sau đó cấy vào môi trường thạch nghiêng để xác định khả năng sinh cellulase và giữ giống [25]. Các chủng phân lập được, tiếp tục được cấy chấm điểm trên môi trường rắn và thử với thuốc thử congo để xác định chủng có khả năng tạo vòng thủy phân. Chủng có khả năng phân giải CMC sẽ tạo ra xung quanh khuẩn lạc vòng thủy phân trong suốt.
Quá trình phân lập vi khuẩn sinh cellulase từ môi trường làm giàu như mô tả trên Hình 2.2.

Hình 2.2 Các bước phân lập vi khuẩn sinh cellulase từ ruột mối [25]
2.4.1.2. Xác định định tính khả năng sinh cellulase của các chủng vi khuẩn phân lập Các chủng vi khuẩn được thử khả năng sinh cellulase trên đĩa thạch bằng
cách cấy chấm điểm trên môi trường rắn D5 có chứa 1% CMC, nuôi ở 30°C, trong 48 giờ. Sử dụng thuốc thử congo đỏ 1% trên đĩa thạch, để yên 15 phút sau đó đổ sạch thuốc thử congo đi rồi rửa lại bằng dung dich NaCl 1M trong 20 phút, tiếp đó đổ hết dung dịch NaCl ra khỏi đĩa thạch và quan sát sự hình thành vòng thủy phân xung quanh khuẩn lạc. Chủng có khả năng sinh cellulase là chủng mà xung quanh khuẩn lạc tạo vòng thủy phân trong suốt [25]. Năng lực thủy phân của chủng phân lập được tính theo Saptarini và Indriyati [71].
Năng lực thủy phân = D / d
Trong đó: D: đường kính vòng thủy phân (mm),
d: đường kính khuẩn lạc (mm)
2.4.1.3. Xác định đặc tính sinh lý, hóa sinh của vi khuẩn sinh cellulase
Phản ứng catalase và khả năng di động được thực hiện theo tài liệu công bố [73]. Các đặc tính sinh hóa của chủng vi khuẩn tuyển chọn được thực hiện sử dụng Kit API
Phản ứng Gram và Hình thái khuẩn lạc được thực hiện theo phương pháp mô tả [73].
2.4.2. Nghiên cứu ảnh hưởng của điều kiện nuôi cấy tới khả năng sinh tổng hợp cellulase
Chủng vi khuẩn được nhân giống trong môi trường nhân giống, sau đó tiếp giống vào các môi trường sinh tổng hợp enzym với tỷ lệ, ở điều kiện nhiệt độ, tốc độ lắc, thời gian như mô tả trong bài. Dịch sau lên men được đem đi ly tâm loại sinh khối thu dịch nổi. Dịch nổi được dùng để xác định hoạt tính cellulase bao gồm CMCase, FPU, Acevilase.
2.4.2.1. Lựa chọn môi trường thích hợp cho quá trình sinh tổng hợp cellulase của chủng vi khuẩn tuyển chọn
Chủng vi khuẩn được nuôi ở các môi trường sinh tổng hợp enzym khác nhau là M3, LB và M6 (Thành phần môi trường ở mục 2.3.3).
2.4.2.2. Ảnh hưởng của các thông số kỹ thuật đến sinh tổng hợp enzym
Ảnh hưởng tỉ lệ tiếp giống: thay đổi tỷ lệ tiếp giống 5%, 10% và 15% , xác định hoạt độ enzym thô các mẫu tương ứng.
Ảnh hưởng của tốc độ lắc: thay đổi tốc độ lắc từ 0 vòng/phút đến 250 vòng/phút, xác định hoạt độ enzym tương ứng
Ảnh hưởng nhiệt độ: thay đổi nhiệt độ lần lượt là 25ºC, 30ºC, 37ºC và 45ºC,
xác định hoạt độ enzym thô các mẫu tương ứng.
Ảnh hưởng pH: điều chỉnh pH thay đổi từ pH 3 đến pH 9, xác định hoạt độ enzym thô các mẫu tương ứng.
2.4.2.2. Ảnh hưởng của thời gian thu nhận
Vi khuẩn nuôi trên các môi trường sinh tổng hợp enzym đã lựa chọn. Với điều kiện nhiệt độ, tốc độ lắc, tỷ lệ tiếp giống đã lựa chọn. Lấy mẫu ở các thời điểm khác nhau 24h, 48h,72h và 96h đem xác định hoạt độ cellulase ở các thời điểm tương ứng.
2.4.2.6. Ảnh hưởng nguồn dinh dưỡng trong môi trường nuôi cấy
Nguồn dinh dưỡng cacbon: thay đổi các nguồn cacbon như Tinh bột, CMC, cám gạo ở các nồng độ khác nhau.
Nguồn dinh dưỡng nitơ: thay đổi các nguôn nitơ khác nhau bao gồm casein, bột đậu tương, NH4NO3, cao nấm men, peptone, NaNO3.
Nồng độ bột đậu tương: thay đổi nồng độ bột đậu tương từ 5g/l đến 20 g/l,
xác định hoạt độ enzym thu được tương ứng
2.4.2.7. Phương pháp qui hoạch thực nghiệm tối ưu môi trường sinh tổng hợp CMCase cho Bacillus subtilis G4 sử dụng phần mềm Design Expert 7.1
Trên cơ sở kết quả nghiên cứu ảnh hưởng của từng yếu tố tới sinh tổng hợp cellulase, tiến hành nghiên cứu tối ưu hóa điều kiện sinh tổng hợp cellulase với các yếu tố ảnh hưởng lớn nhất đến hoạt tính cellulase đã được khảo sát ở mục 2.4.2.6 là nồng độ tinh bột, casein và bột đậu tương. Phương pháp tối ưu bề mặt đáp ứng với 3 yếu tố ảnh hưởng được thiết kế như Bảng 2.4. Hoạt độ CMCase là biến phụ thuộc (Bảng 2.4). Sử dụng phần mềm Design-Expert 7.1 (State-Ease, Inc, Minneapolis, Mỹ) để phân tích các hệ số hồi quy, thiết lập bề mặt đáp ứng và tối ưu hóa theo hàm mong đợi, ANOVA được sử dụng để đánh giá các thông số thống kê.
Bảng 2.2. Giá trị mã hóa và thực nghiệm Design-Expert 7.1
Nồng độ tinh bột (g/L) | Nồng độ casein (g/L) | Nồng độ bột đậu tương (g/L) | |
1 | 5 | 20 | 20 |
2 | 15 | 12,5 | 12,5 |
3 | 15 | 12,5 | 12,5 |
4 | 15 | 12,5 | 12,5 |
5 | 5 | 5 | 5 |
6 | 25 | 20 | 5 |
7 | 15 | 1,25 | 12,5 |
8 | 15 | 12,5 | 12,5 |
9 | 0 | 12,5 | 12,5 |
10 | 5 | 5 | 20 |
11 | 25 | 20 | 20 |
12 | 25 | 5 | 5 |
13 | 5 | 20 | 5 |
14 | 25 | 5 | 20 |
15 | 30 | 12,5 | 12,5 |
16 | 15 | 12,5 | 12,5 |
15 | 12,5 | 12,5 | |
18 | 15 | 12,5 | 23,75 |
19 | 15 | 12,5 | 12,5 |
20 | 15 | 23,75 | 12,5 |
17
2.4.3. Nghiên cứu thu nhận và xác định đặc tính chế phẩm cellulase thu từ
Bacillus subtilis G4
2.4.3.1. Thu nhân chế phẩm cellulase từ vi khuẩn
Dịch nuôi cấy được ly tâm 6000 vòng/phút trong 10 phút ở 4ºC sau đó loại bỏ kết tủa để thu nhận dịch enzym thô. Thêm tác nhân kết tủa là muối (NH4)2SO4 và acetone ở các nồng độ nhau ở nhiệt độ 2ºC vào dịch enzym thô để kết tủa protein sau đó ly tâm 10000 vòng/phút trong 10 phút ở 4ºC thu kết tủa. Hòa tan lại kết tủa trong dung dịch đệm xitrat với thể tích đệm sử dụng bằng với thể tích enzym thô ban đầu. Xác định lại hoạt độ CMCase, hàm lượng protein của mẫu sau kết tủa để đánh giá hiệu suất thu hồi enzym và độ tinh sạch của chế phẩm enzym thu nhận.
Hiệu suất thu hồi (%) =[74].
Độ tinh sạch của enzym (lần) =[74]
2.4.3.2. Đặc tính của chế phẩm cellulase thu nhận.
Nhiệt độ tối ưu và độ bền nhiệt
Nhiệt độ tối ưu của chế phẩm cellulase được xác định thông qua xác đinh hoạt độ CMCase của chế phẩm được ủ với cơ chất ở các nhiệt độ khác nhau. Cho vào ống nghiệm 0,5 ml enzym thêm 1,0 ml dung dịch cơ chất CMC 1% trong đệm citrate pH 4.8, ủ trong thời gian 30 phút ở các nhiệt độ khác nhau 30°C, 40°C, 50°C, 60°C, 70°C và 80°C [75].
Độ bền của enzym được xác định thông qua xác định hoạt độ CMCase còn lại sau thời gian ủ 30 phút ở các nhiệt độ khác nhau. Lấy 1ml enzym vào trong đệm citrate 0,05M (pH 4,8) ủ với các nhiệt độ khác nhau từ 30ºC, 40°C, 50°C, 60°C, 70°C, 80°C và 90°C trong thời gian 30 phút. Sau đó xác định hoạt tính còn lại của enzym theo phương pháp xác định hoạt độ CMCase được mô tả ở mục 2.5.1…. [75].
pH tối ưu và độ bền pH
pH tối ưu của enzym được xác định thông qua hoạt độ CMCase chế phẩm được ủ với cơ chất ở pH phản ứng khác nhau. Chuẩn bị dung dịch đệm có pH khác nhau từ 3 - 10. Cho vào ống nghiệm 0,5 ml enzym + 0,5 ml dung dịch đệm ở các

![Đặc Tính Của Cellulose Và Xylanase Từ C.cellulans [18]](https://tailieuthamkhao.com/uploads/2023/02/19/nghien-cuu-cellulase-tu-vi-khuan-ruot-moi-phan-lap-o-viet-nam-3-1-120x90.jpg)
![Tính Bền Nhiệt Của Cellulase Và Xylanase Từ C.cellulans [18].](https://tailieuthamkhao.com/uploads/2023/02/19/nghien-cuu-cellulase-tu-vi-khuan-ruot-moi-phan-lap-o-viet-nam-4-1-120x90.jpg)