cứu phòng thí nghiệm, trong suốt quá trình chiết mẫu cây luôn có nhiệt độ bằng nhiệt độ sôi của dung môi nên không thích hợp cho các hợp chất kém bền nhiệt như carotenoid hoặc tạo các tạp chất trong quá trình chiết. (Nguyễn Trọng Tuân, 2007)
- Tiến hành
Sơ đồ bố trí thí nghiệm chiết cao từ các bộ phận cây Trứng cá trình bày trong hình
Quả sống, quả chín
Cắt nhỏ, sấy khô, xay
nhuyễn, xác định độ ẩm
Xay nhuyễn
Ethanol 96 % trong 3 giờ ở 70 oC
Dịch
chiết lá
Dịch chiết
vỏ thân
Dịch chiết
quả chín
Dịch chiết
quả non
Cao lá
Cao vỏ thân
Cao quả
chín
Cao quả
non
Bộ phận cây trứng cá
Lá, vỏ thân
Hình 3.1. Sơ đồ bố trí chiết cao từ các bộ phận cây Trứng cá
Lá, vỏ thân, quả non và quả chín cây trứng cá tươi thu hái về rửa sạch. Sau đó lá và vỏ thân cây trứng cá làm khô bằng cách sấy khô đến khối lượng không đổi trong tủ sấy ở điều kiện 60 oC trong 6 giờ. Xay nhỏ lá và vỏ thân trứng cá bằng máy nghiền để tạo bột khô thu được ml, mt (g)
Quả chín và quả sống để ráo nước, sau đó cân xác định khối lượng tươi ms, mc (g), bảo quản tủ lạnh.
Chiết lá và vỏ thân khô: cho mẫu bột vào thau nhỏ làm ẩm dược liệu với một lượng dung môi vừa đủ, để dược liệu trương nở trong 30 phút. Dược liệu sau khi làm
ẩm cho vào bình cầu thủy tinh (được sấy khô), rót dung môi từ từ vào bình cầu tỉ lệ 1:20 (w/v) và lắp hệ thống sinh hàn. Dung môi ethanol 96 % cách mặt dược liệu 2 - 3 cm. Cho nước chảy liên tục trong ống sinh hàn. Điều chỉnh nhiệt độ bếp điện tương đương 65 - 70 oC. Sau khi thấy tim sôi trong bình cầu ta bắt đầu tính thời gian chiết 3 giờ. Sau 3 giờ tắt bếp để dich chiết nguội, lọc dịch chiết qua bông. Lặp lại 3 lần chiết, gộp các dịch chiết cô dung môi bằng bếp cách thủy thu mẫu cao xác định độ ẩm cao, khối lượng cao và hiệu suất chiết. Cao chiết bảo quản tủ lạnh nhiệt độ 4 - 8 oC.
Quả non và quả sống: cho mẫu vào máy xay, bổ sung dung môi lượng vừa đủ, xay nhỏ tốc độ (10000 vòng/phút) trong 5 phút. Quả sau khi xay cho vào bình cầu thủy tinh (được sấy khô), rót dung môi từ từ vào bình cầu tỉ lệ 1:10 (w/v) và lắp hệ thống sinh hàn. Dung môi ethanol 96 % cách mặt dược liệu 2 - 3 cm. Cho nước chảy liên tục trong ống sinh hàn. Điều chỉnh nhiệt độ bếp điện tương đương 65 - 70 oC. Sau khi thấy tim sôi trong bình cầu ta bắt đầu tính thời gian chiết 3 giờ. Sau 3 giờ tắt bếp để dich chiết nguội, lọc dịch chiết qua bông. Lặp lại 3 lần chiết, gộp các dịch chiết cô dung môi bằng bếp cách thủy thu mẫu cao xác định độ ẩm cao, khối lượng cao và hiệu suất chiết. Cao chiết bảo quản tủ lạnh nhiệt độ 4 - 8 oC
- Chỉ tiêu theo dõi: độ ẩm nguyên liệu và hiệu suất chiết.
+ Độ ẩm nguyên liệu: độ ẩm là lượng nước tự do có trong nguyên liệu. Biết được độ ẩm là điều quan trọng trong công tác phân tích xác định chất lượng nguyên liệu. Dược liệu thường quy định một giới hạn độ ẩm nhất định gọi là độ ẩm an toàn của dược liệu. Ở độ ẩm này hay thấp hơn dược liệu có thể được an toàn trong quá trình lưu trữ. Để xác định độ ẩm ta có thể sử dụng nhiều phương pháp theo Trần Hùng (2010) như sấy, chưng cất.
Nguyên tắc: dùng sức nóng làm bay hơi hết nước trong mẫu nguyên liệu ở những điều kiện nhiệt độ và áp suất nhất định. Cân trọng lượng mẫu trước và sau khi sấy khô, từ đó tính ra phần trăm nước có trong mẫu nguyên liệu.
Tiến hành xác định độ ẩm: Phương pháp sấy
Dùng tủ sấy: lấy một bình thủy tinh hình trụ có nắp mài, sấy đến khối lượng không đổi ở nhiệt độ 105 oC. Cân vào bình một lượng chính xác khoảng 3 g dược liệu rồi đem sấy trong tủ sấy ở nhiệt độ 105 oC trong 2 - 3 giờ. Dùng kẹp lấy bình trụ ra, để vào bình hút ẩm, mở khóa hoặc hé mở nắp bình hút ẩm cho thông khí với bên ngoài trong 1 phút rồi đóng kín bình hút ẩm. Để nguội trong bình hút ẩm 15 phút.
Cân và ghi kết quả. Tiếp tục sấy trong 1 giờ, để nguội và cân mẫu như trên cho đến khi kết quả 2 lần cân liên tiếp chênh lệch nhau không quá 5 mg.
Tính kết quả độ ẩm theo công thức:
X = 𝑎−𝑏 𝑥100 %
𝑎
X: độ ẩm dược liệu, tính ra phần trăm a: khối lượng dược liệu khi chưa sấy (g)
b: khối lượng dược liệu khi sấy đến khối lượng không đổi (g)
Dùng cân xác định độ ẩm: trải mỏng khoảng 1,5 g dược liệu đã được nghiền mịn lên dĩa cân và tiến hành xác định độ ẩm theo hướng dẫn sử dụng máy. Đọc kết quả. Sau khi kết thúc thí nghiệm, phải để máy nguội khoảng 10 phút rồi mới thực hiện mẫu kế tiếp.
+ Hiệu suất chiết: hiệu suất chiết (H %) được xác định tỷ lệ % khối lượng giữa lượng dịch chiết thu được sau khi đã làm khô so với khối lượng mẫu sử dụng .
Công thức hiệu suất:
H = 𝑚1 𝑥100 %
𝑚2
Trong đó :
H: hiệu suất chiết (%); m1: khối lượng bột dược liệu khô; m2: khối lượng cao chiết sau khi cô dung môi
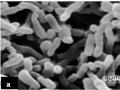
3.3.4.2. Nuôi cấy và nhận diện dòng vi khuẩn Propionibacterium acnes
Sơ đồ thí nghiệm
Tube Eppendorf chứa vi khuẩn P. acnes trữ ở nhiệt độ -40 oC
Nuôi cấy dòng vi khuẩn trong môi trường TYEG broth
Nuôi cấy và phân lập dòng vi khuẩn trên môi trường TYEG agar có bổ sung
bromocresol purple 0,002 %
Nuôi cấy và phân lập dòng vi khuẩn P. acnes trên môi trường thạch nghiêng TYEG
Hình 3.2. Sơ đồ nuôi cấy và phân lập vi khuẩn Proionibacterium acnes từ mẫu lưu trữ
- Tiến hành (Kishisita et al., 1980)
Ống nghiệm chứa môi trường TYEG borth hấp tiệt trùng ở 121 oC
Tube Eppendorf chứa vi khuẩn P. acnes trữ ở nhiệt độ 40 oC được đặt nhiệt độ thường 15 phút sau đó cấy vào môi trường TYEG broth, ủ ở 37 oC từ 5 - 7 ngày.
Hút 30 µl dòng vi khuẩn trong tube cho vào ống nghiệm chứa môi trường TYEG broth Tiến hành cấy ria vi khuẩn từ môi trường TYEG broth lên đĩa thạch môi trường TYEG agar có bổ sung bromocresol purple 0,002 % ủ kỵ khí ở 37 oC từ 5 - 7 ngày Chọn khuẩn lạc có màu vàng, đục, mô cao hoàn toàn trên môi trường và làm môi trường từ tím chuyển sang vàng (do khuẩn lạc thuộc giống vi khuẩn Propionibacterium phát triển sinh acid propionic làm giảm pH của môi trường). Tiến hành nuôi cấy trên trên môi trường thạch nghiêng TYEG, ủ ở 37 oC trong 48 giờ. Sau đó vi khuẩn được định danh bằng các phản ứng sinh hóa.
Nhận diện dòng vi khuẩn bằng một số thử nghiệm hoá sinh Nhuộm Gram
Tiến hành nhuộm Gram theo hướng dẫn sử dụng bộ nhuộm Gram công ty TNHH Nam Khoa
- Chuẩn bị vết bôi: làm sạch kính mang vật bằng cồn 70 %, nhỏ 1 giọt nước cất vô trùng vào giữ kính mang vật, dùng que cấy chuyển một ít vi khuẩn vào giọt nước tán nhẹ cho vi khuẩn hoà tan vào giọt nước, làm khô trong không khí.
- Cố định mẫu: hơ nhanh vết bôi trên ngọn lửa đèn cồn 2 - 3 lần.
- Nhuộm với dung dịch crystal violet, để 1 phút, rửa nước, thấm khô.
- Nhuộm lại bằng dung dịch lugol trong 1 phút, rửa nước, thấm khô
- Nhỏ cồn 95 % giữ khoảng 30 giây hoặc cho cồn chảy qua vết bôi vi khuẩn liên tục đến khi nước cồn chảy không còn màu rửa lại nước và thấm khô.
- Nhuộm bổ sung bằng dung dịch Safranin trong 1 phút, rửa nước, để khô trong không khí.
- Quan sát dưới kính hiển vi với vật kính 100X.
Thử nghiệm catalase (Nguyễn Lân Dũng, 2009)
- Lấy sinh khối khuẩn lạc trên môi trường thạch TYEG sau 48 giờ ủ. Hoà tan sinh khối vào giọt nước sẵn trên miếng lam.
- Thêm vào một hoặc vài giọt H2O2 3 %
- Quan sát sự hình thành bọt khí và ghi nhận kết quả: Nếu dương tính thì có hình thành bọt khí, nếu kết quả âm tính thì không có sự hình thành bọt khí.
Kiểm tra sự hình thành indol (John Harley and Lansing Prescott, 2002)
Xác định khả năng của vi sinh vật có khả năng tạo indol từ việc phân giải acid amin trytophan bởi enzym tryptophanase. Indol sinh ra kết hợp với andehyde có trong thuốc thử Kovac’s tạo vòng màu hồng/đỏ trên bề mặt môi trường.
Tiến hành
- Cho vào ống nghiệm có nấp đậy 10 ml môi trường trypticase soyar broth (1 %), khử trùng 121 oC trong 15 phút, để nguội.
- Dùng que cấy lấy một ít khuẩn lạc cần kiểm tra chủng vào ống nghiệm chứa môi trường, đậy nắp, ủ kỵ khí 48 giờ ở 37 oC cho vi khuẩn phát triển.
- Mỗi ống nghiệm cho 0,5 ml thuốc thử Kovac’s.
- Đọc kết quả: Dương tính khi vòng Pellicle vàng của thuốc thử Kovac’s chuyển sang màu hồng/đỏ trên bề mặt môi trường. Âm tính khi vòng Pellicle vàng của thuốc thử Kovac’s không bị biến đổi.
Khả năng phản nitrat hoá (John Harley and Lansing Prescott, 2002) Môi trường:
Nước thịt pepton 100ml KNO3 1g
pH= 7,2 - 7,4
Phân môi trường vào các ống nghiệm (4 - 5 ml), khử trùng ở 121 oC trong 30 phút.
Cấy vi khuẩn mới hoạt hoá. Dùng vaselin bịt kín nút để ngăn oxy, đặt ở nhiệt độ thích hợp trong 1 - 7 ngày và quan sát sự phát triển của vi khuẩn (tăng độ đục của dịch nuôi cấy, sinh khí NH3). Vi khuẩn có phát triển là phản ứng dương tính, không phát triển là phản ứng âm tính.
Khả năng làm dịch hoá gelatin (John Harley and Lansing Prescott, 2002)
Môi trường:
Pepton 5g
Gelatin 100 - 150g Nước cất 1000 ml pH= 7,2 - 7,4
Phân môi trường vào các ống nghiệm (4 - 5 ml), khử trùng ở 115 oC trong 20 phút. Cấy vi khuẩn mới hoạt hoá (18 - 24 giờ) chích sâu vào môi trường gelatin, giữ ống không cấy làm đối chứng, nuôi ở 37 oC trong thời gian 5 - 7 ngày.
Quan sát khả năng làm dịch hoá gelatin tại nhiệt độ phòng từ 20 oC trở xuống. Nếu bề mặt môi trường gelatin không lõm xuống, gelatin vẫn ở trạng thái ổn định là phản ứng âm tính (không sinh gelatinase); nếu một phần hay toàn bộ gelatin hoá lỏng là phản ứng dương tính.
Vi khuẩn P. acnes là vi khuẩn Gram dương, tế bào hình que, catalase dương tính, có khả năng sinh indol, tạo phản ứng phản nitrat và dịch hóa gelatin.
3.3.4.3. Khảo sát khả năng ức chế vi khuẩn Propionibacterium acnes của cao chiết cây Trứng cá
Phương pháp khuếch tán giếng thạch (agar well diffusion) tiến hành có những điểm biến đổi phù hợp điều kiện phòng thí nghiệm.
Sơ đồ thí nghiệm
Chủng 50 L huyền phù Propionibacterium acnes được nuôi 48 giờ, pha loãng đạt mật số 108 tế bào/ ml, trải mẫu, để ráo
Môi trường dịch chiết tim TSB agar
Bơm 30 l các cao chiết lần lượt vào các giếng, ủ mẫu nhiệt độ phòng trong 30 phút cho cao chiết trong giếng khuếch tán.
Tạo các giếng đường kính 6 mm
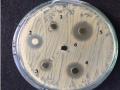
Ủ ở 37 oC, 48 giờ, đo đường kính vòng vô khuẩn.
Hình 3.3. Sơ đồ khảo sát khả năng ức chế vi khuẩn P. acnes của cao chiết Tiến hành thí nghiệm
- Pha loãng cao chiết: các cao được pha lõang trong Dimethyl Sulfoxide (DMSO) thành các nồng độ khác nhau: cân 0,2 g cao cho vào 1ml DMSO ta được nồng độ 200 mg/ml, pha loãng thu được nồng độ 100 mg/ml, 50 mg/ml.
- Chuẩn bị đĩa môi trường dịch chiết agar, dày 4mm.
- Huyền phù P. acnes: các dòng vi khuẩn đã được nuôi cấy sau 48 giờ trong môi trường lỏng tăng sinh khối, sao cho mật số vi khuẩn khoảng 108 tế bào/ml (tương đương độ đục Mc Farland 0,5).
- Hút 50 l huyền phù P. acnes (mật số 108 tế bào/ ml), trải mẫu lên đĩa môi trường TSB agar, để ráo. Đục 4 giếng đường kính 6 mm sao cho mỗi giếng cách nhau khoảng 2 - 3 cm.
- Bổ sung 30 l lần lượt các cao vào các giếng thạch. Đối chứng sử dụng levofloxacin 5 g/mL và đối chứng âm là DMSO. Tiến hành lần lượt ở các nồng độ khác nhau.
- Ủ mẫu ở nhiệt độ phòng khoảng 30 phút cho dịch chiết từ các giếng khuếch tán ra môi trường nuôi cấy vi khuẩn. Sau đó, ủ kỵ khí, ở 37 oC trong 48 giờ.
- Đọc kết quả đo đường kính vòng vô khuẩn theo công thức :
ĐK (mm) = D-d
Trong đó ĐK: đường kính vòng vô khuẩn (mm).
D: đường kính vòng sáng xung quanh giếng thạch (mm). d: đường kính giếng thạch (mm)
Thí nghiệm lặp lại 3 lần lấy giá trị đường kính trung bình.
3.3.4.4. Xác định nồng độ ức chế tối thiểu (MIC) của cao chiết với vi khuẩn Propionibacterium acnes
Mục tiêu: xác định nồng độ nhỏ nhất của cao chiết có hoạt tính kháng khuẩn cao nhất, có thể ức chế vi khuẩn P. acnes.
Nguyên tắc: xác định nồng độ thấp nhất ức chế sự phát triển của vi khuẩn P. acnes của cao chiết có hoạt tính kháng khuẩn cao nhất bằng phương pháp khuếch tán giếng thạch (agar well diffusion method) của (Đỗ Trung Đàm, 2006).
Tiến hành thí nghiệm
Tương tự như thí nghiệm trên nhưng ở các mức nồng độ khác nhau theo dãy sau 40 mg/ml; 20 mg/ml; 10 mg/ml và 5 mg/ml. Đối chứng âm là DMSO.
Đọc kết quả: nồng độ ức chế tối thiểu được xác định là nồng độ của cao chiết nhỏ nhất mà ở đó không thấy sự phát triển của vi khuẩn P. acnes chính là giá trị MIC của cao chiết trên vi khẩn P. acnes.
3.3.4.5. Định tính một số hợp chất thiên nhiên trong cao chiết cho khả năng kháng khuẩn cao nhất
Mục tiêu: xác định một số hợp chất thiên nhiên trong cao chiết có hiệu quả kháng khuẩn cao nhất từ cây Trứng cá
Tiến hành thí nghiệm: tiến hành xác định một số hợp chất trong cao chiết Trứng cá như: nhóm flavonoid, saponin, tanin. Các hợp chất flavonoid, saponin, tanin được định tính bằng phương pháp trình bày trong bảng 3.2
Bảng 3.2. Định tính một số hợp chất trong dịch chiết ethanol cao chiết Trứng cá
Thực nghiệm | Hiện tượng | |
Flavonoid | 1 g cao chiết + 2 ml methanol + vài hạt bột Mg + 0,5 ml HCl đđ | Dung dịch màu hồng tới đỏ |
Saponin | 5 g cao chiết + 5 ml nước cất, đun ấm, lắc mạnh | Xuất hiện bọt bền |
Tanin | 1 g cao chiết + 20 ml nước cất, thêm vài giọt NaCl và FeCl3 10 % | Xuất hiện tủa xanh lá cây, xanh đen |
Có thể bạn quan tâm!
-
 Khảo sát khả năng ức chế vi khuẩn gây bệnh mụn trứng cá Propionibacterium acnes của cao chiết từ cây Trứng cá Muntingia calabura L. - 2
Khảo sát khả năng ức chế vi khuẩn gây bệnh mụn trứng cá Propionibacterium acnes của cao chiết từ cây Trứng cá Muntingia calabura L. - 2 -
 Cơ Chế Gây Bệnh Trứng Cá Vi Khuẩn Propionibacterium Acnes
Cơ Chế Gây Bệnh Trứng Cá Vi Khuẩn Propionibacterium Acnes -
 Tình Hình Nghiên Cứu Và Ứng Dụng Cao Chiết Từ Cây Trứng Cá Trong Và Ngoài Nước
Tình Hình Nghiên Cứu Và Ứng Dụng Cao Chiết Từ Cây Trứng Cá Trong Và Ngoài Nước -
 Nuôi Cấy Và Nhận Diện Vi Khuẩn Propionibacterium Acnes
Nuôi Cấy Và Nhận Diện Vi Khuẩn Propionibacterium Acnes -
 Định Tính Một Số Hợp Chất Thiên Nhiên Trong Cao Chiết Từ Lá Trứng Cá
Định Tính Một Số Hợp Chất Thiên Nhiên Trong Cao Chiết Từ Lá Trứng Cá -
 Khảo sát khả năng ức chế vi khuẩn gây bệnh mụn trứng cá Propionibacterium acnes của cao chiết từ cây Trứng cá Muntingia calabura L. - 8
Khảo sát khả năng ức chế vi khuẩn gây bệnh mụn trứng cá Propionibacterium acnes của cao chiết từ cây Trứng cá Muntingia calabura L. - 8
Xem toàn bộ 89 trang tài liệu này.

Puguh et al., 2014