kháng viêm và chống oxy hoá.
2.3.3.3. Vỏ thân
Qua các tài liệu đã công bố về thành phần hoá học các nhà khoa học phân lập được rất nhiều các hợp chất từ dịch chiết vỏ thân Muntingia calbura L. như sau: Flavonoid: 8-hydroxy-7’,3’,4’,5’-tetramethoxyflavon; 8,4’-dihydroxy-7,3’,5’- trimethoxyflavon; 6,7-dimethoxy-5-hydroxyflavon; 5,7-dimethoxyflavon; 3,5- dihydroxy-6,7-dimethoxyflavan; (2S)-5’-hydroxy-7,8,3’,4’-tetramethoxyflavan Hợp chất khác: -sitistenon; 6--gydroxystigmast-4-en-3-one, -sitosterol; acid syringic; acid vanillic, 3-hydroxy-1-(3,5-dimethoxy-4-hydroxyphenyl)propan-1-on,
tetracosyl ferulate; hexacosanol (Mahmood et al., 2013)
2.3.4. Tác dụng dược lý cây Trứng cá
Trong suốt nhiều thập kỉ qua các nhà khoa học trên khắp thế giới cố gắn khám phá và nghiên cứu nhiều tác dụng dược lí mà cây Trứng cá mang lại cho con người. Cây Trứng cá đã cho thấy nhiều tiềm năng dược phẩm mới trong tươi lai. Theo kinh nghiệm dân gian người dân Peru dùng lá sắc với nước sử dụng giảm đau dạ dày, sưng tuyến tiền liệt và hạ sốt giảm đau đầu (Morton (1987), Zakaria (2007b). Vỏ thân sử dụng như thuốc giảm sưng viêm (Zakaria, 2006). Tại Colombia hoa sử dụng như loại thuốc an thần, chống co giật, trầm cảm. Ở Mexico, cây trồng sử dụng điều trị bệnh sởi, nhọt miệng và đau dạ dày.
2.3.4.1. Độc tính cấp
Độc tính cấp của M. calabura được nghiên cứu năm 2011 theo Sridhar (2011), dịch chiết methanol lá với liều 300 mg/kg, 500 mg/kg và 2000 mg/kg dùng theo đường uống của chuột. Quan sát hiện tượng trong 2 - 3 giờ đầu, tỷ lệ tử vong bắt đầu ghi nhận từ 24 giờ đến 14 ngày. Kết quả thu được không thấy có dấu hiệu độc tính cấp và tỷ lệ tử vong liều 2000 mg/kg dịch chiết là 0 %. Nghiên cứu khác về độc tính cấp của lá M. calabura thu hái tại Selangor, Malaysia thực hiện bởi Irahim (2012). Dịch chiết ethanol lá liều thử nghiệm 2000 và 5000 mg/kg dùng đường uống ở chuột. Tỷ lệ tử vong ghi nhận đến ngày 14 sau khi uống dịch chiết là 0 %, không nhìn thấy dấu hiệu lâm sàng về sự suy yếu của động vật, quan sát cấp độ tế bào về mô học, sinh hoá máu, công thức máu cho thấy không có sự bất thường nào ở chuột. Những phát hiện này cho thấy dịch chiết lá M. calabura không gây ra ngộ độc cấp tính dù ở liều cao (5000 mg/kg).
Karthyaini và Suresh (2012) nghiên cứu độc tính cấp của quả M. calabura liều thử nghiệm giới hạn 1000 mg/kg và 2000 mg/kg không có dấu hiệu độc tính cấp hoặc tử vong ghi nhận cả hai mức liều.
2.3.4.2. Hoạt tính gây độc tế bào
Những năm gần đây Chen et al., 2004 nghiên cứu độc tính tế bào của M. calabura, trong đó 15 hợp chất phân lập từ dịch chiết methanol vỏ thân đã được kiểm tra bằng các thí nghiệm gây độc tế bào. Hoạt động chống lại tế bào P-388, A549, và HT-29. Trong số các hợp chất phân lập, các hợp chất 8-hydroxy-7,3’,4’,5’- tetramethoxyflavane; 8,4’-dihydroxy-7,8’,5’-trimethoxyflanane; 5-dihydroxy-6,7- dimethoxyflavone; -sitostenone; acid vanillic; 3-hydroxy-1-(3,5-dimethoxy-4- hydroxyphenyl) propran-1-on; tetracolsyl ferulate có hoạt tính chống lại tế bào P-388 với ED50 ghi nhận lần lượt là 3,56 g/ml; 3,71 g/ml; 9,39 g/ml; 6,28 g/ml; 10,72
g/ml; 15,62 g/ml và 3,27 g/ml đối chứng mithramycin (ED50 = 0,06 g/ml ).
2.3.4.3. Hoạt tính kháng khuẩn
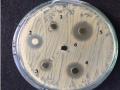
Hợp chất phenolic có trong các bộ phận cây Trứng cá có khả năng kháng khuẩn cao. Theo nghiên cứu Yasunaka (2005) sử dụng cao chiết methanol lá và quả Trứng cá thu hái tại Veraceuz, Mexico cho khả năng kháng hai chủng vi khuẩnErcherichia coli (C600) và Staphylococcus aureus (209P) ở nồng độ 100 mg/ml. Kết quả MIC thu được hai loại cao chiết methanol lá và methanol quả là trên hai dòng vi khuẩn Ercherichia coli, Staphylococcus aureus lần lượt là 512/1024 μg/ml và 128/256 μg/ml.
Một nghiên cứu khác của Zakaria (2006) về hoạt tính kháng khuẩn của cao chiết lá Trứng cá với các dung môi methanol, nước và chloroform. Cao chiết pha loãng các nồng độ khác nhau (10000, 40000, 70000 và 100000 ppm) thử nghiệm chống lại Corneybacterium, S. Aureus, Bacillus cereus, Proteus vulgaris, Staphylococcus epidermidis, Kosuria rhizophila, Shigella fleneri, E. Coli, Aermonashydrophila và Salmonella typhi bằng phương pháp khuyếch tán đĩa thạch in vitro. Kết quả cho thấy cao chiết chloroform ít hiệu quả hơn so với cao chiết nước và methanol. Ở tất cả các nồng độ thử nghiệm, dịch chiết nước ức chế sự phát triển của S. aureus và K. rhizophila trong khi dịch chiết methanol kháng lại vi khuẩn S. flexneri, B. cereus, S. aureus, P. vulgaris, A. hydrophila và K. rhizophila. Ở nồng độ 40000 ppm trở lên, dịch chiết nước hoạt tính kháng khuẩn tác động đối với vi khuẩn C. diphtheriae, P. vulgaris, S. epidermidis và A. hydrophila
Một nghiên cứu khác thực hiện bởi Zakaria et al., 2007a khảo sát khả năng kháng dòng vi khuẩn Staphyloccocus aureus của 3 loại cao chiết từ lá trứng cá với các dung môi nước, chloroform, methanol. Kết quả cho thấy cả 3 loại cao chiết từ lá Trứng cá có hoạt tính kháng khuẩn các dòng S. aureus 29213, S. aureus 33591, S. aureus 700699. Giá trị MIC ứng với 3 loại cao chiết nước, chloroform, methanol lần lược là 5 μg/ml ; 1,25 μg/ml và 2,5 μg/ml. Năm 2010, Zakaria tiếp tục các nghiên cứu 3 loại dịch chiết Trứng cá khảo sát khả năng kháng các chủng vi khuẩn khác như S. aureus
ATCC 25923 [nhạy cảm methicilin], S. aureus ATCC 33591 [kháng methicilin], E. coli ATCC 10536, Pseudomonas aeruginosa ATCC 27853, Candida albicans ATCC 10231, và Microsporum canis ATCC 36299 bằng phương pháp khuếch tán đĩa thạch. Kết quả thu được chỉ cao chiết methanol ức chế sự phát triển của S. aureus ATCC 25923 và S. aureus ATCC 33591 với giá trị MIC là 1250 μg/ml và MBC là 2500 μg/ml. Cao chiết nước và chloroform không ức chế các chủng vi khuẩn C. albicans,
M. canis, P. aeruginosa và E. coli. Cao chiết methanol lắc phân đoạn với các dung môi từ không phân cực đến phân cực (ether, ethylacetat, nước) khảo sát khả năng kháng khuẩn S. aureus ATCC 25923 và S. aureus ATCC 33591 các phân đoạn. Phân đoạn ethylacetat cho thấy khả năng kháng hai dòng vi khuẩn này với giá trị MIC và MBC ghi nhận được là 156 μg/ml và 313 μg/ml.
2.3.4.4. Hoạt tính chống oxy hoá
Gốc tự do là một sản phẩm tất yếu của các quá trình sinh lý sinh hoá trong cơ thể. Trong cơ thể luôn có sự cân bằng mật độ gốc tự do. Khi nồng độ gốc tự do tăng quá cao gây mất cân bằng, dẫn tới những tổn thương tế bào, phá huỷ protein, DNA đẩy nhanh quá trình lão hoá và gây ung thư. Để xác định tiềm năng chống oxy hoá của M. calabura được thực hiện bởi Zakaria et al., 2007b. Những lá Trứng cá thu hái từ Selangor, Malaysia phơi khô và chiết với dung môi nước. Tiến hành thử nghiệm bằng phương pháp DPPH và superoxid anion kết quả cho thấy dịch chiết nước có khoảng 94,8 1,14 % và 83,70 2,05 % khả năng chống oxy hoá khi đo bằng 2 phép thử.
Một nghiên cứu khác của Siddiqua (2010), dịch chiết methanol lá Trứng cá cho thấy khả năng chống oxy hoá bằng phương pháp DPPH với nồng độ ức chế IC50 = 22
g/ml cao hơn so với acid ascorbic có giá trị IC50 = 12 g/ml
2.3.4.5. Hoạt tính kháng viêm
Lá Trứng cá có thể sử dụng như thức uống giống trà tác dụng điều trị giảm sưng viêm. Theo nghiên cứu Zakaria, (2007b) để điều trị viêm cấp do carrageenan gây ra sử dụng dịch chiết nước lá Trứng cá với nồng độ 10 %, 50 %, 100 % (tương đương với liều 27 mg/kg, 135 mg/kg và 270 mg/kg tương ứng). Kết quả thu được chứng minh rằng dịch chiết nước từ lá Trứng cá có hoạt tính chống viêm. Hoạt tính viêm ở mô do carageenan gây ra mất hoàn toàn sau 7 giờ ở nồng độ 10 % và 50 % dịch chiết nước, sau 6 giờ đối với nồng độ 100 %. Đặc biệt tại các nồng độ dịch chiết khả năng chống viêm cao hơn nhiều so với thuốc đối chứng ASA (100 mg/kg).
2.3.4.6. Hoạt tính bảo vệ tim mạch
Báo cáo khả năng bảo vệ tim mạch lá trứng cá thực hiện bởi Nivethetha (2009). Dịch chiết lá Trứng cá với dung môi là nước có khả năng bảo vệ tim bằng cách làm giảm nguyên nhân gây nhồi máu cơ tim (AST, ALT, LDH, CK, acid uric) ở chuột. Hoạt tính một số enzym giảm khi sử dụng dịch chiết nước lá Trứng cá ở nồng độ 200 và 300 mg/kg.
2.3.4.7. Hoạt tính chống bệnh đái tháo đường
Theo Sirdhar (2011) cao chiết methanol lá Trứng cá có khả năng chống lại bệnh đái tháo đường với liều 300 mg/kg và 500 mg/kg. Liều 500 mg/kg cao methanol làm giảm lượng đường huyết từ 83,19 mg/dl (lúc 0 giờ) xuống 62,62 mg/dl (cuối 6 giờ). Hiệu quả đối với khả năng dung nạp glucose đường uống cũng được khảo sát. Kết quả cho thấy liều 500 mg/kg làm giảm lượng đường huyết trong 1 giờ (116,46 6,94 mg/dl) trong khi nhóm chỉ sự dụng kẹo cao su (144,73 7,86 mg/dl). Nghiên cứu khác về khả năng tăng đường huyết sau khi sử dụng Alloxan. Với liều 500 mg/kg cho thấy khả năng giảm đường huyết 37 % so với thuốc đối chứng glipizide 5 mg/kg.
2.4. TÌNH HÌNH NGHIÊN CỨU VÀ ỨNG DỤNG CAO CHIẾT TỪ CÂY TRỨNG CÁ TRONG VÀ NGOÀI NƯỚC
2.4.1. Tình hình nghiên cúu và ứng dụng cao chiết từ cây Trứng cá trên thế giới
Theo Zakaria (2006) tiến hành thử nghiệm khảo sát khả năng kháng khuẩn của dịch chiết từ lá Trứng cá lần bằng 3 dung môi khác nhau nước, methanol, chloroform bằng phương pháp khuếch tán giếng thạch. Kết quả thu được dịch chiết nước có khả năng chống lại Staphylococcus aureus, Kosuria rhizophila, dịch chiết methanol có khả năng chống lại Shigella flexneri, Bacillus cereus, Staphylococcus aureus, Proteus vulgaris, Aeromonas hydrophila, Kosuria rhizophila; các khả năng kháng khuẩn này không tìm thấy ở dịch chiết chloroform.
Theo Zakaria (2011), tiến hành thử nghiệm các hoạt động chống oxy hoá và tăng sinh tế bào từ dịch chiết lá Trứng cá bằng 3 dung môi nước, chloroform, methanol được thực hiện trong nghiên cứu này. Đánh giá bằng phương pháp thử MTT ((2,4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolim). Dịch chiết nước và methanol cho kết quả ức chế sự phát triển các tế bào ung thư MCF-7, HeLa, HT-29, HL-60 và K-562 trong khi dịch chiết chloroform chỉ ức chế phát triển tế bào ung thư MCF-7, HeLa, HL-60 và K-562. Bên cạnh đó tất cả dịch chiết từ các dung môi không ức chế sự gia tăng các tế bào bình thường 3T3, cho thấy sự an toàn khi sử dụng. Tất cả các dịch chiết ở nồng độ (20 g/ml, 100 g/ml, 500 g/ml) đều có hoạt tính chống oxy hoá, trong đó dịch chiết nước và methanol có hoạt tính chống oxy hoá cao hơn dịch chiết chloroform. Tổng hàm lượng phenolic trong 3 dung môi nước, methanol,
chloroform lần lượt là 2970,4 6,6; 1279 6,1; 2978,1 4,3 mg/100g acid gallic.
Theo Zakaria (2010) nghiên cứu xác định hoạt tính kháng khuẩn invitro của dịch chiết toàn phần và phân đoạn của lá Trứng cá. Lá trứng cá được chiết với 3 loại dung môi là nước, chloroform và methanol với tỷ lệ 1:20 (w/v) trong 72 giờ với quy trình lặp lại ba lần. Các dòng vi khuẩn khảo sát là Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Cadida albicans và Microsporum canis. Dịch chiết methanol ức chế Staphylococus aureus (MIC = 1250 g/ml, MBC = 1250 g/ml) và được xem là dịch hiệu quả nhất trong cả ba loại dung môi. Tiến hành chiết phân đoạn ethyl acetat hoạt tính kháng khuẩn Staphylococcus aureus đạt giá trị MIC 156 g/ml.
2.4.2. Tình hình nghiên cúu và ứng dụng cao chiết từ cây Trứng cá ở Việt Nam
Trong nước, cây Trứng cá chủ yếu nghiên cứu về sinh thái, khả năng chống chịu và thực trạng cây ven đường. Còn các nghiên cứu về hóa học và tác dụng sinh dược học của các hợp chất polyphenol khai thác từ cây trứng cá với mục đích phục vụ lĩnh vực y dược còn rất ít. Các công bố nghiên cứu chủ yếu dựa vào thế giới và ứng dụng dân gian. Thực tế cho thấy tìm năng điều trị bệnh tim mạch, tiểu đường, gout và chống oxy hóa của các chất chiết từ cây Trứng cá là vô cùng phong phú nhưng vẫn chưa khai thác mạnh mẽ trong nước. Vì vậy việc tiếp tục nghiên cứu đặc tính dược liệu của chiết từ cây Trứng cá có ý nghĩa to lớn trong phòng và điều trị một số bệnh hiện nay là rất cần thiết.
CHƯƠNG 3
PHƯƠNG TIỆN VÀ PHƯƠNG PHÁP NGHIÊN CỨU
3.1. THỜI GIAN VÀ ĐỊA ĐIỂM
Thời gian : Thí nghiệm được thực hiện từ 12/2016 đến 4/2017
Địa điểm: Phòng thí nghiệm Vi sinh, phòng thí nghiệm Dược liệu Khoa Dược- Điều Dưỡng trường Đại học Tây Đô.
3.2. PHƯƠNG TIỆN NGHIÊN CỨU
3.2.1. Nguyên vật liệu
- Mẫu vi khuẩn: Dòng vi khuẩn Propionibacterium acnes 134N từ nghiên cứu “Khảo sát tình hình đề kháng kháng sinh của vi khuẩn gây mụn trứng cáPropionibacterium acnes tại thành phố Cần Thơ” của Phạm Thị Tường Vy (2017) được lưu trữ tại phòng thí nghiệm Vi sinh trường Đại học Tây Đô.
- Lá, vỏ thân, quả non, quả chín cây Trứng cá thu hái tại phường Thường Thạnh, quận Cái Răng, thành phố Cần Thơ vào tháng 12 năm 2016. Lá và vỏ thân Trứng cá rửa sạch, sấy khô, bảo quản ở nhiệt độ phòng trong túi nylon được xay nhỏ trước khi sử dụng cho nghiên cứu. Quả non, quả chín được rửa sạch, nhặt bỏ cuống, để ráo nước xay nhuyễn trước khi sử dụng cho nghiên cứu.
3.2.2. Dụng cụ và thiết bị thí nghiệm
Sử dụng các trang thiết bị hiện có tại Phòng thí nghiệm Vi sinh - Trường Đại học Tây Đô, Phòng thí nghiệm Dược liệu - Trường Đại học Tây Đô.
Các dụng cụ nuôi cấy vi khuẩn P. acnes: đĩa Petri, que cấy, tủ cấy vi sinh vật, nồi hấp khử trùng, cân điện tử Ohaus (Mỹ), tủ sấy, tủ ủ vi sinh vật, tủ đông giữa mẫu Hitachi (Nhật Bản), bộ micropipet, bếp điện, máy ly tâm, ống Eppendorf, bình hút ẩm.
Các dụng cụ thiết bị chiết mẫu: bếp điện, bình cầu, hệ thống sinh hàn, bếp đun cách thủy, cân phân tích Shimidzu (Nhật Bản), phễu hủy tinh, đũa thủy tinh, tủ lạnh bảo quản cao chiết, tủ sấy, cân hồng ngoại xác định độ ẩm.
Các thiết bị và dụng cụ khác: máy vi tính lưu trữ dữ liệu, máy chụp hình, kính hiển vi Olympus CX - 21 (Nhật Bản)….
3.2.3. Hóa chất và môi trường
3.2.3.1. Hóa chất
Ethanol 96 % (Trung Quốc), DMSO (Trung Quốc)
Hoá chất dùng nhuộm Gram vi khuẩn P. acnes : crystal violet, lugol, alcohol 95 %, safranine (Bộ nhuộm Gram công ty TNHH Nam Khoa, Việt Nam).
Hoá chất kiểm tra catalase: dung dịch oxy già (H2O2, 3 %). Thuốc thử Kovac’s dùng thử khả năng sinh indol (Mecrk).
Đĩa kháng sinh levofloxacin 5 g/ml (Công ty TNHH Nam Khoa, Việt Nam).
Hoá chất cần thiết khác
3.2.3.2. Môi trường phân lập vi khuẩn
Vi khuẩn P. acnes được nuôi cấy trong môi trường Trypticase - Yeast Extract - Heart Extract - Glycerol Agar (Kishisita, 1980).
Bảng 3.1. Công thức môi trường TYEG agar (Kishisita, 1980)
% | |
Trypticase | 1,5 |
Yeast extract | 0,5 |
Heart extract Nisui | 0,5 |
Glycerol | 1,0 |
NaCl | 0,2 |
K2HPO4 | 0,2 |
L-cystein-HCl | 0,03 |
Bromocresol purple | 0,002 |
Agar pH | 1,5 6,8 |
Có thể bạn quan tâm!
-
 Khảo sát khả năng ức chế vi khuẩn gây bệnh mụn trứng cá Propionibacterium acnes của cao chiết từ cây Trứng cá Muntingia calabura L. - 1
Khảo sát khả năng ức chế vi khuẩn gây bệnh mụn trứng cá Propionibacterium acnes của cao chiết từ cây Trứng cá Muntingia calabura L. - 1 -
 Khảo sát khả năng ức chế vi khuẩn gây bệnh mụn trứng cá Propionibacterium acnes của cao chiết từ cây Trứng cá Muntingia calabura L. - 2
Khảo sát khả năng ức chế vi khuẩn gây bệnh mụn trứng cá Propionibacterium acnes của cao chiết từ cây Trứng cá Muntingia calabura L. - 2 -
 Cơ Chế Gây Bệnh Trứng Cá Vi Khuẩn Propionibacterium Acnes
Cơ Chế Gây Bệnh Trứng Cá Vi Khuẩn Propionibacterium Acnes -
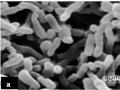
 Nuôi Cấy Và Nhận Diện Dòng Vi Khuẩn Propionibacterium Acnes
Nuôi Cấy Và Nhận Diện Dòng Vi Khuẩn Propionibacterium Acnes -
 Nuôi Cấy Và Nhận Diện Vi Khuẩn Propionibacterium Acnes
Nuôi Cấy Và Nhận Diện Vi Khuẩn Propionibacterium Acnes -
 Định Tính Một Số Hợp Chất Thiên Nhiên Trong Cao Chiết Từ Lá Trứng Cá
Định Tính Một Số Hợp Chất Thiên Nhiên Trong Cao Chiết Từ Lá Trứng Cá
Xem toàn bộ 89 trang tài liệu này.

- Môi trường Trypticase soyar broth dùng để kiểm tra khả năng sinh indol.
- Môi trường Trypticase soyar broth agar dùng để khảo sát hoạt tính kháng khuẩn và nồng độ ức chế tối thiểu.
- Môi trường pepton dùng để thử khả năng làm dịch hóa gelatin và khả năng phản nitrat hóa
3.3. PHƯƠNG PHÁP NGHIÊN CỨU
3.3.1. Thiết kế nghiên cứu
Phương pháp thực nghiệm khoa học
3.3.2. Cỡ mẫu
Tổng số 4 mẫu thực vật từ các bộ phận Trứng cá (Muntingia calabura L.): lá, vỏ thân, quả chín và quả non được sử dụng trong nghiên cứu.
3.3.3. Phương pháp chọn mẫu
Thu hái các bộ phận cây Trứng cá.
- Lá: chọn lá không quá già hay quá non, không bị sâu bệnh.
- Vỏ thân: chọn thân to không sâu bệnh và dùng dụng cụ bóc vỏ thân.
- Quả chín: chọn quả chín đỏ đều màu hái trực tiếp trên cây, không bị sâu bệnh
- Quả non: chọn quả non màu xanh lá hái trực tiếp trên cây, không bị sâu bệnh
3.3.4. Nội dung nghiên cứu
3.3.4.1. Phương pháp chiết
Phương pháp chiết xuất bao gồm cả việc chọn dung môi, dụng cụ chiết và kỹ thuật chiết. Một phương pháp chiết xuất thích hợp có thể được hoạch định một khi đã biết rõ thành phần hoá học của nguyên liệu, mỗi loại hợp chất có độ hoà tan khác nhau trong từng loại dung môi. Vì vậy không thể có một phương pháp chiết xuất chung áp dụng cho tất cả các hợp chất. Lựa chọn phương pháp chiết xuất có được cao toàn phần là công việc quan trọng để tránh phân huỷ hợp chất , tránh phản ứng phụ và các loại tạp sinh ra trong quá trình chiết.
Trong quá trình chiết các tiểu phân chất rắn chịu tác động của dung môi trong điều kiện khác nhau. Các chất tan hoà tan trong dung môi thành dung dịch và tạo nên dung dịch chiết, sự hoà tan này ít bị ảnh hưởng bởi các chất không tan. Trong quá trình chiết các chất từ các tổ chức sống (mô tế bào), các chất tan nằm bên trong các tế bào, cách biệt với bên ngoài bởi vách tế bào, vì thế các chất tan sau khi hoà tan thành dung dịch còn phải vượt qua vách tế bào ra khỏi mô để đi vào dịch chiết. Quá trình chiết các chất tan từ các tổ chức sinh học vì thế thường được gọi là quá trình “chiết xuất”. Nguyên liệu thực vật thường được chia nhỏ thành các tiểu phân có thể tiếp xúc với dung môi, trong khi các tế bào phía bên trong vẫn còn nguyên vẹn dung môi và chất tan phải đi qua vách tế bào. Vì thế, trong chiết xuất có 3 quá trình quan trọng đồng thời xảy ra là:
- Sự hoà tan
- Sự khuếch tán
- Sự thẩm thấu qua vách tế bào
Các quá trình này thực hiện liên tục cho đến khi quá trình chiết kết thúc. Nguyên liệu phải được xay nhỏ đến mức thích hợp để dung môi có điều kiện tiếp xúc trực tiếp với vách tế bào một cách dễ dàng, thúc đẩy quá trình chiết xuất nhanh chóng và nâng cao hiệu suất chiết. (Nguyễn Trọng Tuân, 2007).
- Phương pháp chiết nóng đun hồi lưu
Là phương pháp ngâm được thực hiện ở nhiệt độ cao kết hợp bộ phận gia nhiệt và hệ thống sinh hàn. Do được chiết ở nhiệt độ cao nên khả năng hòa tan các chất tan và dung môi thường là cao nhất và quá trình hòa tan xảy ra nhanh. Đun hồi lưu là sự chuyển chất trở lại môi trường thông qua hệ thống ngưng tụ. Thiết bị chiết đun hồi lưu gồm: Hệ thống sinh hàn, bình cầu, bếp điện
Ưu điểm: thiết bị đơn giản rẻ tiền, dễ thực hiện, phương pháp đơn giản
Nhược điểm: không chiết được lượng lớn mẫu cây, nên chỉ thích hợp nghiên