Đối với nhôm và crôm lớp ô xít xuất hiện rất nhanh nhưng lại rất bền vững, hầu như nó không phát triển thêm, do vậy nó lại có tác dụng bảo vệ quá trình ô xít hoá tiếp tục kim loại (đường cong c, hình 2.3).
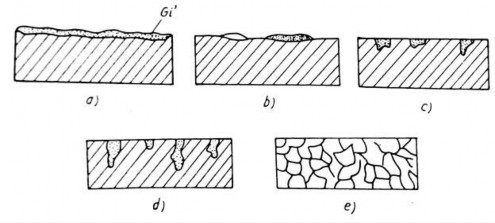
Hình 2.3. Sự gỉ theo thời gian
Những kim loại này có khả năng chống gỉ trong môi trường không khí rất tốt . Do vậy crôm là một thành phần bổ sung cơ sở cho các kim loại thép hợp kim cao, hợp kim chịu nhiệt. Nhôm và mangan cũng có những tác dụng có lợi như crôm. Riêng platin và vàng là những hợp kim loại có khả năng đặc biệt chống gỉ hoá học.
2.2.2 Gỉ điện hóa
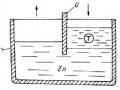
Gỉ điện hoá là loại gỉ phổ biến nhất, xảy ra khi kim loại tiếp xúc với chất điện phân. Trong quá trình gỉ, trên bề mặt kim loại xuất hiện những vi bin và phát sinh dòng điện. ví dụ: khi nhúng mẫu Zn vào trong dung dịch H 2SO4 loãng, ở đây sẽ thấy kẽm bị hoà tan và hydrô thoát ra theo phản ứng chung sau:
Zn + H2SO4= ZnSO4 + H2 (2.1)
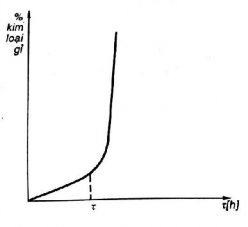
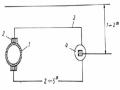
Trên cơ sở đó vẽ đường cong tốc độ gỉ (hình 2.4).
Hình 2.4. Tốc độ gỉ của Zn trong H2SO4
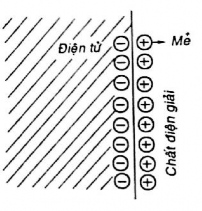
Hình 2.5. Lớp điện tích kép
Nếu xét theo cơ cấu gỉ hóa học thì không thể giải thích được như trên , tốc độ gỉ hoá
học thông thường tuân theo qui luật đường baraboon, logarit. Nhưng trong trường hợp này,
sau một thời gian nào đó, tốc độ gỉ tăng vọt lên. Thực chất của vấn đề này là trên bề mặt kim loại xuất hiện những vi bin là vì mạ kẽm đóng vai trò là anôt. Sở dĩ xuất hiện vi pin là vì điện thế trên bề mặt kim loại không đồng nhất.
1. Điện thế điện cực của kim loại
Khi kim loại tiếp xúc với chất điện giải sẽ xảy ra sự tác dụng giữa chất điện phân và kim loại. Ion kim loại sẽ chuyển vào dung dịch và để lại điện tử tự do trên kim loại. Trên giới hạn phân chia giữa hai pha sẽ xuất hiện lớp điện tích kép (hình 2.5).Một bên điện tích dương (do các ion kim loại) một bên là điện tích âm (do các điện tử). Trên giới hạn phân chia đó sẽ xuất hiện bước nhảy điện thế, gọi là điện thế điện cực kim loại. Muốn xác định điện cực kim loại phải so sánh nó với điện cực tiêu chuẩn (điện cực tiêu chuẩn là điện cực hydro, có áp suất hydro bằng 1atm, hoạt động của ion H+bằng 1 đơn vị )
Giá trị điện thế này trước tiên phụ thuộc tới kim loại điện cực trơ, đồng thời phục
thuộc tới chất điện giải: nếu số lượng ion kim loại càng nhiều trong chất điện phân thì sự thoát ra các ion kim loại tiếp theo vào chất điện phân càng khó. Với nồng độ của các i on kim loại tăng thì điện thế sẽ giảm và ngược lại , với nồng độ ion giảm thì điện thế sẽ tăng.
Giá trị điện thế được giảm theo phương trình của Nensitova :
E= Eo+
0,058 logC (2.2)
n
Ở đây : E - điện thế điện cực kim loại (V).
Eo- điện thế tiêu chuẩn của kim loại (V).
n - hoá trị ion của kim loại
C - Nồng độ ion của kim loại có mặt trong chất điện phân (mg/lít)
im loại | Kí hiệu hóa học và hóa trị | Điện thế chuẩn (V) |
Magiê | Mg++ | -1,55 |
Nhôm | Al+++ | -1,33 |
Kẽm | Zn++ | -0,76 |
Crôm | Cr++ | -0,56 |
Sắt | Fe++ | -0,44 |
Cadium | Cd++ | -0,40 |
Có thể bạn quan tâm!
-
 Gia Công Cơ Khí Sau Khi Phun Phủ, H Àn Đắp
Gia Công Cơ Khí Sau Khi Phun Phủ, H Àn Đắp -
 Phục Hồi Và Bảo Vệ Bề Mặt Kim Loại Bằng Phun
Phục Hồi Và Bảo Vệ Bề Mặt Kim Loại Bằng Phun -
 Sự Mòn Của Kim Loại Do Tác Dung Của Môi Trường Các Dòng Chảy
Sự Mòn Của Kim Loại Do Tác Dung Của Môi Trường Các Dòng Chảy -
 Khái Ni Ệm Chung Về Bảo Vệ Chống Gỉ
Khái Ni Ệm Chung Về Bảo Vệ Chống Gỉ -
 Hàn đắp và phun phủ - 16
Hàn đắp và phun phủ - 16 -
 Hàn đắp và phun phủ - 17
Hàn đắp và phun phủ - 17
Xem toàn bộ 143 trang tài liệu này.
Bảng 2.1. Điện thế chuẩn của một số kim loại.
Phương trình này có ý nghĩa khi nhiệt độ là 20 0C. Từ phương trình trên có thể thấy khi C=1 (tức là nồng độ đơn vị của ion kim loại) thì thành phần về bên phải của phương trình bằng 0, lúc đó được gọi là điện thế chuẩn. Đại lượng điện thế chuẩn có ý nghĩa thực tế, nó đặc trưng cho mỗi loại kim loại . Nếu phân chia kim loại theo điện thế chuẩn thì sẽ có thứ tự điện thế của một số kim loại như bảng 2.1.
Theo thứ tự bảng trên có thể nhận xét rằng khuynh hướng phát triển gỉ của các
kim loại sẽ như sau:
Kim loại với điện thế tiêu chuẩn âm lớn, ví dụ, sắt, kẽm, ... bị gỉ tương đối dễ và gọi là kim loại kém bền vững. Ngược lại, ở những kim loại với điện thế chuẩn dương như vàng sẽ không gỉ và được gọi là kim loại bền vững. Đối với kim loại có điện thế dương gần giá trị không, sự gỉ xảy ra chậm (như thiếc, chì )
2. Cơ cấu gỉ điện hoá
Đây là quá trình hòa tan kim loại khi những kim loại vào chất điệ n giải. Quá trình này phức tạp và có thể chia làm 2 quá trình sau :
Quá trình anốt
Là quá trình ôxy hoá, trong trường hợp gỉ là quá trình hoà tan kim loại, chuyển ion
kim loại vào dung dịch và để lại các điện từ thừa tương ứng :
Me +n H2O Me+nH2O + e (2.3)
Quá trình catốt
Là quá trình khử các điện tử thừa bời ion, nguyên tử hay phân tử của chất điện giải: D + e De
Nếu quá trình catốt không tiến hành song song với qu á trình anốt thì quá trình ăn mòn sẽ đình chỉ. Phù hợp với lý thuyết ăn mòn điện hoá, kim loại sẽ chia ra những vùng anốt và những vùng catốt , chúng xen kẽ nhau và sẽ sát bên nhau.
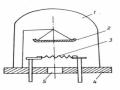
Quá trình ăn mòn là quá trình làm việc của những vi pin đó. Hình 2.6 là sơ đồ
có tính chất nguyên lý làm việc của pin .
Phần anốt kim loại sẽ hoà tan, phần catốt sẽ tiến hành quá trình khử . Khi tiến hành hai quá trình thì điện tử anốt chuyển về catốt và cation chuyền từ vùng catốt đến vùng anốt .
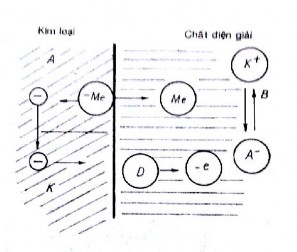
Hình 2.6. Sơ đồ nguyên lý làm vi ệc của pin
Tóm lại, quá trình gỉ điện hoá tiến hành trên những vùng khác nhau, do quá trình làm viêc của vipin mà trong đó vianốt có điện thế âm hơn so với vicatốt .
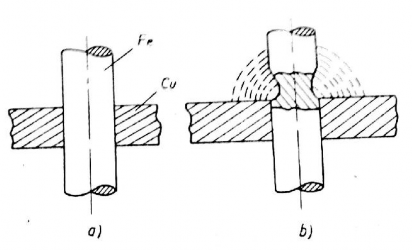
Hình 2.7. Quá trình gỉ pin sắt – đồng a, trước khi gỉ b, khi gỉ
Hình 2.7 là quá trình gỉ của pin gỉ sắt và đồng xảy ra trong môi trường lỏng. Ở đây sắt được tiếp xúc với đồng, s ắt bị gỉ và trở thành cực dương . Các điện tử đi ra từ sắt vào đồng. Trong trường hợp này đồng đóng vai trò như cực âm, trên bề mặt của chúng xuất hiện các bọt khí hiđrô. Đồng trong trường hợp này hầu như không thay đổi . Toàn bộ hệ thống này đóng vai trò như một bộ pin hoá học xảy ra rất ngắn ngủi trong mạch điện của pin này: các điện tử chuyển qua từ các kim loại (sắt đồng) bằng điện giải, đồng thời sự chạy qua của các điện tích sẽ tìm kiếm các ion cũng bằng môi trường điện giải . Từ những lý do đó, quá trình gỉ trong trường hợp này có thể nói như sau: hai kim loại có điện thế chuẩn khác nhau sẽ làm xuất hiện một hiệu điện thế (điện thế chuẩn của kim loại xem bảng 2.1). Ở đây hiệu điện thế của đồng và sắt là +0,34 - (-0,44)=0,78 vôn. Sự gỉ mãnh liệt nhất của sắt trong trường hợp này là khi hai kim loại gần nhất tiếp xúc, khi ấy dòng điện có đường đi ngắn nhất và ở vị trí vậy trở lực sẽ nhỏ nhất, khi đó sẽ cho dòng điện pin là lớn nhất. Như vậy , với kết cấu vị trí trên (hình 2.7) sẽ thiếu sót về kết cấu mà chúng ta cần khắc phục. Một vị trí khác về kim loại gỉ điện hoá: tấm thép được phủ b ằng lớp bảo vệ kẽm hoặc thiếc (hình 2.8)
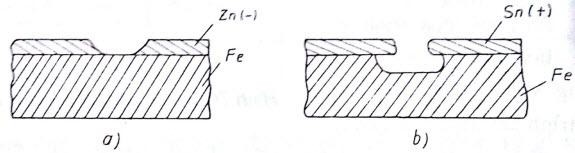
Hình 2.8. Pin gỉ điện hóa
a, lớp bảo vệ kẽm b, lớp bảo vệ thiếc
Lớp bảo vệ kẽm hoặc thiếc, trong thực tế các khuyết tật (các lỗ rỗ) do vậy ở những
vị trí lỗ rỗ không có lớp bảo vệ, sắt tiếp xúc trực tiếp với môi trường . Do vậy khi lớp bảo vệ
là kẽm thì kẽm là kim loại có tính kém bền vững hơn sắt, sẽ đóng vai trò cực dương do đó sẽ bị gỉ, còn sắt đóng vai trò cực âm dó đó không bị gỉ. Ngược lại ở những lớp phủ thiếc (Sn) thiếc là kim loại có tính bền vững hơn thép, khi đó thiếc đóng vai trò cực âm và sắt là cực dương do vậy ở những vị trí sắt tiếp xúc với môi trường, sắt sẽ bị gỉ. Bởi vậy đối với lớp phủ thiếc yêu cầu phải khắt khe hơn lớp phủ kẽm, có nghĩa là yêu cầu không có khuyết tật rỗ, trường hợp có khuyết tật, sắt sẽ bị gỉ mãnh liệt hơn khi không có một lớp phủ thiếc.
Ngoài sự gỉ vi mô trên, thực tế còn có các pin gỉ vi mô được hình thành do c ác tạp chất chứa trong kim loại. Do vậy ta có thể thấy rằng các kim loại sạch, (tinh khiết) có khả năng chống gỉ tốt hơn là các kim loại có lẫn tạp chất .
Các phương pháp gia công hoặc chế tạo phôi (như gia công áp lực, hàn…) thường gây ra những khuyết tật, mà những khuyết tật đó là nguyên nhân gây ra sự gỉ điểm.
Sự phân cực và sự khử phân cực
Sự phân cực.
A
Khi nhúng hai thanh kim loại khác nhau trong dung dịch điện giải (ví dụ, hai cực đồng, kẽm nhúng vào trong dung dịch NaCl). Hiệu số điện thế giữa anốt và catốt tạo nên dòng điện. Cường độ dòng điện đặc trưng cho tốc độ ăn mòn. Khi để hở mạch điện thì điện thế cực dương hơn (Vk) là điện cực đồng. Điện thế điện cực âm hơn (V 0 ) là điện cực kẽm.
K
Khi V 0
> V 0
giá trị của dòng điện ban đầu được xác định theo định luật ôm :
A
Ibh= VK VA
R
(2.9)
0 0
V K - V A = U - Sức điện động qua pin
R - Điện trở
Nếu R nhỏ thì Ibh lớn và giảm rất nhanh, đến lúc nào đó sẽ thiết lập sự cân bằng .
Dòng điện lúc đó là I và I<
K
Vì R không đổi theo thời gian nên I giảm chỉ có thể do (V 0
- V 0
) giảm, nghĩa là
A
giá trị VK giảm đến Vk và VA tăng đến Va .
I= VK VA
R
(2.10)
Các hiệu số VA - Va = VA - đại lượng phân cực anốt
VK – Vk = Vk - đại lượng phân cực catốt
(Vk- VA ) – ( Vk – V a) = V - đại lượng phân cực của pin
Vậy phân cực anốt là sự chuyển điện thế anốt về phía dương hơn khi có dòng điện anốt.
Phân cực catốt là sự chuyển điện thế catốt về phía âm hơn khi có dòng điện catốt.
Tóm lại ta có thể biểu diễn sự phân cực như sau: sự khác nhau ban đầu của điện thế giữa cực âm và cực dương sẽ gi ảm dần và chúng sẽ gần lại nhau. Điều đó có thể biểu thị ở trên sơ đồ hình 2.9 - đường cong phân cực.
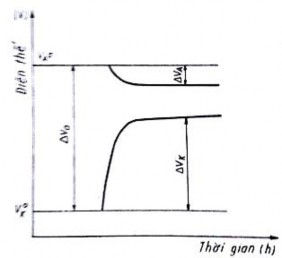
Hình 2.9. Đường cong phân cực
Ở Việt Nam hiện nay để xác định đường cong phân cực của lớp phủ thường dùng thiết bị AUTOLAB với phần mềm GPESX EcoChemie BV – Hà Lan.
Trên sơ đồ ta thấy phía trên cực trục tu ng biểu thị giá trị điện thế âm. Giá trị Vo biểu thị giá trị khác nhau ban đầu của điện thế giữa cực âm và cực dương, VK biểu thị điện thế phân cực của điện cực âm (giá trị này biểu thị rằng : cực âm luôn luôn là giá trị âm lớn hơn).
VA là điện thế phân của cực dương (biểu thị rằng cực dương luôn luôn là giá trị âm nhỏ hơn). Sự khác nhau về điện thế sẽ làm giảm sự phân cực của cực dương cũng như cực âm. Như vậy tốc độ gỉ cũng như dòng gỉ cũng sẽ giảm đi.
b. Sự khử phân cực
Hiện tượng tác dụng ngược lại với hiện tượng t rên chúng ta gọi là sự khử cực. Sự khử cực sẽ phá vỡ sự phân cực (bao gồm cả cực dương và cực âm). Sự khử phân cực l à một hiện tượng rất quan trọng , vì nó tạo khả năng cho quá trình gỉ kéo dài .
3. Tính thụ động của kim loại.
Theo bảng 2.1 chúng ta thấy một hiện tượng là : với một kim loại nào đó có điện thế chuẩn âm lớn đáng kể nào đó, kim loại đó chưa phải là bị gỉ một cách mãnh liệt như chúng ta đã nói ở trên . Có thể lấy ví dụ như nhôm là kim loại kém bền vững (có điện thế 1,33) nhưng nếu ở môi trường khí quyển thì lại là một kim loại có khả năng chống gỉ tốt. Điều đó có thể rằng trên bề mặt của nhôm đã tạo ra một lớp màng bảo vệ bề mặt của nó (lớp ô xít nhôm Al2O3), lớp này có tác dụng bảo vệ sự gỉ tiếp tục- lớp này gọi là màng thụ động. Như vậy chúng ta có thể nói rằng: tính thụ động của kim loại kém bền vững là khả
năng chống gỉ tốt của nó trong môi trường nhất đị nh nhờ tạo ra một màng bảo vệ (màng thụ động).
Tính thụ động là một đặc trưng của trạng thái bề mặt của kim loại kém bền vững và biểu hiện khả năng chống gỉ lớn trong môi trường hiện hành.
Trên cơ sở hình thành lớp thụ động cho nên các loại thép crôm, thép crôm-niken có khả năng chống gỉ rất tốt trong nhiều môi trường .
2. Các chất hãm
Các chất hoá học thông thường đều có khả năng có mặt trong môi trường gỉ, khi chúng thâm nhập vào sẽ làm giảm hoặc tăng tốc độ gỉ của kim loại. Những chất có tác dụng làm giảm tốc độ gỉ chúng ta gọi là các chất hãm (inhibitor). Các chất hãm cho thêm vào môi trường gỉ một số lượng không đá ng kể( khoảng 1/100 1/1000). Đối với thép không gỉ, người ta sử dụng crôm như là chất hãm ở môi trường âm. Khi đó crôm có tác dụng tạo nên một lớp thụ động trên bề mặt của thép. Lớp ô xít mỏng này (bao gồm cả sắt và crôm) sẽ không hoà tan.
Ngoài ra còn các loại chất hãm bốc hơi làm cơ sở cho việc bảo vệ tạm th ời các sản phẩm thép khỏi bị gỉ. Ví dụ như dùng chất hãm bốc hơi dicyclohexylamine viết tắt là DCN là loại chất kết tinh, loại chất này bốc hơi chậm bởi sẽ hấp thụ trên bề mặt của thép và tạo ra một lớp rất mỏng khi tiếp xúc với nước có trong không khí, chất hãm sẽ thủy phân và tạo ra lớp thụ động trên bề mặt kim loại.
Người ta sử dụng các chất hãm bốc hơi chủ yếu để bọc các sản ph ẩm bằng thép cho việc xuất khẩu. Các sản phẩm được bọc bằng một loại giấy đặc biệt, trên đó được quét bằng một lớp DCN. Lớp DCN bảo vệ tốt sẽ có tác dụng sau vài năm. DCN rất thích hợp với việc bảo vệ các vật ở kho, nhưng loại này lại không thích hợp với các kim loại không phải là sắt , vì nó có thể gây gỉ xấu hơn .
2.2.3 Gỉ trong môi trường khí quyển
Gỉ trong môi trườ ng khí quyển là loại thường gặp : khoảng 80% thiết bị bằng kim loại làm việc trong điều kiện khí quyển, tốc độ ăn mòn trong khí quyển không kém tốc độ ăn mòn trong đất và trong nước. Cho nên khoảng 50% lượng kim loại hao tổn do ăn mòn trong khí quyển. Vì vậy vấn đề gỉ trong môi trường khí quyển có ý nghĩa kinh tế rất lớn .
Đặc trưng cơ bản của kim loại gỉ này là trên bề mặ t kim loại có một lớp nước mỏng (gọi là màng nước) màng nước này rất dễ tạo nên trên bề mặt kim loại do sự hấp thụ hơi nước từ trong môi trường khí quyển.
Trên những bề mặt sạch và nhẵn lý tưởng , lớp nước này cũng có thể tạo ra , khi độ ẩm tương đối của không khí đạt tới 100%, nghĩa là ở nhiệt độ điểm sươn g.
Những bề mặt thực tế là những b ề mặt không phẳng và không nhẵn, chúng có lượn
sóng và có độ nhấp nhô tế vi, bởi vậy trên bề mặt này dễ dàng tạo ra màng nước. Chỉ cần
trong một độ ẩm tương (gọi là độ ẩm tương đối với giới hạn chuẩn, giá trị này thường khoảng 60%) thì lớp màng nước đã hình thành và ở độ ẩm tương đối giới hạn này tốc độ gỉ xảy ra rất mạnh.
Độ ẩm tương đối giới hạn đối với các kim loại có giá trị khác nhau. Trong khí quyển có chứa nhiều chất bẩn thì độ ẩm tương đối cũng thấp đi.
Ví dụ, do sự có mặt của hơi HCl mà độ ẩm tương đối gi ới hạn đối với thép hoặc
kẽm sẽ nhỏ hơn 10%.
Trong các màng nước mỏng đó đều có các khí hoà tan như CO, SO2… sẽ làm cho tốc độ gỉ tăng nhanh, các chất bụi bẩn cũng gây ra sự phá hủy do gỉ, vì các bụi này bám trên bề mặt và tạo ra sự nhấp nhô, như vậy dễ dàng tạo ra các màng nước. Nếu các bụi bẩn là các phần tử than (ở môi trường khí quyển công nghiệp) chúng sẽ đẩy mạnh tốc độ gỉ.
Gỉ trong khí quyển có thể chia làm 3 loại chính như sau :
a. Gỉ trong không khí ướt
Loại gỉ này xảy ra khi ngưng tụ không khí ẩm thành màng nước mỏng trên bề mặt kim loại, có thể trông thấy được khi độ ẩm cao(độ ẩm không khí gần 100%). Dạng gỉ này thường gặp khi trời mưa hay nước trực tiếp bắn lên trên kim loại .
b. Gỉ trong không khí ẩm
Gỉ trong không khí ẩm xảy ra khi nhiệt độ ẩm tương đối bé (nhỏ hơn 100%). Sự gỉ này xuất hiện dưới lớp nước mỏng d o hấp thụ mao quản hay ngưng tụ , lớp nước này quá mỏng, mắt ta không trông thấy được .
c. Gỉ trong không khí khô
Loại gỉ này hoàn toàn không có lớp ẩm trên bề mặt kim loại .
Trong thực tế dạng ăn mòn này có thể chuyển hoá thành dạng ăn mòn khác rất khó phân biệt. Khi xét về cơ cấu của ba loại trên người ta thấy chúng có những đặc điểm rất khác nhau.
Cơ cấu gỉ trong không khí ướt có thể nói gi ống như gỉ trong chất điện giải. Đó là sự
làm việc của những vi pin.
Ngược lại loại gỉ trong không khí khô, lại là dạng gỉ hoá học đơn thuần . Cơ cấu gỉ của chúng giống như cơ cấu gỉ hoá học nhưng vì nhiệt độ t hấp nên tốc độ gỉ không đáng kể. Ví dụ: Ở sắt chiều dày màng gỉ thông thường khoảng 30 40 m
Đối với gỉ trong không khí ẩm là dạng gỉ phổ biến nhất, đặc điểm gỉ là trên bề mặt của kim loại có màng nước mỏng mà mắt ta không nhìn thấy được . Màng mỏng này hình thành là do các nguyên nhân sau:
- Do hiện tượng ngưn g tụ mao quản. Khả năng ngưng tụ mao quản trên bề mặt phụ
thuộc vào dạng bề mặt (lồi lòm ) và áp suất hơi bão hoà trên các bề mặt.
Phương trình xác định khả năng ngưng tụ mao quản: