thời gian nạp khoảng 15 giờ cho ăc quy đã phóng cạn.
Nạp nhanh (từ 4 đến 5 giờ). Ăc quy Ni-MH có thể nạp điện hiệu quả và an toàn với tốc độ cao. Quá trình nạp này đòi hỏi theo dõi để ngừng nạp khi áp suất khí trong ăc quy tăng cao hoặc khi nhiệt độ tăng lên quá mức cho phép. Ăc quy có thể nạp đầy với tốc độ 0,3C trong thời gian 4,5 giờ đến 5 giờ (điện lượng nạp đạt đến 150% dung lượng danh định). Bên cạnh yếu tố thời gian, cần có rơ le nhiệt để ngắt quá trình nạp khi nhiệt độ tăng lên đến 60oC.
Nạp siêu nhanh (1 giờ). Ăc quy Ni-MH còn được nạp với tốc độ rất cao, dòng nạp bằng 0,5C đến 1C, thời gian nạp từ 0,5 giờ đến 1 giờ. Khi nạp ở chế độ này cần chú ý kết thúc trước thời điểm nạp đầy ăc quy theo tính toán.
Chế độ nạp 3 bước. Là chế độ nạp tiên tiến nhất hiện nay, cho tốc độ nạp nhanh, không bị nạp quá, không gây cháy nổ, không sinh nhiệt độ cao.
Bước 1, nạp với tốc độ 1C, điều khiển bằng cách theo dõi sự tăng nhiệt độ hoặc tăng điện áp.
Bước 2, nạp với chế độ 0,1C trong 30 phút đến 1 giờ.
Bước 3, nạp bảo dưỡng với dòng nạp trong khoảng 0,02C đến 0,05C, nhiệt độ không vượt quá 60oC
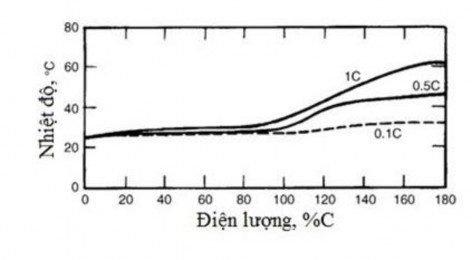
Hình 1.5. Biến thiên nhiệt độ theo điện lượng và tốc độ nạp điện [68]
1.1.5. Đặc trưng phóng điện
Tốc độ phóng điện, là cường độ dòng điện phóng có giá trị bằng dung lượng danh định C chia cho thời gian (tính bằng giờ), và nhiệt độ có ảnh hưởng lớn đến khả năng phóng điện của ăc quy (hình 1.6). Nhiệt độ môi trường cao cho phép tốc độ phóng điện lớn. Khi phóng điện với tốc độ 0,2C ăc quy có thể làm việc trong khoảng nhiệt độ từ -20oC đến 50oC, dung lượng phóng điện thực tế đạt được trên 90%. Khi nhiệt độ trong khoảng từ 20oC đến 50oC, ăc quy có thể phóng với tốc độ lên đến 3C.
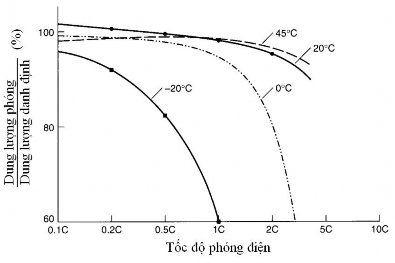
a 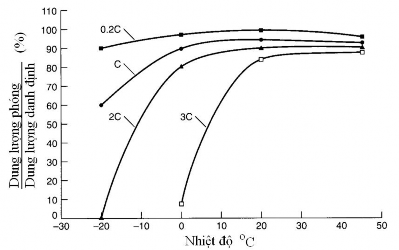 b
b
Hình 1.6. Ảnh hưởng của tốc độ phóng điện (a) và nhiệt độ (b) đến dung lượng phóng điện của ăc quy Ni-MH [68].
1.1.6. Hiện tượng nạp quá và phóng quá
Để đảm bảo an toàn, chống cháy nổ ăc quy và các thiết bị sử dụng ăc quy, điện cực âm luôn được thiết kế có dung lượng lớn hơn điện cực dương (hình 1.4). Do vậy sự nạp quá hay sự phóng quá chỉ có thể xảy ra trên điện cực dương.
Sự nạp quá xảy ra khi toàn bộ Ni(OH)2 bị ôxy hoá thành NiOOH, quá trình nạp điện sau đó không phải làm tăng dung lượng mà chỉ để giải phóng ôxy theo phương trình phản ứng sau:
4OH- - 4e → 2H2O + O2 (1.4)
Khí O2 sinh ra làm tăng áp suất riêng phần của nó trong hệ. Tuy nhiên O2 có thể khuếch tán sang điện cực âm và phản ứng với hyđrô.
O2 + 2H2 → 2H2O (1.5)
làm tiêu hao lượng hyđrô hấp thụ tại cực âm và tổn thất điện năng trong quá trình nạp. Như vậy lượng ôxy được khử và áp suất trong hệ được cân bằng trở lại. Toàn bộ điện năng cung cấp cho ăc quy sẽ chuyển hóa thành nhiệt năng làm hệ nóng lên.
Nhiệt độ tăng cao do nạp quá làm điện thế điện cực Ni giảm về phía âm, đồng thời ảnh hưởng xấu tới một số đặc tính khác như xảy ra quá trình ăn mòn và phá hủy điện cực, giảm độ bền nhiệt động, thậm chí làm mất tính chất hấp thụ thuận nghịch hyđrô của hợp chất LaNi5.
Sự phóng quá xảy ra tại điện cực dương, H2O bị khử thành H2: 2H2O + 2e- → 2OH- + H2 (1.6)
và H2 có thể bị chuyển thành H2O tại điện cực âm:
2OH- + H2 - 2e-→ 2H2O (1.7)
Quá phóng gây hại tương tự như khi nạp quá, làm thế điện cực dương giảm mạnh về phía âm, cấu trúc lục lăng của hợp kim LaNi5 bị thay đổi, chúng trở nên xốp, mất hẳn tính hấp thụ thuận nghịch hyđrô.
1.1.7. Đặc tính tự phóng
Trong quá trình bảo quản, cả hai điện cực đều bị tiêu hao hoạt chất, dung lượng của ăc quy bị suy giảm. Trên cực dương, NiOOH bị phân hủy theo phương trình phản ứng sau:
4NiOOH + 2H2O 4Ni(OH)2 + O2 (1.8)
Khí ôxy tạo thành có thể khuếch tán sang điện cực MH, tại đây bị khử bởi hyđrô trở thành ion OH-. Dung lượng của điện cực MH giảm ứng với lượng hyđrua tiêu hao trên điện cực, theo phản ứng:
4MH + O2 4M + 2H2O (1.9)
Như vậy dung lượng của cả hai điện cực Ni(OH)2 và MH đều bị giảm trong suốt quá trình tự phóng với việc hình thành ôxy và khử hyđrô.
Quá trình tự phóng cũng có thể bắt đầu từ cực âm khi một phần vật liệu MH bị phân hủy sinh ra hyđrô theo phản ứng:
2MH 2M + H2 (1.10)
Khí hyđrô khuếch tán sang điện cực dương và bị ô xy hóa bởi NiOOH, đồng thời NiOOH bị khử theo phản ứng:
H2+ 2NiOOH 2Ni(OH)2 (1.11)
Các quá trình trên chịu ảnh hưởng mạnh bởi áp suất hyđrô cục bộ trong ăc quy. Chính vì vậy việc điều chỉnh áp suất riêng phần thích hợp của H2 cũng như tái tiêu thụ ôxy thoát ra là những giải pháp thiết kế quan trọng trong nguyên lý làm việc của ăc quy Ni -MH.
Nhiệt độ càng cao thì sự khuếch tán của pha khí càng mạnh, tốc độ tự phóng càng lớn. Ở nhiệt độ phòng, tốc độ tự phóng khoảng 1% dung lượng trên ngày.
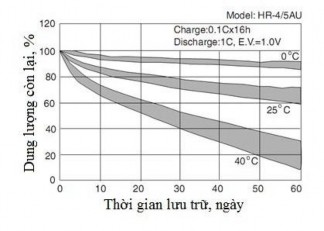
Hình 1.7. Đặc tính tự phóng của ăc quy Ni-MH [68]
1.2. Hợp kim hấp thụ hyđrô gốc LaNi5
Hợp kim LaNi5 được nghiên cứu từ nhiều thập kỷ qua, nhằm ứng dụng những tính chất ưu việt của chúng, trong đó nổi bật là khả năng tích thoát hyđrô thuận nghịch ở nhiệt độ phòng. Tính chất này của hợp kim đã được khai thác để chế tạo điện cực âm cho ăc quy Ni-MH.
1.2.1. Cấu trúc tinh thể của hợp kim LaNi5
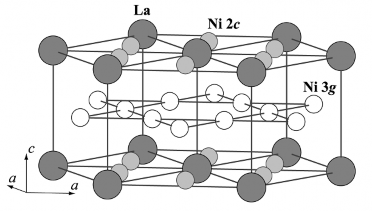
Hình 1.8. Cấu trúc mạng tinh thể của hợp kim LaNi5 [77]
Hợp kim LaNi5 có cấu trúc tinh thể mạng lục giác kiểu CaCu5. Cấu trúc này có thể coi như sự sắp xếp xen kẽ của hai lớp nguyên tử khác nhau. Lớp thứ nhất (z = 0) gồm hai loại nguyên tử với tỷ lệ La:Ni =1:2, nguyên tử La nằm tại vị trí giữa và các đỉnh của mặt lục giác, các nguyên tử Ni nằm ở các vị trí 2c. Lớp thứ hai (z = 1/2) chỉ gồm các nguyên tử Ni nằm ở đỉnh của hình lục giác lệch so với lớp thứ nhất góc 300, vị trí 3g [88] như hình 1.8
1.2.2. Khả năng hấp thụ thuận nghịch hyđrô
Sự hấp thụ hyđrô của hợp kim LaNi5 từ pha khí hay từ phản ứng điện hóa diễn ra tương tự nhau, được mô tả trên hình 1.9. Cơ chế hấp thụ hyđrô từ pha khí diễn ra theo hai bước, khi tiếp xúc với hợp kim LaNi5 các phân tử hyđrô hấp phụ lên bề mặt vật liệu (H2s) phân ly thành hai nguyên tử hyđrô hấp phụ Had (hình 1.9.a). Tiếp theo nguyên tử Had khuếch tán đi sâu vào tinh thể hợp kim và chuyển sang trạng thái hấp thụ Hab hình thành hợp chất hyđrua.
Khí hyđrô
H2
2Had
Hợp kim LaNi5
Khuếch tán
2Hab
(a)
Dung dịch KOH
H2O + e
OH- + Had
Hợp kim LaNi5
Khuếch tán
Hab
(b)
Hình 1.9. Sự hình thành hyđrua từ pha khí (a) và từ phản ứng điện hóa (b) [77]
Hấp thụ hyđrô từ phản ứng điện hóa như sơ đồ hình 1.9.b. Phản ứng tạo
thành hyđrua diễn ra theo nhiều giai đoạn như sau:
1. Vận chuyển chất phản ứng, H2O, từ trong dung dịch điện li đến bề mặt điện cực là hợp kim LaNi5 (được kí hiệu là M)
M + H2Ob M(H2O)s (1.12)
2. Quá trình trao đổi điện tích tạo thành hyđrô hấp phụ Had diễn ra trên bề mặt điện cực. ka
M(H2O)s + e- MHad+ OH-(s) (1.13)
kc
Trong đó ka và kc là hằng số tốc độ của phản ứng.
3. Nguyên tử Had khuếch tán vào khối (hạt) hợp kim LaNi5 thành dạng
hyđrô hấp thụ (Hab) và hình thành hợp chất hyđrua MH.
MHad MHab MH (1.14)
4. Khuếch tán vận chuyển ion OH- vào dung dịch điện ly.
(s) (b)
OH- OH- (1.15)
5. Tùy thuộc vào thành phần hợp kim và nồng độ hyđrô trong hợp kim mà có sự hình thành và chuyển pha hyđrua.
MH () MH ( ) (1.16)
6. Hai nguyên tử Had có thể kết hợp với nhau tạo thành khí hyđrô thoát ra trên bề mặt điện cực (bề mặt hạt hợp kim).
2MHad H2(g) + 2M (1.17)
Tốc độ phản ứng điện hoá tạo thành hyđrua phụ thuộc vào giai đoạn chậm nhất trong các bước từ 1 đến 5 trên đây. Quá trình 6 là một phản ứng phụ không mong muốn, tiêu tốn năng lượng, tạo áp suất cao dẫn đến phá huỷ vật liệu. Khi phản ứng bị khống chế bởi khuếch tán, các giai đoạn 1, 3, 4, 5 xảy ra với tốc độ chậm. Sự khuếch tán H2O từ dung dịch tới bề mặt điện cực và OH- vào trong dung dịch có thể điều chỉnh bằng cách tăng lượng nước trong dung dịch điện ly. Ngược lại, sự khuếch tán Had vào khối hợp kim xảy ra rất chậm, bước 3, 5, gây ra sự trễ, do đó ảnh hưởng tới tốc độ phóng nạp của điện cực. Sự khuếch tán chậm này làm cho quá trình 6 có cơ hội xảy ra. Có thể tăng tốc độ khuếch tán bằng cách giảm kích thước hạt, tăng diện tích bề mặt của vật liệu điện cực, khi đó dung lượng hấp thụ hyđrô của vật liệu cũng được tăng lên, đây là một trong các mục tiêu nghiên cứu của đề tài.
1.2.3. Vai trò của các nguyên tố thành phần trong hợp kim.
Quá trình hấp thụ hyđrô làm thể tích mạng tinh thể hợp kim LaNi5 tăng đến 25% (khi hấp thụ bão hòa). Chính sự dãn nở này là một trong những
nguyên nhân dẫn tới phá hủy vật liệu. Điều này ảnh hưởng lớn tới việc ứng
dụng hợp kim gốc LaNi5. Các nghiên cứu thay thế một phần La và Ni bởi các nguyên tố khác nhằm khắc phục sự giãn nở, nâng cao dung lượng hấp thụ, nâng cao tuổi thọ, nâng cao tốc độ phóng nạp, hạ giá thành sản phẩm... đang được tiến hành.
Hợp kim LaNi5 khi được thay thế một phần La hay Ni bằng các nguyên tố khác như Co, Mn, Fe, Al,... sẽ tạo thành hợp chất dạng La1-xRxNi5 hoặc LaNi5-xMx (R là nguyên tố đất hiếm, M là kim loại chuyển tiếp). Khi đó các hợp chất liên kim loại La1-xRxNi5 hoặc LaNi5-xMx cũng có kiểu mạng tinh thể tương tự LaNi5. Do tính chất của các nguyên tố đất hiếm rất giống nhau nên dung dịch rắn La1-xRxNi5 tồn tại với mọi nồng độ, trong khi đó sự thay thế nguyên tử Ni lại có giới hạn (bảng 1.2).
Bảng 1.2. Giới hạn trên của một số nguyên tố thay thế Ni [77]
Giới hạn | |
Si | 0,6 |
Fe | 1,2 |
Al | 1,3 |
Mn | 2,2 |
Cu, Co, Pt | 5 |
Có thể bạn quan tâm!
-
 Chế tạo hợp kim gốc lani5 làm vật liệu điện cực âm độ bền cao để sử dụng trong ăcquy ni-mh - 1
Chế tạo hợp kim gốc lani5 làm vật liệu điện cực âm độ bền cao để sử dụng trong ăcquy ni-mh - 1 -
 Chế tạo hợp kim gốc lani5 làm vật liệu điện cực âm độ bền cao để sử dụng trong ăcquy ni-mh - 2
Chế tạo hợp kim gốc lani5 làm vật liệu điện cực âm độ bền cao để sử dụng trong ăcquy ni-mh - 2 -
![Ảnh Sem Bề Mặt Mẫu Lani 2,49 Al 1,98 Mn 0,49 Co 0,08 Chưa Phóng Nạp (A), Và Phóng Nạp 200 Chu Kỳ Cv (B) [15]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Ảnh Sem Bề Mặt Mẫu Lani 2,49 Al 1,98 Mn 0,49 Co 0,08 Chưa Phóng Nạp (A), Và Phóng Nạp 200 Chu Kỳ Cv (B) [15]
Ảnh Sem Bề Mặt Mẫu Lani 2,49 Al 1,98 Mn 0,49 Co 0,08 Chưa Phóng Nạp (A), Và Phóng Nạp 200 Chu Kỳ Cv (B) [15] -
 Nguyên Lý Máy Nhiễu Xạ Tia X 4 Vòng Tròn Và Thiết Bị D8 – Advance
Nguyên Lý Máy Nhiễu Xạ Tia X 4 Vòng Tròn Và Thiết Bị D8 – Advance -
 Tổng Trở Của Quá Trình Điện Cực Nhiều Giai Đoạn
Tổng Trở Của Quá Trình Điện Cực Nhiều Giai Đoạn
Xem toàn bộ 104 trang tài liệu này.
Tỷ lệ thay thế phụ thuộc vào sự tương đồng về kích thước nguyên tử, cấu trúc vỏ điện tử và phụ thuộc vào quy trình chế tạo. Những nghiên cứu bằng phương pháp nhiễu xạ nơtron cho thấy sự thay thế các nguyên tử Ni bởi Al và Si trong hợp chất LaNi5-xMx chỉ có thể xảy ra tại vị trí 3g, trong khi với các nguyên tố khác như Co, Mn, Fe có thể xảy ra ở vị trí 2c, mặt z = 1/2 có mật độ nguyên tử thấp.
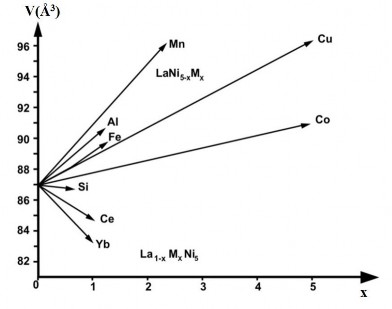
Hình 1.10. Ảnh hưởng của các nguyên tố thay thế đến thể tích ô mạng cơ sở [77]
Một số nguyên tố thay thế có ảnh hưởng rõ rệt đến hằng số mạng tinh thể của hợp kim, nhưng ở mức độ rất khác nhau (hình 1.10).
Khả năng hấp thụ hyđrô tạo thành LaNi5Hy phụ thuộc chủ yếu vào kiểu mạng tinh thể và thành phần nguyên tố thay thế Ni. Khi thay thế Ni bởi Al, y giảm từ 6,2 trong LaNi4,9Al0,1 xuống 4,8 trong LaNi4Al. Khi thay thế Ni bởi Mn, y gần như không đổi (y ≈ 6) với mọi giá trị 0 < x < 2 [63]. Ngược lại, hàm lượng hyđrô trong vật liệu ít bị ảnh hưởng khi thay thế bởi các nguyên tố đất hiếm. Theo nghiên cứu của Wahmal và cộng sự [67], giá trị y = 6,2 ở 40oC đối với hợp kim La0,8 R0,2Ni5 (R = Nd, Er, Y...).
Ảnh hưởng của các nguyên tố đến khả năng phóng điện của hợp kim LaNi4,5M0,5 trong đó M là Fe, Co, Mn đã được nghiên cứu [52, 53, 85], kết quả cho thấy khả năng phóng điện giảm dần theo thứ tự LaNi5, LaNi4,5Fe0,5, LaNi4,5Co0,5, LaNi4,5Mn0,5. Giá trị của điện trở chuyển điện tích (Rct) tăng theo thứ tự sau LaNi5, LaNi4,5Fe0,5, LaNi4,5Co0,5, LaNi4,5Mn0,5.
Đã có nhiều nghiên cứu về vai trò của coban được công bố [3, 18, 30,
50]. Các công trình này đều chỉ ra rằng coban có mặt trong thành phần hợp kim LaNi5 làm giảm sự ăn mòn, tăng sự ổn định điện hoá và tăng thời gian sống của ăc quy Ni-MH. Coban thay thế một phần Ni trong hợp kim LaNi5 đã làm giảm thể tích mol của hyđrô, VH, trong pha hyđrua, ảnh hưởng đến dung lượng và tăng thời gian sống của hợp kim.
Coban đã được sử dụng như một chất phụ gia trong thành phần hợp kim LaNi4,3-xCoxMn0,4Al0,3. Phụ gia Co làm tăng rõ rệt dòng trao đổi i0, dung lượng bề mặt Qs, điện dung lớp điện tích kép Cdl, các đại lượng này đạt giá trị cao nhất tại tỉ lệ x = 0,5 và 0,75 [3, 83, 84, 103]. Coban làm giảm điện trở phân cực Rp và điện trở chuyển điện tích Rct, đến giá trị nhỏ nhất tại tỉ lệ x = 0,5 và x = 0,75. Hợp kim LaNi4,3-xCoxMn0,4Al0,3 có tỉ lệ Co tối ưu cho quá trình nạp là x = 0,5; cho quá trình phóng là x = 0,75 [103].
Ảnh hưởng của Mn đến cấu trúc tinh thể và tính chất điện hóa của hợp kim La(Ni1-xMnx)z đã được nghiên cứu bởi Notten [78], với 5,0 ≤ z ≤ 6,0 và 0
≤ xz ≤ 2. Cả hai trục của ô cơ sở “a” và “c” đều tăng khi tăng hàm lượng Mn do nguyên tử Mn có bán kính lớn hơn Ni. Sự ổn định điện hóa của hợp kim phụ thuộc mạnh vào cả thành phần hóa học và tỷ lệ hợp thức z, tăng mạnh khi giá trị x lớn. Họ cũng chỉ ra rằng Mn rất hiệu quả trong việc giảm áp suất cân bằng của hyđrô trong hạt hợp kim.
Sự thay thế nhôm cho niken làm tăng các thông số mạng và thể tích ô cơ sở của hợp kim, cải thiện đáng kể sự ổn định phóng nạp của hợp kim, khi tỷ lệ Al tăng từ 0 đến 0,4 thời gian sống của hợp kim tăng từ 72 đến 132 chu kỳ [118]. Al trong hợp kim MmNi5 (Mm là mischmetal, hợp kim đất hiếm giàu Ce) làm giảm áp suất cân bằng đến gần áp suất khí quyển, giảm khả năng tích trữ, tăng độ dốc của đường áp suất cân bằng. Hợp kim MmNi4,5Al0,5 phù hợp làm vật liệu tích trữ hyđrô điều kiện hoạt động gần áp suất khí quyển.
1.2.4. Ăn mòn và phá hủy hợp kim LaNi5
1.2.4.1. Ô xy hóa trong không khí
Khi để trong không khí, hợp kim dạng LaNi5 sẽ bị ăn mòn. Trên bề mặt các hạt hợp kim LaNi5 dạng bột luôn có mặt một lớp các hợp chất ôxy hóa của niken và các hạt nanô tinh thể của La2O3. Các hợp chất ôxy hóa này được xác định bởi kính hiển vi điện tử quét (SEM) và phổ quang điện tử tia X (XPS). Niken và coban có thể bị ôxy hóa sâu tới 0,4 nm chiều dày, nhôm có thể sâu bị ôxy hoá sâu hơn.
Lớp ôxy hóa gồm 2 phần: phía trong giàu Ni, phía ngoài nghèo Ni. Đối với hợp kim LaNi5 lớp ôxy hóa dày khoảng từ 40 nm đến 50 nm, còn với hợp kim MmNi3,05Co0,95Al0,19Mn0,57 thì lớp này dày khoảng 10 nm đến 20 nm.
1.2.4.2. Ô xy hóa trong dung dịch KOH
Trong dung dịch KOH, hợp kim LaNi5 bị ăn mòn tạo thành các sản phẩm hoà tan và các sản phẩm rắn bám lên bề mặt hạt vật liệu.
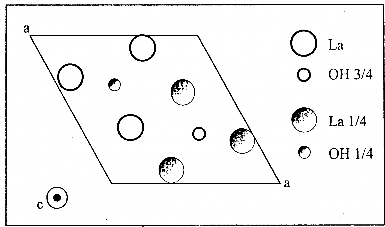
Hình 1.11. Cấu trúc lục giác kiểu UCl3 của La(OH)3 hướng chiếu trục
Hyđrôxit đất hiếm có cấu trúc tinh thể kiểu UCl3 được tạo thành trong quá trình ăn mòn hợp kim LaNi5. Các hyđrôxit này được xác định bằng phương pháp nhiễu xạ tia X. Trong thực tế La(OH)3 được coi là hợp chất bền nhất ở điều kiện pH và nhiệt độ trong ăc quy. Các kết quả phân tích bằng hiển
vi điện tử truyền qua (TEM) và hiển vi điện tử quét (SEM) chỉ ra rằng
La(OH)3 tạo thành dưới dạng các đỉnh nhọn ở tọa độ [0001], mật độ đỉnh này tăng theo số chu kì phóng nạp điện hóa. Kết quả đo phổ nhiễu xạ tia X cũng chỉ ra rằng các sản phẩm ăn mòn của ceri tồn tại chủ yếu dưới dạng Ce(III).
Sự có mặt của niken trong quá trình hyđrua hóa đã được xác định bằng phương pháp XRD, phương pháp đo từ tính và XPS. Niken có thể bị ôxy hóa tới 0,4 nm chiều dày. Boonstra và cộng sự cho rằng niken bị ôxy hóa thành Ni(OH)2.
Một số nguyên tố trong hợp kim MmNi3,58Al0,3Mn0,41Co0,76 bị ăn mòn tạo thành các sản phẩm hòa tan trong dung dịch KOH. Trong đó HMnO2- và AlO2- được coi là những chất bền nhiệt động có độ hòa tan lớn (10-4M với Mn(OH)2, 1M với Al2O3). Tốc độ hòa tan của hợp kim tăng theo nhiệt độ. M. Ikoma và cộng sự đã chứng minh sự có mặt Al và Mn trên bề mặt của các hạt LaNi5 bằng phương pháp phân tích huỳnh quang tia X và phương pháp XPS. Họ kết luận rằng 2 nguyên tố Mn và Al tan trong KOH và sau đó lắng đọng trên bề mặt của điện cực âm [46].
Trong môi trường KOH, hiện tượng ăn mòn cũng tạo pha hyđrôxit trên bề mặt vật liệu. Mức độ biến đổi pha khác nhau với những khoảng thời gian ngâm mẫu khác nhau. Tuy nhiên tất cả sự biến đổi này rất nhỏ không làm thay đổi đáng kể hằng số mạng của vật liệu nên không ảnh hưởng trực tiếp đến quá trình tích thoát thuận nghịch hyđrô của vật liệu.
1.2.4.3. Sự nứt vỡ hạt hợp kim
Sự nứt vỡ hạt hợp kim dưới tác động của môi trường điện ly hoặc/và phóng nạp đã được nghiên cứu bằng quan sát ảnh SEM tại vị trí hạt đã đánh dấu [14, 15]. Trước khi ngâm mẫu, các hạt đều cho ảnh rõ nét, sắc cạnh. Sau 23 ngày mẫu bị bào mòn, hai hạt ở giữa và phía dưới của ảnh, bị mòn hoàn toàn, hạt hợp kim còn lại bị biến đổi bề mặt, mòn vẹt và vỡ nhỏ so với ban đầu.



![Ảnh Sem Bề Mặt Mẫu Lani 2,49 Al 1,98 Mn 0,49 Co 0,08 Chưa Phóng Nạp (A), Và Phóng Nạp 200 Chu Kỳ Cv (B) [15]](https://tailieuthamkhao.com/uploads/2022/04/24/che-tao-hop-kim-goc-lani5-lam-vat-lieu-dien-cuc-am-do-ben-cao-de-su-4-1-120x90.jpg)

