Những chủng đường ruột đề kháng kháng sinh nhóm -lactam do tăng cường sản xuất ra enzym -lactamase (penicillinase hoặc cephalosporinase) do gen đề kháng nằm trên nhiễm sắc thể thường nhạy cảm với các kháng sinh thuộc nhóm khác.
Đề kháng thu được làm cho vi khuẩn sinh ra các enzym -lactamase khác
- Năm 1989-1990, hai tác giả Bauernfeind và Papanicolaou đã tìm thấy ở loài K. pneumoniae sinh ra enzym -lactamase kháng lại kháng sinh cephamycin (CMY-1, MIR-1), gen mã hóa nằm trên plasmid [91].
- Enzym immipenemase cũng đã được tìm thấy ở các loài S. marcescens và
E. cloacae bởi các tác giả Yang (1990), Lee và Raimondi (1991) [74], [97].
- Các Beta Lactamase mới [6]
* TEM-TYPE ESBLs (Lớp A): việc thay thế amino acid ở nhiều vị trí ở TEM-1 beta-lactamase có thể được tạo ra ở phòng thí nghiệm mà không mất hoạt tính. Sự thay đổi vị trí này của ESBLs làm thay đổi hình dạng vị trí hoạt hóa của men, cho phép thâm nhập oxyimino-beta-lactam. Việc mở vị trí hoạt hóa của enzym với beta-lactam làm gia tăng tính nhạy cảm của enzymvới beta-lactamase inhibitor (vd: clavulanic acid). Sự thay đổi amino acid của men có thể gây ra các dạng ESBLs có thể đề kháng với chất ức chế, tuy nhiên sự kết hợp giữa đề kháng và hoạt tính phổ rộng của enzym có vẻ như không tương thích (ngoại lệ hiếm gặp). Trên 130 men TEM đã được tìm thấy, và sự đa dạng của chúng có lợi cho việc theo dõi sự lan tràn của các gene đề kháng. TEM-10, TEM-12, TEM-16 thường gặp nhất ở Bắc Mỹ và Nam Mỹ.
* SHV-TYPE ESBLs (lớp A): SHV-1 chia 68% các amino acid của nó với TEM-1 và có cấu trúc tương tự. Cũng như TEM, SHV-type ESBLs có một hoặc nhiều sự thay thế các amino acid xung quanh vị trí hoạt hóa. Hơn 50 dạng khác nhau của SHV đã được biết. SHV-type ESBLs gặp nhiều trong các giám sát về phân lập tính đề kháng lâm sàng ở Châu Âu và Mỹ. SHV-5 và SHV-12 là 2 thành viên thường gặp nhất của họ này.
Có thể bạn quan tâm!
-
 Tỷ lệ nhiễm và mang gen kháng Cephalosporin thế hệ 3 và Quinolon của các chủng Klebsiella gây nhiễm khuẩn hô hấp phân lập tại Bệnh viện Nhi Trung ương, 2009 - 2010 - 1
Tỷ lệ nhiễm và mang gen kháng Cephalosporin thế hệ 3 và Quinolon của các chủng Klebsiella gây nhiễm khuẩn hô hấp phân lập tại Bệnh viện Nhi Trung ương, 2009 - 2010 - 1 -
 Tỷ lệ nhiễm và mang gen kháng Cephalosporin thế hệ 3 và Quinolon của các chủng Klebsiella gây nhiễm khuẩn hô hấp phân lập tại Bệnh viện Nhi Trung ương, 2009 - 2010 - 2
Tỷ lệ nhiễm và mang gen kháng Cephalosporin thế hệ 3 và Quinolon của các chủng Klebsiella gây nhiễm khuẩn hô hấp phân lập tại Bệnh viện Nhi Trung ương, 2009 - 2010 - 2 -
 Các Yếu Tố Làm Cho Vi Khuẩn Không Chịu Tác Dụng Của Thuốc Kháng Sinh
Các Yếu Tố Làm Cho Vi Khuẩn Không Chịu Tác Dụng Của Thuốc Kháng Sinh -
 Phát Hiện Các Đột Biến 158Delag, 5382Insc Và 6174Delt Bằng Real-Time Pcr (Scort Và Cs, 2006).
Phát Hiện Các Đột Biến 158Delag, 5382Insc Và 6174Delt Bằng Real-Time Pcr (Scort Và Cs, 2006). -
 Hình Ảnh Minh Hoạ Giải Trình Tự Một Đoạn Dna (Nguồn: Sanger Cequencing Read Display.gif)
Hình Ảnh Minh Hoạ Giải Trình Tự Một Đoạn Dna (Nguồn: Sanger Cequencing Read Display.gif) -
 Nuôi Cấy, Phân Lập, Xác Định Căn Nguyên Vi Khuẩn:
Nuôi Cấy, Phân Lập, Xác Định Căn Nguyên Vi Khuẩn:
Xem toàn bộ 134 trang tài liệu này.
* CTX-TYPE ESBLs (lớp A): được nhấn mạnh về hoạt tính của nó chống lại cefotaxime lớn hơn ceftazidime. Hiện nay, có hơn 40 CTX-M đã được biết. Một vài CTX-M thủy phân ceftazidime nhanh hơn cả thủy phân cefotaxime. CTX-M-14, CTX-M-3, CTX-M-2 là thường gặp nhất.
* NHỮNG ESBLs LỚP A KHÁC: Những ESBLs lớp A khác không thường gặp và được tìm thấy chủ yếu ở Pseudomonas aeruginosa và ở một số ít nơi: PER-1 được phân lập ở Thổ Nhĩ Kỳ, Pháp, và Ý; VEB-1 và VEB-2 tìm thấy ở Đông Nam Á; GES-1, GES-2 và IBC-2 được phân lập ở Nam Phi, Pháp và Hy Lạp. PER-1 cũng thường gặp ở dòng acinetobacter ở Hàn Quốc và Thổ Nhĩ Kỳ. Một số các men này cũng được tìm thấy ở Enterobacteriaceae, ngược lại các ESBLs ít gặp (như BES-1, IBC-1, SFO-1 và TLA-1) chỉ được tìm thấy ở Enterobacteriaceae.

* OXA-TYPE ESBLs (lớp D): 12 ESBLs bắt nguồn từ OXA-10, OXA-1, hay OXA-2 bằng cách thay thế các amino acid. Các men này được tìm thấy chủ yếu ở P.aeruginosa ở Thổ Nhĩ Kỳ và Pháp. Hầu hết các OXA-type ESBLs có đề kháng tương đối với tính ức chế của clavulanic acid. Một số men cho thấy chủ yếu đề kháng với ceftazidime, nhưng OXA-17 cho thấy đề kháng nhiều hơn với cefotaxime và cefepime hơn là đề kháng với ceftazidime.
* MEN PLASMID-MEDIATED AmpC (lớp C): AmpC beta-lactamases, sinh ra do beta-lactam, được mã hóa ở các gene trên nhiễm sắc thể ở nhiều trực khuẩn gram âm. Các đột biến làm gia tăng tình trạng đề kháng cephalosporin phổ rộng ở Enterobacter cloacae. Men AmpC ở E.coli được biểu hiện nghèo nàn và gene AmpC mất đi ở nhiễm sắc thể của Klebsiellavà Salmonella, nhưng men plasmid-mediated AmpC có thể làm cho các vi khuẩn này có tính đề kháng giống nhau như các enterobacter kháng beta-lactam. Hơn 20 AmpC beta-lactamase được tìm thấy truyền qua trung gian plasmid. AmpC beta-lactamase có đặc trưng làm cho đề kháng với cephamycin cũng như với oxyimino-beta-lactam và đề kháng với chất ức chế (clavulanic acid).
* CARBAPENEMASES (LỚP A, B VÀ D): carbapenemases là một nhóm khác, hiện nay ít gặp tuy nhiên rất được quan tâm, vì chúng có hoạt tính không những
chỉ chống lại oxyimino-cephalosporin và cephamycin mà còn với carbapenem. Plasmid-mediated IMP-type carbapenemases (hiện nay đã biết được 17 loại), được tìm thấy ở Nhật (1990s), ở cả gram âm đường ruột, pseudomonas và acinetobacter sp. Men IMP lan truyền chậm đến các quốc gia khác ở vùng Đông Nam Á; được báo cáo ở Châu Âu năm 1997, và đã được tìm thấy ở Canada và Brazil. Họ thứ 2 của carbapenemases đang phát triển là họ VIM, được báo cáo ở Ý năm 1999 và đến nay gồm 10 thành viên, phân bố rộng rãi ở Châu Âu, Nam Mỹ, và Đông Nam Á và hiện nay đã tìm thấy ở Mỹ. Một vài men lớp A, đặc biệt là men plasmid-mediated KPC, cũng có tác dụng như carbapenemases. Sau cùng, vài OXA-type beta-lactamases có hoạt tính carbapenemases, bằng cơ chế đề kháng thêm vào như thay đổi tính thấm hay bơm đẩy kháng sinh ra ngoài.
Đề kháng thu được không do sinh ra enzym -lactamase[45], [56] [62] [58],[120].
- Do làm thay đổi tính thấm qua màng tế bào: trường hợp này ít gặp, một chủng đường ruột có thể trở nên kháng với kháng sinh nhóm -lactam do đột biến trên NST làm thay đổi tính thấm của màng tế bào, đề kháng kiểu này đã được Gutmann (1984), Jarlier (1986) và Ingahm (1990) mô tả.
- Do làm thay đổi đích bám của kháng sinh: rất hiếm gặp ở các chủng đường ruột, cũng do đột biến trên NST đã làm thay đổi đích bám của kháng sinh penicillin (PBP) hoặc làm thay đổi đích bám của các -lactam khác. Năm 1979, Aono đã tìm thấy ở chủng E. coli đề kháng mecilliam theo cơ chế này [29].
- Có thể có những vi khuẩn mang một kiểu đề kháng phức tạp do có sự phối hợp nhiều cơ chế đề kháng trên cùng một chủng:
. Sinh ra enzym -lactamase phổ mở rộng + đột biến làm thay đổi tính thấm của màng tế bào.
. Tăng cường sản xuất enzym cephalosporinase do đột biến gen điều hòa + sinh ra enzym penicillinase do nhận được gen đề kháng nằm trên plasmid.
. Tăng cường sản xuất enzym cephalosporinase do sự khuếch đại gen hoặc do có sự thiết lập những gen điều hòa mới + đột biến làm thay đổi tính thấm của màng tế bào.
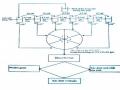
Efflux System Exit Portal (OprM)
Outer Membrane
Periplasm
Linker Lipoprotein (Mex A)
Cytoplasmic Membrane
Hệ thống bơm đẩy kháng sinh ra ngoài
Kênh porin bị đột biến ngăn cản thuốc vào VK
Men Betalactamase
Porin
Hệ thống bơm đẩy kháng sinh
Hình 1.5. Đề kháng thu được không do sinh ra enzym -lactamase
1.4.2.6. Đề kháng với kháng sinh Quinolon
Sự đề kháng với nhóm kháng sinh này cho đến nay vẫn được hiểu là do đột biến trên NST. Sự đột biến này làm thay đổi đặc tính của enzym tác động vào quá trình sinh tổng hợp ADN (enzym ADN - gyrase) làm cho kháng sinh không tác động vào được nữa. Năm 1998, Martinez - Martinez và cộng sự [78] lần đầu tiên mô tả chủng K. pneumoniae mang gen kháng quinolon nằm trên plasmid, đồng thời các gen này còn gắn trên các Integron khác nhau. Hơn nữa, các plasmid này cũng đồng thời mang gen mã hóa enzym -lactamase phổ rộng hoặc enzyme cephalosporinase. Phát hiện này có tầm quan trọng rất lớn, bởi nó nói lên rằng gen kháng quinolon có thể được lan truyền ngang giữa các vi khuẩn.
1.4.2.7. Ý nghĩa sinh học
Những hiểu biết về cơ chế sinh hóa và di truyền học của sự đề kháng kháng sinh ở vi khuẩn đã giúp ích được rất nhiều cho các thầy thuốc lâm sàng trong công tác điều trị.
Đề kháng tự nhiên
Những hiểu biết về sự đề kháng tự nhiên sẽ giúp các thầy thuốc lâm sàng tránh được những chỉ định không hợp lý như: không nên sử dụng erythromycin để điều trị nhiễm trùng do E. coli, hoặc không nên sử dụng colistin và nalidixic acid để điều trị nhiễm trùng do tụ cầu hoặc nhiễm trùng do trực khuẩn mủ xanh không nên dùng penicillin G để điều trị, cần thận trọng khi lựa chọn kháng sinh nhóm -lactam để điều trị các bệnh nhiễm trùng do vi khuẩn họ đường ruột gây nên.
Đề kháng thu được
- Sự đề kháng do đột biến trên NST đã làm xuất hiện những chủng vi khuẩn kháng kháng sinh trong chính quần thể vi khuẩn nhạy cảm, sự có mặt của kháng sinh trở thành một chất xúc tác để chọn lọc những dòng vi khuẩn đề kháng. Việc điều trị một kháng sinh đơn độc có thể đưa đến sự lựa chọn những chủng kháng đa kháng sinh, hơn thế nếu điều trị một kháng sinh không còn tác dụng đối với một chủng đa kháng (điều trị "mù") sẽ là điều kiện để chủng "ngoan cố" này gây thành dịch. Để phòng ngừa hoặc làm giảm nguy cơ xuất hiện những chủng đột biến kháng kháng sinh, bằng cách lựa chọn hai kháng sinh thuộc hai nhóm khác nhau (dựa theo nguyên tắc lựa chọn kháng sinh phối hợp) để điều trị phối hợp. Vì theo lý thuyết, một trong những đặc điểm của sự đột biến là nó mang tính độc lập, vì vậy khả năng để một tế bào vi khuẩn xuất hiện đột biến kháng cả hai kháng sinh đồng thời là rất
hiếm, tần xuất này chỉ có thể là 10-14 hoặc 10-15. Chính vì thế mà đã từ lâu người ta
áp dụng điều trị phối hợp hai hoặc ba kháng sinh trong điều trị lao.
- Sự đề kháng do nhận được gen đề kháng thông qua các hình thức: tiếp hợp khi hai vi khuẩn tiếp xúc trực tiếp với nhau, biến nạp khi vi khuẩn bị ly giải và giải phóng ra ADN tự do hoặc tải nạp nhờ phage hoặc do một thành phần di truyền di động (transposons):
. Transposons có thể là nguyên nhân hàng đầu trong việc lan truyền một số gen đề kháng nhất định vào nhiều loại vi khuẩn khác nhau [47]. Nhưng riêng khả năng chuyển vị trí chưa đủ để lan truyền được gen đề kháng mà nó còn phải gắn vào một đơn vị sao chép nào đó (plasmid, phagiơ hay NST). Khi nằm trên một vector không tự sao chép của tế bào chủ thì transposons có thể chuyển vị trí mà nhảy vào một plasmid đang tồn tại trong tế bào hay nhảy vào NST.
. Hình thức tiếp hợp giữ vai trò quan trọng vì R-plasmid (là những plasmid mang đặc tính đề kháng) được tìm thấy ở rất nhiều tác nhân gây bệnh, khoảng 60- 90% vi khuẩn Gram âm đề kháng là do R-plasmid. Khả năng của một số plasmid kể cả tự truyền và không tự truyền có thể tồn tại ở nhiều loài vi khuẩn [55] [33], cũng đóng vai trò quan trọng trong sự bảo tồn và lan truyền gen đề kháng, ví dụ: những plasmid giống nhau ở nhiều loài thuộc họ Enterobacteriaceae [41]. Sự đề kháng của vi khuẩn do gen mã hóa nằm trên plasmid gặp ở hầu hết các nhóm kháng sinh khác nhau. Mà các plasmid luôn duy trì ổn định trong tế bào chủ thông qua sự truyền dọc cùng với sự phát triển của vi khuẩn và hơn thế nó có thể truyền ngang do lan truyền từ chủng này sang chủng khác. Vì vậy, tính kháng thuốc có thể được truyền dọc qua các thế hệ và truyền ngang giữa các chủng, các loài, gây khó khăn cho việc điều trị. Do nhận được R-plasmid, có những chủng vi khuẩn trở thành kháng lại một hay nhiều thuốc kháng sinh khác nhau, mặc dù trước đó chúng chưa hề tiếp xúc lần nào với những kháng sinh đó. Hiện nay chỉ có một số loại kháng sinh mà vi khuẩn đề kháng theo cơ chế đột biến là: rifamycin, polymycin, nitrofuran, quinolon và vancomycin.
Chính vì thế mà trong những năm gần đây, việc sử dụng kháng sinh một cách bừa bãi và lạm dụng những kháng sinh thế hệ mới của các thầy thuốc lâm sàng trong các bệnh viện cũng như các thầy thuốc điều trị tư đã làm xuất hiện ngày càng nhiều chủng vi khuẩn đột biến kháng kháng sinh và ngày càng lựa chọn nhiều chủng kháng đa kháng sinh. Đặc biệt trong môi trường khép kín của bệnh viện, việc "giao lưu" của những vi khuẩn đề kháng từ người này sang người khác được thúc
đẩy qua các dụng cụ thăm khám, qua các loại chất tiết khác nhau của bệnh nhân, nên môi trường bệnh viện là ổ dự trữ lớn vi khuẩn đề kháng.
Như vậy, sử dụng kháng sinh để điều trị phải hết sức thận trọng để hạn chế việc xuất hiện và lan truyền vi khuẩn đa kháng kháng sinh.
1.5. Phương pháp xác định độ nhạy cảm của vi khuẩn với kháng sinh và các phương pháp xác định gen kháng thuốc của vi khuẩn
1.5.1. Phương pháp xác định độ nhạy cảm của vi khuẩn với kháng sinh
1.5.1.1. Kỹ thuật khoanh giấy khuếch tán trên thạch
Là kỹ thuật xác định tính nhạy cảm kháng sinh của các chủng vi khuẩn gây bệnh với các loại kháng sinh khác nhau.
Kỹ thuật [2],[84].
Vi khuẩn đã được định danh, thuần khiết, nuôi cấy 18-24h trên môi trường không có chất ức chế, Đồng nhất vi khuẩn trong canh thang MH hoặc nước muối sinh lý 0,9% so với độ đục chuẩn McFarland 0,5, để có huyền dịch vi khuẩn ban đầu tương ứng với 108 vi khuẩn/1ml. Sau đó tiếp tục pha loãng
huyền dịch này 1/100 (hoặc 1/10 tùy theo mỗi loại vi khuẩn) trong canh thang MH hoặc nước muối sinh lý để có huyền dịch vi khuẩn 106 vi khuẩn/1ml (hoặc 107, hoặc 108 vi khuẩn/1ml, tùy theo mỗi loại vi khuẩn).
Ria hoặc láng huyền dịch vi khuẩn đã đồng nhất ở trên dàn đều vi khuẩn lên bề mặt thạch, sau đó để hộp thạch khô tự nhiên hoặc phơi trong tủ ấm 370C/15-30 phút.
Đặt khoanh giấy kháng sinh, sao cho khoảng cách giữa các khoanh giấy cách nhau 2cm và cách mép hộp lồng 2cm. Sau khi đặt khoanh giấy kháng sinh, cần để hộp lồng ở nhiệt độ phòng 30 phút trước khi cất trong tủ ấm 370C .
Đọc kết quả :
- Đọc kết quả sau khi đã để tủ ấm 370C/18-24h.
- Dựa vào bảng chuẩn để xác định mức độ nhạy cảm kháng sinh của từng loại vi khuẩn khác nhau.
- Có ba mức độ nhạy cảm được qui định : nhạy cảm (Susceptible - viết tắt S), trung gian (Intermediate - viết tắt I) hoặc đề kháng (Resistante - viết tắt R).
Có các tiêu chuẩn riêng về môi trường, độ đục huyền dịch vi khuẩn và khí trường ủ của từng loại chủng vi khuẩn
1.5.1.2. Kỹ thuật xác định nồng độ kháng sinh tối thiểu ức chế vi khuẩn (Minimum Inhibitory Concentration - MIC)
Kỹ thuật [2],[84]
Pha kháng sinh
Pha dung dịch kháng sinh đậm đặc (dung dịch “mẹ”)
- Nếu sử dụng kháng sinh bột dùng cho phòng thí nghiệm:
Dựa trên hoạt lực của kháng sinh (được ghi trên các nhãn lọ), cần tính để pha dung dịch “mẹ” theo công thức.
. Dung dịch kháng sinh “mẹ” sau khi pha xong, chia nhỏ ra các ống nghiệm, bảo quản trong lạnh âm 200C (trừ kháng sinh Acid nalidixic bảo quản ở nhiệt độ phòng). Khi đã lấy ra sử dụng, chỉ dùng trong 24h.
- Nếu sử dụng kháng sinh bột dùng cho tiêm truyền tĩnh mạch:
Pha toàn bộ lọ kháng sinh đó với một lượng nước hồi chỉnh hoặc nước cất theo chỉ dẫn (có trên nhãn của lọ kháng sinh), từ đó tính được nồng độ của dung dịch mẹ.
Pha các nồng độ kháng sinh từ nồng độ của dung dịch mẹ.
* Nồng độ cuối cùng pha loãng 1/10 trong môi trường, được tính theo tỷ lệ trộn 2,5 ml dung dịch trung gian + 22,5 ml thạch MH (MIC bằng phương pháp pha loãng trong thạch), hoặc 0,2 ml dung dịch trung gian + 1,8 ml canh thang MH (MIC bằng phương pháp pha loãng trong canh thang).
Kỹ thuật xác định nồng độ kháng sinh tối thiểu ức chế vi khuẩn trong môi trường đặc
Ngày 1: Chuẩn bị chủng và môi trường
- Các chủng cần thử MIC và các chủng chuẩn quốc tế được cấy trong canh thang thường hoặc canh thang MH để có được canh khuẩn non (một số vi khuẩn có thể cấy vi khuẩn trên môi trường thạch)
- Chuẩn bị thạch MH: Cân thạch theo công thức (ghi trên hộp), đun sôi cho tan hết thạch, hấp thạch ở 1210C/15’ (Đối với một số chủng cần môi trường có chất dinh dưỡng cao, cần bổ sung thêm các chất dinh dưỡng cần thiết).
- Khi thạch đã nguội còn khoảng 40-500C, dùng ống đong khắc vạch đong 22,5 ml thạch cho vào bình nón đã có sẵn 2,5 ml dung dịch kháng sinh theo các nồng độ như trong bảng pha kháng sinh. Mỗi lần làm MIC cần 2 đĩa môi trường MH không có kháng sinh để làm đĩa chứng (cho thêm 2,5 ml PBS hoặc nước cất + 22,5 ml môi trường thạch MH).