cao gấp 22,70 lần so với mật độ vi khuẩn thấp nhất ở nghiệm thức pH = 9.
pH | Mật độ VK (x106 CFU/ml) | ||
Chủng RB.DS29 | Chủng RB.CJ41 | Chủng RB.EK7 | |
5 | 470,00± 17,32ef | 366,67±20,82e | 164 ± 12,49f |
5,5 | 938,00± 14,00c-e | 669,00± 38,18c | 1456 ± 26,00d |
6 | 1180,67 ± 49,17b-d | 200,00± 9,17f | 1730 ± 161,79c |
6,5 | 1530,67 ± 159,21b | 1056,00±60,40a | 1266,67 ± 16,65e |
7 | 3299,33 ±183,61a | 478,33±56,58d | 3083,67 ± 88,91a |
7,5 | 1437,33 ±116,57bc | 353,33±30,14e | 2483 ± 59,57b |
8 | 975,33 ±222,39de | 996,67±45,09a | 1285,33 ± 12,22e |
8,5 | 576,67 ±5,77ef | 451,00±39,66de | 143,33 ± 12,58f |
9 | 145,33 ±35,12f | 766,67± 35,12b | 232± 15,10f |
CV% | 19,26 | 6,72 | 3,05 |
P | ** | ** | ** |
Có thể bạn quan tâm!
-
 Ảnh Hưởng Của Chủng Vi Khuẩn Đến Sinh Trưởng Rễ Của Cây Hồ Tiêu Sau 90 Ngày Lây Nhiễm Phytophthora
Ảnh Hưởng Của Chủng Vi Khuẩn Đến Sinh Trưởng Rễ Của Cây Hồ Tiêu Sau 90 Ngày Lây Nhiễm Phytophthora -
 Ảnh Hưởng Của Chủng Vi Khuẩn Đến Một Số Chỉ Tiêu Sinh Trưởng Và Kháng Bệnh Của Cây Hồ Tiêu Sau 120 Ngày Lây Nhiễm Nấm Fusarium
Ảnh Hưởng Của Chủng Vi Khuẩn Đến Một Số Chỉ Tiêu Sinh Trưởng Và Kháng Bệnh Của Cây Hồ Tiêu Sau 120 Ngày Lây Nhiễm Nấm Fusarium -
 Định Danh Các Chủng Có Tiềm Năng Kháng Phytophthora, Fusarium, Kháng Tuyến Trùng Meloidogyne Gây Bệnh Rễ Ở Cây Hồ Tiêu
Định Danh Các Chủng Có Tiềm Năng Kháng Phytophthora, Fusarium, Kháng Tuyến Trùng Meloidogyne Gây Bệnh Rễ Ở Cây Hồ Tiêu -
 Các Hợp Chất Thứ Cấp Kháng Phytophthora Của Của Chủng Rb.ds29 Bằng Phân Tích Gc-Ms
Các Hợp Chất Thứ Cấp Kháng Phytophthora Của Của Chủng Rb.ds29 Bằng Phân Tích Gc-Ms -
 Mối Tương Quan Giữa Hoạt Tính Enzyme Và Tỷ Lệ Tử Vong Tuyến Trùng
Mối Tương Quan Giữa Hoạt Tính Enzyme Và Tỷ Lệ Tử Vong Tuyến Trùng -
![Ảnh Hưởng Của Hexahydropyrrolo [1,2-A] Pyrazine-1,4-Dione Đến Tỷ Lệ Tử Vong Của Tuyến Trùng Và Tỷ Lệ Nở Của Trứng Tuyến Trùng](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Ảnh Hưởng Của Hexahydropyrrolo [1,2-A] Pyrazine-1,4-Dione Đến Tỷ Lệ Tử Vong Của Tuyến Trùng Và Tỷ Lệ Nở Của Trứng Tuyến Trùng
Ảnh Hưởng Của Hexahydropyrrolo [1,2-A] Pyrazine-1,4-Dione Đến Tỷ Lệ Tử Vong Của Tuyến Trùng Và Tỷ Lệ Nở Của Trứng Tuyến Trùng
Xem toàn bộ 224 trang tài liệu này.
Bảng 3.19. Ảnh hưởng của pH đến sinh trưởng của chủng RB.DS29, RB.CJ41 và RB.EK7
Ghi chú: ** Khác biệt có ý nghĩa thống kê ở mức p<0,01. Các chữ cái giống nhau trên cùng một cột thể hiện sự khác biệt không có ý nghĩa thống kê theo trắc nghiệm phân hạng Duncan’s Multiple Rang Test.
Đối với chủng RB.CJ41: Khi đánh giá mật độ vi khuẩn tại các nghiệm thức khác nhau cho thấy có sự khác biệt về mặt thống kê (p<0,01), mật độ vi khuẩn từ 200,00 x106 – 1056,00 x 106 CFU/ml. Ở nghiệm thức pH 6,5 có mật độ vi khuẩn cao nhất gấp từ 1,38 lần đến 5,28 lần so với các nghiệm thức còn lại. Nghiên cứu của Ann và cộng sự (2012), vi khuẩn Bacillus CBF tăng trưởng cao nhất ở pH 5,5 và không tăng trưởng trong môi trường có pH 8 [24].
Đối với chủng RB.EK7: Mật độ vi khuẩn có sự khác biệt có ý nghĩa về mặt thống kê giữa các nghiệm thức (p<0,01). Trong đó, nghiệm thức pH 7 có mật độ vi khuẩn cao nhất đạt gấp 21,514 lần so với nghiệm thức pH 8,5 có mật độ vi khuẩn thấp nhất. Các nghiệm thức còn lại có mật độ vi khuẩn dao động từ 164 x 106 CFU/ml
- 2483 x 106 CFU/ml. Theo nghiên cứu của Vũ Thúy Nga (2016), pH 7 cũng là pH tối ưu của chủng Bacillus velezensis SHV.22 [164].
3.2.1.3. Thời gian
Để tăng sinh khối, vi khuẩn được nuôi cấy trong một thiết bị kín nhằm đảm bảo
tính thuần của dịch vi khuẩn. Trong quá trình nuôi cấy, nếu môi trường không thay đổi và thời gian nuôi cấy càng kéo dài thì nồng độ chất dinh dưỡng càng giảm, các chất thải của quá trình trao đổi chất càng tăng và ảnh hưởng đến khả năng tăng sinh khối của vi khuẩn. Xác định được thời gian nuôi cấy và lên men rất quan trọng để xác định thời điểm thu sinh khối, các hoạt chất có lợi từ vi khuẩn. Nghiên cứu tiến hành nhân giống cấp 1 ở 3 mốc thời gian là 12 giờ, 24 giờ và 36 giờ. Sau đó tiếp tục lên men ở các mốc thời gian 0 giờ, 6 giờ, 8 giờ và 10 giờ tương ứng với tuổi giống 12 giờ, 24 giờ và 36 giờ. Đo OD610nm và trải dịch nuôi vi khuẩn để xác định mật độ vi khuẩn tại các thời điểm lên men khác nhau. Kết quả thực nghiệm được ghi nhận ở bảng 3.20.
Bảng 3.20. Ảnh hưởng của thời gian đến khả năng sinh trưởng của vi khuẩn RB.DS29
Chủng RB.DS29 | Chủng RB.CJ41 | Chủng RB.EK7 | ||||
OD/ độ pha loãng | Mật độ vi khuẩn (x106 cfu/ml) | OD/ độ pha loãng | Mật độ vi khuẩn (x106 cfu/ml) | OD/ độ pha loãng | Mật độ vi khuẩn (x106 cfu/ml) | |
12h/0h | 0,341/1 | 146,67±7,09i | 0,310/2 | 41,67±2,08h | 0,487/2 | 92,7±7,57d |
12h/6h | 1,789/12 | 2932,00±48,50c | 0,466/3 | 108,00±27,50gh | 1,076/8 | 733,3±36,07c |
12h/8h | 2,007/15 | 2420,00±73,99d | 0,881/6 | 238,00±60,10f | 1,624/10 | 2081,3±206,39ab |
12h/10h | 2,095/15 | 950,00±17,32h | 1,365/7 | 672,00±32,08b | 1,824/14 | 2123,3±81,45ab |
24h/0h | 1,122/8 | 1346,67±145,18e | 0,323/2 | 48,00±5,29h | 0,535/2 | 102,0±12,00d |
24h/6h | 1,997/16 | 2154,67±145,18e | 1,252/7 | 714,00±12,12b | 1,246/8 | 1018,7±128,33c |
24h/8h | 2,345/20 | 3306,67±30,55b | 1,413/8 | 594,67±44,06c | 1,733/10 | 2328,7±563,89a |
24h/10h | 2,423/22 | 5331,33±132,61a | 1,414/8 | 264,00±21,17f | 1,906/14 | 2430,0±115,33a |
36h/0h | 0,264/1 | 70,00±2,00i | 0,357/2 | 144,67±16,65g | 0,422/2 | 82,7±11,37d |
36h/6h | 1,901/20 | 1233,33±83,27g | 0,965/5 | 1013,33±28,43a | 0,986/8 | 533,3±45,49cd |
36h/8h | 2,006/20 | 1620,00±222,71f | 1,465/8 | 496,00±16,00d | 1,586/10 | 2153,3±97,13ab |
36h/10h | 2,075/20 | 1740,00±211,66f | 1,506/8 | 352,00±48,00e | 1,793/14 | 1820,0±342,07b |
CV% | 5,84 | 8,06 | 16,21 | |||
P | ** | ** | ** |
Ghi chú: ** Khác biệt có ý nghĩa thống kê ở mức p<0,01; Các chữ cái giống nhau trên cùng một cột thể hiện sự khác biệt không có ý nghĩa thống kê theo trắc nghiệm phân hạng Duncan’s Multiple Rang Test.
Đối với chủng RB.DS29: Khi đánh giá mật độ vi khuẩn ở các tuổi giống khác nhau (12 giờ, 24 giờ, 36 giờ) và lên men trong bình tam giác với thời gian 0 giờ, 6 giờ, 8 giờ và 10 giờ, mật độ vi khuẩn đạt cao nhất ở thời điểm tuổi giống 24 giờ và 02 mốc thời gian lên men 8 giờ và 10 giờ đạt lần lượt 5331,33 x106 CFU/ml, 3306,67 x106 CFU/ml. Tuy nhiên, thời điểm 8 giờ lên men có hệ số nhân giống tăng 2 lần, nồng độ pha loãng 20 lần so với thời điểm 10 giờ. Trong khi đó hệ số nhân giống thời điểm 6 giờ tăng 4 lần so với thời điểm 8 giờ. Điều này chứng tỏ vi khuẩn đang ở giai
đoạn sinh trưởng mạnh. Vì vậy, thời gian nhân giống 24 giờ và lên men 8 giờ được lựa chọn cho các nghiên cứu tiếp theo.
Đối với chủng RB.CJ41: Mật độ vi khuẩn có sự khác biệt có ý nghĩa thống kê giữa các nghiệm thức (p<0,01) với tuổi giống khác nhau 12 giờ, 24 giờ, 36 giờ được lên men trong bình tam giác với thời gian 0 giờ, 6 giờ, 8 giờ và 10 giờ. Mật độ vi khuẩn dao động từ 48x106 CFU/ml – 1013,33x106 CFU/ml. Trong đó, mật độ vi khuẩn cao nhất ở thời điểm tuổi giống 36 giờ và thời gian lên men 6 giờ đạt 1013,33 x106 CFU/ml. Tuy nhiên, trong nghiên cứu của Phương Thị Hương, Vũ Văn Hạnh (2018) mật độ tế bào vi khuẩn Bacillus subtilis BSVN15 đạt cao nhất sau 24 giờ lên men là 18370 x106 CFU/ml [165].
Đối với chủng RB.EK7: Mật độ vi khuẩn giữa các nghiệm thức dao động từ 82,7 x106 CFU/ml - 2430,7 x106 CFU/ml. Mật độ vi khuẩn không có sự khác biệt về mặt thống kê ở nghiệm thức có thời gian nhân giống/ thời gian lên men lần lượt là 12h/8h, 12h/10h, 24h/8h, 24h/10h và 36h/8h. Nhìn chung, ở cả 3 thời điểm nhân giống, mật độ vi khuẩn sinh trưởng tốt với thời gian lên men 8 giờ và 10 giờ. Tuy nhiên, thời gian lên men 10 giờ có hệ số nhân giống gấp 4 lần so với thời gian lên men 8 giờ. Mật độ vi khuẩn cao nhất ở thời gian nhân giống 24 giờ (2328,7 x106 CFU/ml) gấp 1,11 – 1,27 lần so với tại thời điểm 12 giờ và 36 giờ. Như vậy, thời gian nhân giống và thời gian lên men tốt nhất đối với chủng RB.EK7 tại thời điểm 24 giờ và 10 giờ.
3.2.1.4. Nhiệt độ
Nhiệt độ là yếu tố ảnh hưởng rất lớn đến sinh trưởng cũng như quá trình tổng hợp các hợp chất thứ cấp của vi khuẩn. Mỗi loại vi khuẩn thích nghi với một giới hạn nhiệt độ nhất định, dựa vào khoảng nhiệt độ phát triển tối ưu, vi khuẩn có thể được chia làm 3 nhóm: nhóm ưa ấm có nhiệt độ tối ưu từ 20oC - 45oC, nhóm ưa lạnh có nhiệt độ tối ưu dưới 20oC và nhóm ưa nóng có nhiệt độ tối ưu trên 45oC. Nhiệt độ quá thấp vi khuẩn không phát triển được nhưng có thể còn sống, nhưng nếu nhiệt độ cao hoặc rất cao thì vi khuẩn bị tiêu diệt [120]. Kết quả về ảnh hưởng của nhiệt độ đến sinh trưởng của các chủng vi khuẩn được ghi nhận ở bảng 3.21.
Đối với chủng RB.DS29: Mật độ vi khuẩn tăng dần từ nhiệt độ 29oC đến 35oC, sau đó giảm dần đến nhiệt độ 39oC và có sự khác biệt có ý nghĩa thống kê ở mức p<0,01. Mật độ vi khuẩn cao nhất ở nhiệt độ 35oC đạt 179,67 x 106 CFU/ml gấp 46,91 lần so với mật độ vi khuẩn thấp nhất ở nhiệt độ 29oC đạt 26 x 106 CFU/ml.
Đối với chủng RB.CJ41: Mật độ vi khuẩn có sự khác biệt về mặt thống kê ở các ngưỡng nhiệt độ khác nhau và dao động từ 258,00x107 CFU/ml – 1233,33x107
CFU/ml. Nhiệt độ 37oC có mật độ vi khuẩn cao nhất gấp 4,78 lần so với nghiệm thức nhiệt độ 33oC (258,00x107 CFU/ml), gấp 3,58 lần so với nghiệm thức 29oC (344,00x107 CFU/ml). Kết quả nghiên cứu cũng tương đồng với nghiên cứu của Phương Thị Hương, Vũ Văn Hạnh (2018) khi nuôi cấy vi khuẩn Bacillus subtilis BSVN15 ở 37oC có mật độ vi khuẩn đạt 83100x106 CFU/ml [165]. Trong khi đó, chủng Bacillus subtilis CBF trong nghiên cứu Ann và cộng sự (2012) sinh trưởng tốt trong điều kiện nhiệt độ 30oC [24]..
Đối với chủng RB.EK7: Ở nhiệt độ 37oC có mật độ vi khuẩn cao nhất đạt 723 x 106 CFU/ml gấp 4,665 lần so với ở nhiệt độ có mật độ vi khuẩn thấp nhất đạt 155 x 106 CFU/ml. Các nghiệm thức còn lại mật độ vi khuẩn đạt từ 174 x 106 CFU/ml - 640 x 106 CFU/ml. Theo nghiên cứu Vũ Thúy Nga (2016) chủng Bacillus velezensis SHV.22 có khả năng sinh trưởng mạnh trong điều kiện 28oC [164].
Bảng 3.21. Ảnh hưởng của nhiệt độ đến sinh trưởng của chủng RB.DS29, RB.CJ41 và RB.EK7
Mật độ VK (x106CFU/ml) | |||
Chủng RB.DS29 | Chủng RB.CJ41 | Chủng RB.EK7 | |
29oC | 260,00± 10,00e | 344,00±36,66c | 155,00± 21,79d |
31oC | 413,33± 15,28d | 565,33±50,81b | 155,00± 42,04d |
33oC | 563,33 ± 35,12c | 258,00±21,63c | 489,00±24,00b |
35oC | 1796,7 ± 36,06a | 686,00±24,25b | 613,33±60,28ab |
37oC | 1110,00 ± 70,24b | 1233,33±57,52a | 731,00± 93,79a |
40oC | 400 ± 30,00 d | 626,00±66,36b | 308,00 ± 14,00c |
CV% | 5,21 | 7,75 | 12,30 |
P | ** | ** | ** |
Ghi chú: ** Khác biệt có ý nghĩa thống kê ở mức p<0,01; Các chữ cái giống nhau trên cùng một cột thể hiện sự khác biệt không có ý nghĩa thống kê theo trắc nghiệm phân hạng Duncan’s Multiple Rang Test.
3.2.1.5. Tốc độ lắc
Tốc độ lắc ảnh hưởng đến nồng độ oxy hòa tan và sự khuếch tán các chất dinh dưỡng vào môi trường. Tốc độ lắc thích hợp sẽ cải thiện sự sinh trưởng, phát triển và tổng hợp các hợp chất thứ cấp của vi sinh vật. Tuy nhiên, nồng độ oxy hòa tan quá cao sẽ có thể gây stress cũng như quá trình oxy hóa ở sinh vật nhân sơ từ đó ức chế sinh trưởng và quá trình trao đổi chất của vi sinh vật [165]
Đối với chủng RB.DS29: Mật độ vi khuẩn có sự khác biệt giữa các nghiệm thức
và dao động từ 103 x106 CFU/ml – 613,33 x106 CFU/ml (bảng 3.22). Tốc độ lắc 150 vòng/ phút có mật độ vi khuẩn đạt cao nhất gấp 2,79 lần đến 5,95 lần so với tốc độ lắc 0 vòng/phút, 100 vòng/phút, 200 vòng/ phút và 250 vòng/phút.
Đối với chủng RB.CJ41: Khi đánh giá mật độ vi khuẩn với tốc độ lắc khác nhau có sự khác biệt về mặt thống kê giữa các nghiệm thức. Mật độ vi khuẩn vi khuẩn đạt cao nhất ở tốc độ lắc 150 vòng/phút (793,33 x106 CFU/ml) gấp từ 1,11 lần đến 2,26 lần so với các tốc độ lắc còn lại (bảng 3.22).
Đối với chủng RB. EK7: Mật độ vi khuẩn có sự khác biệt có ý nghĩa thống kê ở mức p<0,01 giữa các nghiệm thức. Mật độ vi khuẩn đạt từ 101 x106 CFU/ml - 742x106 CFU/ml (bảng 3.22). Mật độ vi khuẩn cao nhất ở tốc độ lắc 150 vòng/phút đạt 742,00 x106 CFU/ml gấp 1,21 lần 7,35 lần so với ở tốc độ lắc 0 vòng/phút, 100 vòng/phút, 200 vòng/ phút và 250 vòng/phút.
Bảng 3.22. Ảnh hưởng của tốc độ lắc đến sinh trưởng của chủng RB.DS29, RB.CJ41 và RB.EK7
Mật độ VK (x106 CFU/ml) | |||
Chủng RB.DS29 | Chủng RB.CJ41 | Chủng RB.EK7 | |
0 | 103,00±6,24c | 357,33 ± 7,02cd | 101,00±21,07d |
100 | 134,00±22,72c | 403,00±14,80c | 322,00±45,03c |
150 | 613,33±69,60a | 793,33±16,65a | 742,00±12,12a |
200 | 220,00±6,93b | 664,00±26,23b | 611,00±25,87b |
250 | 120,00±48,87bc | 324,6±5,03d | 328,00±13,11c |
CV% | 6,24 | 3,37 | 6,39 |
P | ** | ** | ** |
Ghi chú: ** Khác biệt có ý nghĩa thống kê ở mức p<0,01; Các chữ cái giống nhau trên cùng một cột thể hiện sự khác biệt không có ý nghĩa thống kê theo trắc nghiệm phân hạng Duncan’s Multiple Rang Test.
Kết luận: Chủng RB.DS29 sinh trưởng và phát triển tốt nhất trong môi trường LB có pH 7, thời gian nhân giống 24 giờ, lên men 8 giờ, nhiệt độ là 35oC, tốc độ lắc 150 vòng/phút; Chủng RB.CJ41 sinh trưởng và phát triển tốt nhất trong môi trường có thành phần D-glucose 2 g/l; MgSO4 0,5 g/l; Cao thịt 5g/; Pepton 3 g/l;, (NH4)2SO4 4 g/l;, pH 6,5, thời gian nhân giống 36 giờ, lên men 6 giờ, nhiệt độ 37oC, tốc độ lắc 150 vòng/phút; Chủng RB.EK7 sinh trưởng và phát triển tốt nhất trong điều kiện môi trường M2 (D-glucose 2 g/l, Pepton 3 g/l, (NH4)2SO4 4 g/l, cao nấm men 5g/l, KH2PO4
6 g/l), pH 7, thời gian nhân giống 24giờ, thời gian lên men 10 giờ, nhiệt độ 37oC, tốc độ lắc 150 vòng/phút.
Như vậy, chủng RB.DS29, RB.CJ41 và RB.EK7 được nuôi cấy trong điều kiện thích hợp đã được khảo sát với mỗi chủng ở các nghiên cứu tiếp theo bao gồm nghiên cứu xác định đặc tính kháng Phytophthora, Fusarium, tuyến trùng Meloidogyne và nghiên cứu sản xuất chế phẩm vi khuẩn vùng rễ phòng trừ bệnh rễ trên cây hồ tiêu với mật độ cao theo thời gian bảo quản.
3.2.2. Xác định đặc tính kháng Phytophthora, Fusarium của chủng vi khuẩn tuyển chọn
Các chủng RB.DS29, RB.CJ41 được tuyển chọn có khả năng kháng Phytophthora và Fusarium từ các kết quả sàng lọc trong in vitro, in vivo. Tuy nhiên, cơ chế kháng nấm bệnh của các chủng này theo con đường nào cần tiếp tục nghiên cứu để làm sáng tỏ. Theo các nghiên cứu thì các chủng vi khuẩn có hoạt tính kháng nấm thường liên quan đến hoạt tính enzyme ngoại bào như protease, chitinase và beta glucanase và các hợp chất bay hơi hoặc không bay hơi kháng nấm [134]. Vì vậy, các chủng này tiếp tục được nghiên cứu sâu hơn để làm sáng tỏ cơ chế kháng Phytophthora và Fusarium.
3.2.2.1. Xác định đặc tính kháng Phytophthora của chủng vi khuẩn tuyển chọn
* Ảnh hưởng của dịch nuôi cấy vi khuẩn có bổ sung bào tử Phytophthora, casein, chitin, β-glucan đến khả năng ức chế Phytophthora
Thành tế bào Phytophthora có chứa chitin, protein và tới 90% β-glucan nên sẽ bị các enzyme phân giải do vi khuẩn tổng hợp phá hủy. Mặt khác, việc bổ sung bào tử nấm có thể coi là chất cảm ứng để vi khuẩn tổng hợp enzyme và một số hợp chất khác. Việc so sánh dịch nuôi cấy khi bổ sung chitin, casein và β-glucan với dịch nuôi cấy bổ sung bào tử nấm để có cơ sở xác định đặc tính kháng do enzyme phân giải hay do nguyên nhân khác.
Kết quả bảng 3.23 cho thấy, trong điều kiện không bất hoạt các dịch nuôi cấy vi khuẩn, có sự khác biệt có ý nghĩa thống kê về hiệu suất đối kháng nấm bệnh giữa các nghiệm thức ở mức p<0,01. Nghiệm thức MT + bào tử Phytophthora có hiệu suất đối kháng nấm bệnh cao nhất (24,2%) gấp từ 1,32 đến 5,9 lần so với nghiệm thức MT+ chitin (16,7%), MT + β-glucan (10,7%), MT + casein (18,3%). Khi bất hoạt các dịch nuôi cấy bổ sung chất cảm ứng (100oC trong 1 giờ), hiệu suất đối kháng nấm bệnh của các nghiệm thức giảm từ 2,3% - 10,8% (MT + bào
tử Phytophthora). Điều này chứng tỏ, hoạt tính kháng Phytophthora của chủng RB.DS29 có thể do enzyme cũng như các hợp chất thứ cấp tác động.
Nghiên cứu của Lê Vũ Khánh Trang và công sự (2019) cũng chỉ ra rằng, hiệu lực kháng Phytophthora sp. gây bệnh sương mai trên cây cà chua của vi khuẩn Bacillus velezensis có thể là do các thành phần enzyme như protease, chitinase, glucanase, cellulase, lipase, amylase, cylase và các thành phần không phải enzyme có thể là một số hợp chất có hoạt tính kháng nấm như iturin, fengycin, siderophore bacillibactin [167].
Bảng 3.23. Khả năng ức chế nấm bệnh của các dịch nuôi cấy chủng RB.DS29
Hoạt tính enzyme protease (UI/ml) | Hoạt tính enzyme chitinase (UI/ml) | Hoạt tính enzyme β- glucanase (UI/ml) | HSĐK (%) dịch nuôi cấy không bất hoạt | HSĐK (%) dịch nuôi cấy bất hoạt | |
MT | - | - | - | 4,1±1,44d | 2,5±0,00b |
MT + bào tử Phytophthora | 0,08±0,01 | 2,74±0,05 | 0,03±0,01 | 24,2±0,76a | 10,8±0,76a |
MT + casein | 0,14±0,02 | - | - | 18,3±1,76b | 2,3±1,44b |
MT + chitin | - | 3,23±0,04 | - | 16,7±0,76b | 4,2±1,50b |
MT + β-glucan | - | - | 0,07±0,01 | 10,7±1,04c | 2,5±1,44b |
CV% | 10,7 | 18,5 | |||
P | ** | ** |
Ghi chú: HSĐK: hiệu suất đối kháng (%); MT: môi trường. Các chữ cái giống nhau trên cùng một cột thể hiện sự khác biệt không có ý nghĩa thống kê theo trắc nghiệm phân hạng Duncan’s Multiple Rang Test; ** Khác biệt có ý nghĩa thống kê ở mức p<0,01.
Kết quả phân tích tương quan giữa hoạt tính enzyme protease, chitinase và β- glucanase ở hình 3.15 cho thấy, có mối tương quan thuận giữa hoạt tính enzyme và hoạt tính đối kháng Phytophthora với hệ số tương quan lần lượt là R=0,589, R=0,644 và R=0,65 (P<0,05). Sản xuất các enzyme phân giải thành tế bào nấm là một trong những cơ chế kháng trực tiếp, phổ biến của vi khuẩn. Diby và Sarma (2005) chứng minh 5 chủng Pseudomonas fluorescens and Trichoderma sp. từ vùng rễ cây hồ tiêu có khả năng đối kháng Phytophthora capsici bằng cơ chế tổng hợp enzyme β-1,3- glucanases, β-1,4-glucanases, lipases phân hủy thành tế bào nấm, ngoài ra còn có các enzyme khác như Peroxidase (PO), Catalase, Phenylalanine Ammonia Lyase (PAL) and Poly Phenol Oxidase (PPO) [168]. Wiratno và cộng sự (2019) đã phân lập được 10 chủng vi khuẩn nội sinh rễ cây hồ tiêu (Piper nigrum L.) trong đó có 9 chủng an
toàn đối với thực vật và động vật có vú [169]. Khả năng ức chế nấm Fusarium oxysporum của các chủng này đạt 18,6 - 43,7% và tuyến trùng Meloidogyne incognita đạt 16,6 - 65,8%. 7 chủng có hoạt tính enzyme chitinase và 4 chủng có hoạt tính enzyme protease [169].
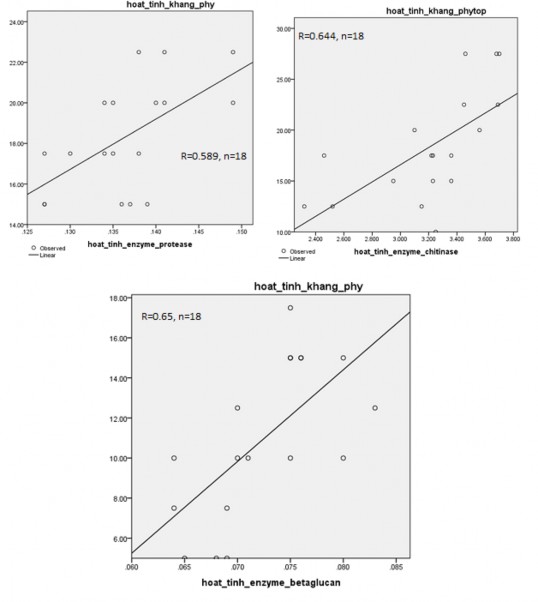
Hình 3.15. Mối tương quan giữa hoạt tính enzyme và hoạt tính kháng Phytophthora
Bên cạnh đó, việc tổng hợp các hợp chất có khả năng kháng nấm cũng là một cơ chế kháng quan trọng. Nghiên cứu của Özyilmaz và Benlioglu (2013) đã phân lập được 11 chủng Pseudomonas từ rễ của cây ớt, dâu tây, cải bắp, súp lơ, bông cải xanh, đậu và củ cải ở các khu vực trồng trọt chính của tỉnh Aydin của Thổ Nhĩ Kỳ [170]. Trong đó có 10 chủng hòa tan Ca3(PO4)2, 11 chủng sản xuất hợp chất indolic L- tryptophan in vitro. Trong 11 chủng Pseudomonas kiểm tra khả năng tổng hợp HCN, sáu chủng bao gồm 6ba2, 3ss9, 6L10, ke, 3k9, 6L14 có khả năng tổng hợp HCN cao.






![Ảnh Hưởng Của Hexahydropyrrolo [1,2-A] Pyrazine-1,4-Dione Đến Tỷ Lệ Tử Vong Của Tuyến Trùng Và Tỷ Lệ Nở Của Trứng Tuyến Trùng](https://tailieuthamkhao.com/uploads/2022/12/28/tuyen-chon-nghien-cuu-dac-tinh-khang-tac-nhan-gay-benh-va-tao-che-pham-18-120x90.jpg)