Chương 2 VẬT LIỆU VÀ PHƯƠNG PHÁP
2.1. HÓA CHẤT VÀ THIẾT BỊ
2.1.1. Hóa chất
Thuốc thử Folin – Merck, Đức. Tyrosin – Merck, Đức.
Casein – Merck, Đức. Albumin – Merck, Đức.
Dung dịch Citrat Natri 1%: cân chính xác 1g Citrat Natri pha với nước cất thành 100ml.
Dung dịch Na2HPO4 1/15M: cân chính xác 5.9690g Na2HPO4.12H2O hòa tan trong nước cất và định mức cho đủ 250ml.
Dung dịch KH2PO4 1/15M: cân chính xác 0.9072g KH2PO4 hòa tan trong nước cất và định mức lại cho đủ 100ml.
Dung dịch đệm Sorosen 1/15M, pH 7.6: trộn chung 177ml dung dịch Na2HPO4 1/15M và 23ml dung dịch KH2PO4 1/15M.
Dung dịch casein 1%: đun sôi cách thủy 1g casein trong dung dịch đệm
Sorensen cho đến khi tan hoàn toàn rồi định mức lại cho đủ 100ml.
Dung dịch TCA 5%: hòa tan 5g TCA trong nước cho đủ 100ml. Dung dịch NaOH 0.5N: hòa tan 10g NaOH trong nước cho đủ 500ml.
Dung dịch HCl 0.2N: trộn 4.25ml HCl đậm đặc với nước cho đủ 250ml. Dung dịch Tyrosin 20 mM/l: khuấy nghiền 1.8119 Tyrosin trong dung dịch
HCl 0.2N vừa đủ 500ml.
Dung dịch Tyrosin chuẩn 1mM/l trong dung dịch HCl 0.2N: pha loãng 5ml dung dịch Tyrosin 20mM/l trong dung dịch HCl 0.2N thành 100ml.
Nhựa đu đủ lấy mẫu tại thị trấn Xuyên Mộc - tỉnh Bà Rịa Vũng Tàu.
Bánh dầu đậu phộng lấy mẫu tại chợ Lái Thiêu.
2.1.2. Thiết bị
Máy quang phổ UV Aglient 8453.
Máy đông khô chân không Christ, Alpha 1- 2 Ldplus
Cùng các thiết bị khác của phòng thí nghiệm : máy ly tâm, máy khuấy từ gia
nhiệt...
2.2 PHƯƠNG PHÁP THỰC HIỆN
2.2.1 Phương pháp trích nhựa đu đủ từ trái[3, 8, 11, 16, 10, 20]
Quả: lấy ở những quả đang còn xanh, vỏ quả mịn, có trọng lượng từ 0.3-1 kg là tốt nhất. Quả non quá cho ít nhựa, quả quá già hoặc quả to vừa cho nhựa ít, vừa không sánh sệt, hoạt tính enzyme không cao. Quả có vỏ sần sùi, chia thùy cũng cho ít nhựa. Để thu enzyme có hoạt tính cao nhất, nên lấy nhựa ở quả đang độ 10 tuần tuổi.
Thời gian lấy nhựa: sáng sớm, kết thúc vào giữa buổi sáng (giai đoạn có độ ẩm không khí cao). Khi độ ẩm không khí thấp, dòng nhựa chảy chậm và đặc rất khó thu nhận.
Mùa khô: nhựa ít, đặc, nồng độ protein cao
Mùa mưa: nhựa nhiều, loãng, nồng độ protein thấp Tiến hành
Nhựa đu đủ lấy ở quả xanh còn ở trên cây
Dùng dao inox có đầu nhọn rạch vài đường dọc theo quả ở chỗ đường kính quả to nhất, các lát khía cách nhau 3-5cm (không rạch sâu quá 2cm, nếu không dịch nước và tinh bột từ quả sẽ trộn lẫn vào nhựa và làm giảm chất lượng nhựa thu được).
Hứng lấy nhựa chảy ra bằng lọ thủy tinh màu miệng rộng trong 4 – 6 phút, sau khi lấy nhựa xong đậy nắp kín và bảo quản lạnh, giữ trong tối nhằm tránh không cho nhựa tiếp xúc lâu với không khí và để bảo đảm hoạt tính của papain có trong nhựa.
Khi lấy nhựa cần lau sạch trái nhằm tránh không cho chất bẩn hoặc côn trùng lẫn vào.
Không nên trộn nhựa khô với nhựa tươi vì nó làm giảm chất lượng nhựa.

Hình 2.1 Cách lấy nhựa đu đủ
Quả có thể được rút nhựa trong suốt khoảng thời gian từ 4 – 7 ngày. Lần đầu tiên có thể chỉ cần một rạch là đủ, ở những lần thu nhựa sau, rạch 2 – 3 đường giữa những đường rạch trước đó.
Khi tiến hành các thao tác với nhựa tươi, tránh không cho nhựa tiếp xúc vào da vì dễ gây bỏng. Đồng thời cũng không nên để nhựa tiếp xúc với các dụng cụ làm từ kim loại nặng như sắt, đồng, …để tránh làm biến màu và giảm hoạt tính enzyme. Lọ, dao, muỗng,… phải được làm bằng nhựa hoặc thép không rỉ.
Nhựa tươi không bền vì thế nên đông khô chân không ngay sau khi thu nhận, nhựa đông khô được bảo quản trong tủ lạnh để tiến hành các nghiên cứu.
2.2.2 Phương pháp thu nhận papain tinh khiết[8, 18, 23, 28, 40, 42, 44]
Trong thành phần của nhựa đu đủ tươi ngoài enzyme papain, chymopapain còn có một số loại enzyme, protein, chất nhựa, chất cao su, chất béo,… và các tạp chất khác. Để có được quy trình tách và làm sạch papain từ nhựa đu đủ có hiệu quả thì phải có quy trình hòa tan nhựa đu đủ, mục đích là để loại bỏ các chất cặn, nhựa, tạp lớn.
Trộn 180g nhựa đu đủ khô với 100g celite và 150g cát sạch, nghiền kỹ trong cối ở nhiệt độ phòng với 200-300ml dung dịch cysteine 0.04M (hòa tan 6.3g cysteine hydrochloride trong 1000ml dung dịch NaOH 0.054M, kiềm được sử dụng để đưa pH dịch chiết tới 5.7). Khi dịch nhựa tạo thành thể huyền phù, gạn bỏ lớp nổi ở trên. Quá trình nghiền và trích được lặp lại với 300ml dung dịch cysteine. Sau đó rửa cối với dung dịch cysteine để điều chỉnh thể tích lên 1000ml. Dịch huyền phù sau cùng được lọc lạnh (có thể hút nhẹ) trên giấy lọc Whatman số 1. Thời gian lọc phụ thuộc vào nhựa khô được sử dụng và quá trình này có thể rất chậm. Nước lọc có màu trắng sữa hoặc vàng xanh, pH gần 5.7. Các bước còn lại của quá trình
tinh sạch enzyme được tiến hành trong điều kiện lạnh.[25, 27, 28]
2.2.2.1 Loại bỏ các chất không tan ở pH 9.
Dịch chiết thu được ở trên được điều chỉnh lên pH 9 bằng cách thêm từ từ và khuấy đều một lượng khoảng 110ml dung dịch NaOH 1M. Tủa xám tạo thành có thể được loại ra bằng lọc hoặc ly tâm ở 4000rpm trong 30 phút. Dịch trích ở giai đoạn này phải trong do các tủa gây biến tính protein đã được loại bỏ.
2.2.2.2 Quá trình phân đoạn bằng amonium sulfate
Cho amonium sulfate vào dịch enzyme đến 40% độ bão hòa, sau 1-2 giờ, ly tâm ở 4000rpm. Thu nhận tủa, bỏ dịch lỏng hoặc có thể giữ lại để lấy chymopapain. Tủa được rửa một lần với 400-500ml dung dịch amonium sulfate 40% độ bão hòa.
2.2.2.3 Quá trình phân đoạn bằng NaCl
Hòa tan tủa trong 600ml dung dịch cysteine 0.02M (pH 7-7.5), tủa papain tạo thành khi thêm từ từ 60g NaCl rắn. Sau một giờ, ly tâm ở 4000rpm trong 40 phút để thu tủa, bỏ dịch lỏng.
2.2.2.4 Kết tinh
Tủa được tạo thành dịch huyền phù với 400ml dung dịch cysteine 0.002M ở pH 6.5 và điều kiện nhiệt độ phòng. pH của dung dịch huyền phù được điều chỉnh lại đến 6.5 sau khi cho protein vào. Giữ ở nhiệt độ phòng trong 30 phút để tinh thể tạo thành, sau đó duy trì ở 4oC qua đêm, sau đó ly tâm lạnh ở 4000rpm trong 1 giờ để thu nhận tinh thể.
2.2.2.5 Tái kết tinh
Hòa tan tinh thể thu được ở giai đoạn kết tinh trong nước cất (tạo dung dịch có nồng độ protein khoảng 1%) ở nhiệt độ phòng. Sau đó cho vào từ từ (đồng thời khuấy đều) dung dịch NaCl bão hòa (10ml/300ml dung dịch protein). Khi 75% thể tích dung dịch NaCl đã cho vào, papain bắt đầu kết tinh ở nhiệt độ phòng. Dịch huyền phù được giữ ở 4oC qua đêm, sau đó ly tâm thu tủa. Hoạt độ riêng của
enzyme có thể tăng nhẹ nếu tiến hành tái kết tinh thêm một lần nữa như trên.
2.2.2.6 Đông khô chân không.
Tủa protein thu được đem đông khô chân không để loại bỏ nước. Protein sau khi đông khô chân không được bảo quản trong tủ lạnh để tiến hành các nghiên cứu tiếp theo.
Qui trình thu nhận papain tinh khiết có thể được tóm tắt lại theo sơ đồ
2.2
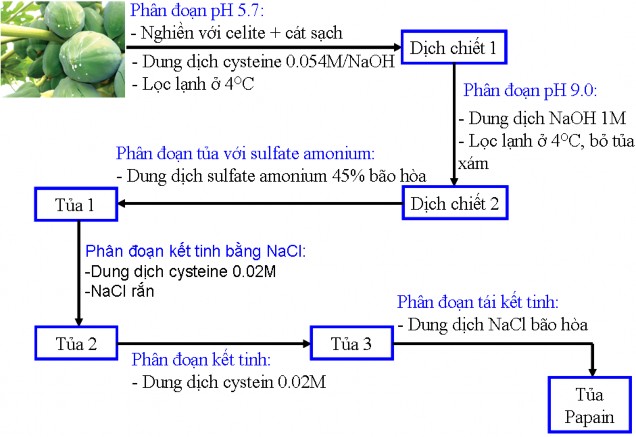
Hình 2.2 Sơ đồ thu nhận papain từ nhựa đu đủ đông khô
2.2.3 Xác định lượng protein theo phương pháp Lowry[1, 4, 12, 36]
Nguyên tắc
Hầu hết các protein đều có chứa tyrosin và tryptophan. Hàm lượng của những acid amin này tùy thuộc vào loại protein. Vì vậy, những protein cùng loại với nhau có hàm lượng các acid amin này giống nhau.
Khi cho protein tác dụng với thuốc thử Folin sẽ tạo thành một phức chất có màu. Cường độ màu của phức này tỉ lệ với hàm lượng tyrosin và tryptophan (cũng là hàm lượng protein). Vì thế ta có thể dùng phương pháp so màu để xác định hàm lượng protein.
Hóa chất
Dung dịch A: cân 2g Na2CO3 hòa tan trong NaOH N/10 thành 100ml.
Dung dịch B: cân 0.5g CuSO4.5H2O hòa tan trong Citrat Natri 1% tạo thành 100ml.
Dung dịch C (chỉ pha để dùng trong ngày): là hỗn hợp của hai dung dịch A và B được pha theo tỷ lệ 49:1.
Dung dịch Albumin 0.1%: cân chính xác đến 4 chữ số khoảng 0.1g albumin pha với nước cất thành 100ml.
Dựng đường chuẩn
Ta thực hiện đường chuẩn với một loại protein tinh khiết có sẵn, thường là albumin của bò đã đông khô. Tiến hành pha albumin có nồng độ khác nhau vào các ống nghiệm được đánh số từ 0 đến 5 như bảng bên dưới.
0 | 1 | 2 | 3 | 4 | 5 | |
Nồng độ protein mg/ml | 0 | 50 | 100 | 150 | 200 | 250 |
Dung dịch albumin 0.1% (ml) | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 |
Nước cất (ml) | 10 | 9.5 | 9.0 | 8.5 | 8.0 | 7.5 |
Có thể bạn quan tâm!
-
 Thu nhận Enzym Papain để ứng dụng vào phản ứng thủy phân Protein trong bánh dầu đậu phộng - 1
Thu nhận Enzym Papain để ứng dụng vào phản ứng thủy phân Protein trong bánh dầu đậu phộng - 1 -
 Thu nhận Enzym Papain để ứng dụng vào phản ứng thủy phân Protein trong bánh dầu đậu phộng - 2
Thu nhận Enzym Papain để ứng dụng vào phản ứng thủy phân Protein trong bánh dầu đậu phộng - 2 -
 Thành Phần Hóa Học Của Bã Đậu Phộng Đã Loại Béo
Thành Phần Hóa Học Của Bã Đậu Phộng Đã Loại Béo -
![Phương Pháp Xác Định Đạm Formol (Phương Pháp Sorensen)[1, 4]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Phương Pháp Xác Định Đạm Formol (Phương Pháp Sorensen)[1, 4]
Phương Pháp Xác Định Đạm Formol (Phương Pháp Sorensen)[1, 4] -
 Đường Chuẩn Biểu Diễn Sự Phụ Thuộc Của Mật Độ Quang Vào Nồng Độ Albumin.
Đường Chuẩn Biểu Diễn Sự Phụ Thuộc Của Mật Độ Quang Vào Nồng Độ Albumin. -
 Khảo Sát Sự Biến Đổi Hoạt Tính Của Các Chế Phẩm Theo Thời Gian.
Khảo Sát Sự Biến Đổi Hoạt Tính Của Các Chế Phẩm Theo Thời Gian.
Xem toàn bộ 96 trang tài liệu này.
Hút 0.4ml dung dịch protein có nồng độ khác nhau từ các ống nghiệm vừa pha ở trên theo thứ tự từ 1 đến 6 vào 6 ống nghiệm sạch khác. Thêm vào đó 2ml dung dịch C. Lắc đều và để yên ở nhiệt độ phòng trong 5 phút. Sau đó thêm vào 0,2ml thuốc thử Folin, lắc đều trong 5 – 10 phút, thêm nước cất cho đủ 5ml. Đem
đo mật độ quang (OD) ở bước sóng 750nm. Sau đó vẽ đường chuẩn biểu diễn sự biến thiên của mật độ quang (OD) theo nồng độ albumin chuẩn (mg/ml).
Xác định hàm lượng protein có trong mẫu:
Hút 0.4ml dung dịch protein cần xác định hàm lượng cho vào một ống nghiệm sạch và đã được sấy khô. Thêm vào đó 2ml dung dịch C. Lắc đều và để yên ở nhiệt độ phòng trong 5 phút. Sau đó, thêm vào 0.2ml thuốc thử Folin, lắc đều trong 5 – 10 phút, thêm nước cất vào cho đủ 5ml. Đem đo mật độ quang (OD) ở bước sóng 750nm. Dựa vào đường chuẩn để ngoại suy ra hàm lượng protein có trong mẫu nghiên cứu.
2.2.4 Xác định hoạt tính protein theo phương pháp Anson[1, 4]
Nguyên tắc
Casein bị phân giải trong môi trường kiềm dưới tác dụng của protease tạo thành sản phẩm là các đoạn peptid ngắn hòa tan trong tricloroacetic acid (TCA), xác định tyrosin và tryptophan hòa tan bởi thuốc thử Folin.
Dựng đường chuẩn Tyrosin
Ống nghiệm | ||||||
Dung dịch Tyrosin chuẩn (ml) | 1 | 2 | 3 | 4 | 5 | 6 |
Lượng Tyrosin tương ứng (M) | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
Dung dịch HCl 0.2N (ml) | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
Dung dịch NaOH 0.5N (ml) | 5.0 | 4.8 | 4.6 | 4.4 | 4.2 | 4.0 |
Lắc mạnh, sau 10 phút đo OD ở bước sóng 720nm | ||||||
Ống số 1 là ống thử không (TK), các ống còn lại là ống thí nghiệm (TT). Vẽ đường chuẩn Tyrosin tương quan giữa lượng Tyrosin (M) và độ hấp thu quang ở bước sóng 720nm.
Vẽ đường chuẩn Tyrosin tương quan giữa lượng Tyrosin (M) và OD.
Xác định lượng Tyrosin trong dung dịch nghiên cứu
Cân chính xác 0.1g mẫu protein hòa tan trong 100ml nước cất, tạo thành dung dịch protein có nồng độ 0.001g/ml.
Ống nghiệm | ||
1 | 2 | |
Dung dịch casein 1% (ml) | 5 | 5 |
Dung dịch TCA 5% (ml) | 0 | 10 |
Dung dịch enzyme mẫu (ml) | 1 | 1 |
Lắc đều và giữ ở 35.5oC | ||
Dung dịch TCA 5% (ml) | 10 | 0 |
Để yên 30 phút, lọc lấy dịch bên dưới | ||
Lấy 4 ống nghiệm mới, sạch, chia thành hai lô, mỗi lô hai ống để lấy trung bình đánh dấu A và B. Cho vào ống A 5ml dịch lọc từ ống nghiệm 1 và ống B 5ml dịch lọc từ ống nghiệm 2.
Thêm vào mỗi ống 10ml dung dịch NaOH 0.5N và 3ml thuốc thử Folin, lắc mạnh, sau 10 phút, đo OD ở bước sóng 660nm hoặc 720nm. Dựa vào đồ thị chuẩn để suy ra được M Tyrosin.
2.2.5 Xác định đạm tổng số theo phương pháp Kjeldahl[1, 4]
2.2.5.1 Nguyên tắc:
Chất đạm khi đem vô cơ hóa sẽ chuyển thành dạng ammonium sulfat, khi cho tác dụng với chất kiềm mạnh như NaOH sẽ phóng thích ra amoniac theo phương trình như sau:
(NH4)2SO4 + NaOH ---> 2NH3 + H2O + Na2SO4
Lượng amoniac phóng thích ra sẽ được hơi nước lôi cuốn bằng một dụng cụ là máy Parnas – Wargner và được dẫn đến một bình tam giác có chứa một lượng thừa H2SO4. Từ đây, cho phép chúng ta xác định được lượng amoniac phóng thích ra, có nghĩa là xác định hàm lượng đạm trong mẫu nguyên liệu.
2NH3 + H2O + H2SO4 ---> (NH4)2SO4 + H2O
2.2.5.2 Cách tính:
N = 1.4*V (mg/ml)
Trong đó:




![Phương Pháp Xác Định Đạm Formol (Phương Pháp Sorensen)[1, 4]](https://tailieuthamkhao.com/uploads/2023/06/13/thu-nhan-enzym-papain-de-ung-dung-vao-phan-ung-thuy-phan-protein-trong-banh-dau-5-1-120x90.jpg)

