3.4 PHƯƠNG PHÁP LOWRY XÁC ĐỊNH HÀM LƯỢNG PROTEIN
Kết quả đo mật độ quang ∆OD ở bước sóng 750nm của các ống nghiệm có nồng độ albumin từ 50 – 250mg/ml được trình bày trong bảng 3.3 (phụ lục 1)
Bảng 3.3. Mật độ quang của albumin ở bước sóng 750nm
01 | 02 | 03 | 04 | 05 | |
Nồng độ Albumin (mg/ml) | 50 | 100 | 150 | 200 | 250 |
Độ hấp thu quang OD (AU) | 0.0432 | 0.0648 | 0.1192 | 0.135 | 0.1942 |
Có thể bạn quan tâm!
-
 Thành Phần Hóa Học Của Bã Đậu Phộng Đã Loại Béo
Thành Phần Hóa Học Của Bã Đậu Phộng Đã Loại Béo -
![Phương Pháp Trích Nhựa Đu Đủ Từ Trái[3, 8, 11, 16, 10, 20]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Phương Pháp Trích Nhựa Đu Đủ Từ Trái[3, 8, 11, 16, 10, 20]
Phương Pháp Trích Nhựa Đu Đủ Từ Trái[3, 8, 11, 16, 10, 20] -
![Phương Pháp Xác Định Đạm Formol (Phương Pháp Sorensen)[1, 4]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Phương Pháp Xác Định Đạm Formol (Phương Pháp Sorensen)[1, 4]
Phương Pháp Xác Định Đạm Formol (Phương Pháp Sorensen)[1, 4] -
 Khảo Sát Sự Biến Đổi Hoạt Tính Của Các Chế Phẩm Theo Thời Gian.
Khảo Sát Sự Biến Đổi Hoạt Tính Của Các Chế Phẩm Theo Thời Gian. -
 Khảo Sát Phản Ứng Thủy Phân Ở Hàm Lượng Xúc Tác Là 0.25% So Với Cơ Chất Theo Thời Gian
Khảo Sát Phản Ứng Thủy Phân Ở Hàm Lượng Xúc Tác Là 0.25% So Với Cơ Chất Theo Thời Gian -
 Sự Phụ Thuộc Của Hiệu Suất Vào Thời Gian Phản Ứng Ở Ph 8.0 Và Hàm Lượng Xúc Tác Là 0.25%.
Sự Phụ Thuộc Của Hiệu Suất Vào Thời Gian Phản Ứng Ở Ph 8.0 Và Hàm Lượng Xúc Tác Là 0.25%.
Xem toàn bộ 96 trang tài liệu này.
Từ kết quả trên, vẽ đồ thị biểu diễn sự biến thiên của mật độ quang ∆OD (AU) theo nồng độ protein chuẩn (mg/ml) theo hình 3.2 với phương trình đường chuẩn là y = 0.0007x – 0.0004
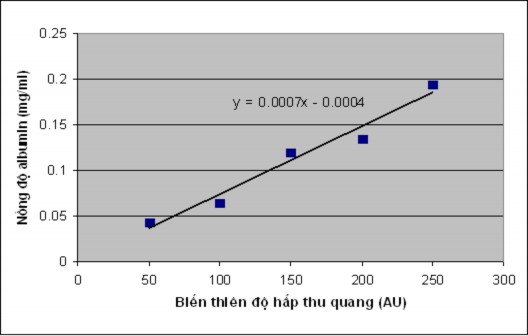
Hình 3.2. Đường chuẩn biểu diễn sự phụ thuộc của mật độ quang vào nồng độ albumin.
Cách tính
Từ phương trình đường chuẩn so sánh mật độ quang của ống nghiệm chứa mẫu protein. Từ đó suy ra nồng độ của protein trong nguyên liệu là x (mg/ml)
Hàm lượng protein M (có trong 1g nguyên liệu được tính theo công thức):
M x * 0.001* n
m
(mg/g)
với x: là nồng độ protein trong dung dịch đã pha loãng (mg/ml). n: hệ số pha loãng
m: khối lượng nguyên liệu lấy phân tích (g)
3.5 PHƯƠNG PHÁP ANSON XÁC ĐỊNH HOẠT TÍNH PROTEASE
Kết quả đo mật độ quang ∆OD ở bước sóng 720nm của các ống nghiệm có lượng tyrosin tương ứng từ 0.2 – 1.0M được trình bày trong bảng 3.4 (phụ lục 2) Bảng 3.4. Mật độ quang của tyrosin ở bước sóng 720nm
02 | 03 | 04 | 05 | 06 | |
Lượng tyrosin tương ứng (M) | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
Độ hấp thu quang OD(AU) | 0.1059 | 0.1812 | 0.3138 | 0.3464 | 0.4688 |
Đường chuẩn Anson
0.5
0.45
0.4
0.35
0.3
0.25
0.2
0.15
0.1
0.05
0
y = 0.4454x + 0.016
0 0.2 0.4 0.6 0.8 1 1.2
Lượng Tyrosin (mM )
Mật độ quang (AU)
Ống số 1 là ống thử không (TK), các ống còn lại là ống thí nghiệm (TT). Vẽ đường chuẩn Tyrosin tương quan giữa lượng Tyrosin (M) và biến thiên độ hấp thu quang ở bước sóng 720nm như hình 3.3 với phương trình đường chuẩn là y = 0.4454x + 0.016.
Hình 3.3. Đường chuẩn biểu diễn sự phụ thuộc của mật độ quang vào nồng độ tyrosin.
Cách tính
Định nghĩa đơn vị Anson: một đơn vị Anson là lượng enzyme tối thiểu trong điều kiện chuẩn (35.5oC, pH 7.6 …) thủy phân casein trong 1 phút tạo thành sản phẩm hòa tan trong TCA, phản ứng với thuốc thử Folin cho ta độ hấp thu OD ở bước sóng 660nm tương ứng với 1M Tyrosin trong đường chuẩn.
Hđ P = Tyrosin*V*L(UI) t*m*v
với
Hđ P: hoạt tính protein (UI)
V: tổng thể tích hỗn hợp trong ống nghiệm 1 hoặc 2 (ml). v: thể tích dịch lọc đem phân tích (ml).
t: thời gian thủy phân (phút)
m: khối lượng mẫu enzyme đem xác định hoạt tính (g) L: độ pha loãng mẫu enzyme.
M Tyrosin: lượng M Tyrosin trong v (ml) suy ra từ đường chuẩn.
3.6 KHẢO SÁT LƯỢNG ENZYME THU ĐƯỢC SAU CÁC GIAI ĐOẠN TINH CHẾ.
Trong quá trình tinh chế enzyme chúng tôi tiến hành khảo sát lượng protein thu được sau mỗi phân đoạn bằng cách lấy ra 0,1g dung dịch enzyme, sau đó định mức thành100ml bằng nước cất để xác định hàm lượng protein theo phương pháp Lowry. Kết quả được trình bày trong bảng 3.5 với cách tính như sau:
Thế giá trị mật độ quang ∆OD ở mỗi phân đoạn vào phương trình đường chuẩn xác định hàm lượng protein theo phương pháp Lowry là y = 0.0007x – 0.0004 ta suy ra được nồng độ protein trong dung dịch đã pha loãng là x. Sau đó, áp dụng công thức
M x * 0.001* n
m
(mg/g)
với x: là nồng độ protein trong dung dịch đã pha loãng (mg/ml). n: hệ số pha loãng
m: khối lượng nguyên liệu lấy phân tích (g)
để tính lượng protein trong nguyên liệu là M (mg/g).
Bảng 3.5. Lượng protein thu được ở các phân đoạn tinh chế khác
300
250
247.71
199.14
200
184.86
179.14
174.86
162.00
150
100
50
0
pH 5.7
pH 9
(NH4)2SO4
NaCl
Kết tinh Tái kết tinh
Các giai đoạn tinh chế
nhau.
∆OD | M (mg/g) | Phụ lục | |
Phân đoạn pH 5.7 | 0.173 | 247.71 | 3 |
Phân đoạn pH 9.0 | 0.139 | 199.14 | 4 |
Phân đoạn tủa với ammonium sulfat | 0.129 | 184.86 | 5 |
Phân đoạn bằng NaCl | 0.125 | 179.14 | 6 |
Phân đoạn kết tinh | 0.123 | 174.86 | 7 |
Phân đoạn tái kết tinh | 0.113 | 162.00 | 8 |
Lượng protein (mg/g)
Hình 3.4 Đồ thị biểu diễn sự biến thiên lượng protein sau mỗi giai đoạn tinh chế.
Nhận xét:
Từ bảng số liệu và biểu đồ trên ta nhận thấy rằng, trong quá trình tinh chế enzyme bằng phương pháp tủa muối thì hàm lượng protein trong mẫu giảm dần. Điều này có thể được giải thích như sau: lượng protein ban đầu cao là do trong nhựa khô chưa tinh chế ngoài papain còn có nhiều protein khác, sau mỗi giai đoạn tinh chế thì protein tạp được loại bỏ dần làm cho hàm lượng protein cũng giảm theo.
3.7 KHẢO SÁT HOẠT TÍNH CỦA ENZYME SAU CÁC GIAI ĐOẠN TINH CHẾ
Trong quá trình tinh chế enzyme ngoài việc khảo sát lượng protein thu được sau mỗi phân đoạn, chúng tôi cũng tiến hành đồng thời việc khảo sát hoạt tính protein ở mỗi giai đoạn tinh chế với cách thực hiện như sau:
Cân 0.1g mẫu protein ở mỗi giai đoạn tinh chế định mức thành 100ml dung dịch bằng nước cất. Cho vào mỗi ống nghiệm 1ml dung dịch protein đã pha loãng và các dung dịch khác như sau
Ống nghiệm | ||
1 | 2 | |
Dung dịch casein 1% (ml) | 5 | 5 |
Dung dịch TCA 5% (ml) | 0 | 10 |
Dung dịch enzyme mẫu (ml) | 1 | 1 |
Lắc đều và giữ ở 35.5oC | ||
Dung dịch TCA 5% (ml) | 10 | 0 |
Để yên 30 phút, lọc lấy dịch bên dưới | ||
Lấy 2 ống nghiệm mới, sạch đánh dấu A và B. Cho vào ống A 5ml dịch lọc từ ống nghiệm 1 và ống B 5ml dịch lọc từ ống nghiệm 2.
Thêm vào mỗi ống 10ml dung dịch NaOH 0.5N và 3ml thuốc thử Folin, lắc mạnh, sau 10 phút, đo ∆OD1 và ∆OD2 ở bước sóng 720nm từ đó dựa vào đồ thị chuẩn để suy ra được M Tyrosin.
Hoạt tính protein được xác định theo phương pháp Anson. Kết quả được trình bày trong bảng 3.6 với cách tính như sau:
Thế giá trị y = (∆OD1 - ∆OD2) vào phương trình đường chuẩn xác định hoạt tính theo Anson y = 0.4454x + 0.016 ta suy ra được x chính là lượng tyrosin. Từ giá trị của x ta tính được hoạt tính protease theo công thức:
Hđ P = Tyrosin*V*L(UI) t*m*v
với
Hđ P: hoạt tính protein (UI)
V: tổng thể tích hỗn hợp trong ống nghiệm 1 hoặc 2 (ml). v: thể tích dịch lọc đem phân tích (ml).
t: thời gian thủy phân (phút)
m: khối lượng mẫu enzyme đem xác định hoạt tính (g) L: độ pha loãng mẫu enzyme.
M Tyrosin: lượng M Tyrosin trong v (ml) suy ra từ đường chuẩn.
Bảng 3.6. Hoạt tính protease của enzyme sau các giai đoạn tinh chế
∆OD1 | ∆OD2 | P(UI/ml) | Tỉ lệ hoạt tính sau mỗi giai đoạn tinh chế (%) | Phụ lục | |
Nhựa khô ban đầu | 0.308 | 0.012 | 70.353 | 9 | |
Phân đoạn pH 5.7 | 0.264 | 0.063 | 66.46 | 94.47 | 10 |
Phân đoạn pH 9.0 | 0.150 | 0.035 | 57.39 | 81.57 | 11 |
Phân đoạn tủa với ammonium sulfat | 0.372 | 0.185 | 49.30 | 70.08 | 12 |
Phân đoạn bằng NaCl | 0.240 | 0.074 | 45.60 | 64.81 | 13 |
Phân đoạn kết tinh | 0.115 | 0.055 | 36.36 | 51.68 | 14 |
Phân đoạn tái kết tinh | 0.097 | 0.062 | 36.78 | 55.34 | 15 |
90
80
70
60
50
40
30
20
10
0
57.39
49.30
45.60
36.36
36.78
pH 5.7 pH 9 (NH4)2SO4 NaCl Kết tinh Tái kết tinh
Các giai đoạn tinh chế
66.46
Series
1
Hoạt tính protease (UI)
Hình 3.5. Sự biến thiên hoạt tính của protein sau các giai đoạn tinh chế.
Qua bảng số liệu và đồ thị, ta nhận thấy rằng trong quá trình tinh chế enzyme bằng phương pháp tủa muối thì hoạt tính protein trong mẫu giảm dần. Nguyên nhân có thể là do ban đầu nhựa khô ngoài chứa enzyme papain ra còn chứa những enzyme khác có chức năng bảo vệ papain nên hoạt tính cao, sau khi qua những giai đoạn tinh chế tiếp theo đã loại bỏ hầu hết những protein tạp chỉ còn lại papain tinh khiết nên dẫn đến hoạt tính protein cũng giảm theo. Sau phân đoạn kết tinh, sản phẩm đem đi kết tinh lại thì độ tinh sạch của sản phẩm cao hơn dẫn đến hoạt tính protein tăng lên đôi chút.
3.8 KHẢO SÁT SỰ BIẾN ĐỔI LƯỢNG PROTEIN TRONG CÁC CHẾ PHẨM PROTEASE THU ĐƯỢC THEO THỜI GIAN
Nhằm đánh giá tính ổn định của mỗi chế phẩm, chúng tôi tiến hành khảo sát sự biến đổi hàm lượng protein của mỗi chế phẩm theo thời gian.
Cân chính xác 0.10 gam các chế phẩm thu được bằng các phương pháp khác nhau sau khi đã đông khô, cho vào bình định mức 100ml. Thêm nước cất đến vạch định mức, sau đó lắc đều đến khi chế phẩm tan hoàn toàn. Các chế phẩm này được bảo quản ở 4oC để dùng dần. Hút 0,4ml dung dịch protein đã pha ở trên để tiến hành xác định lượng protein cho mỗi lần thí nghiệm Thời gian tiến hành thí nghiệm là 5 ngày. Kết quả được trình bày trong bảng 3.7 (phụ lục 16 -19):
M0 M1 M2
M3
250
220
190
160
130
100
1
2
3
Ngày khảo sát
4
5
Bảng 3.7. Hàm lượng protein của các chế phẩm theo thời gian
∆OD | Hàm lượng protein (mg/g) | |||||||
M0 | M1 | M2 | M3 | M0 | M1 | M2 | M3 | |
1 | 0.155 | 0.112 | 0.115 | 0.110 | 222.00 | 160.57 | 164.86 | 157.71 |
2 | 0.136 | 0.141 | 0.101 | 0.109 | 199.14 | 202.00 | 144.86 | 156.29 |
3 | 0.142 | 0.124 | 0.162 | 0.131 | 203.43 | 177.71 | 232.00 | 187.71 |
4 | 0.135 | 0.116 | 0.133 | 0.122 | 193.43 | 166.29 | 190.57 | 174.86 |
5 | 0.125 | 0.106 | 0.133 | 0.116 | 179.14 | 147.71 | 190.57 | 169.14 |
Lượng protein (mg/g)
Hình 3.6. Đồ thị biểu diễn sự biến thiên hàm lượng protein theo thời gian
Trong đó:
M0: mẫu nhựa đu đủ tươi được đem đông khô
M1: mẫu enzyme thu được bằng phương pháp tủa với ammonium sulfate sau khi đông khô.
M2: mẫu enzyme thu được bằng phương pháp tủa bằng ethanol sau khi đông
khô.


![Phương Pháp Trích Nhựa Đu Đủ Từ Trái[3, 8, 11, 16, 10, 20]](https://tailieuthamkhao.com/uploads/2023/06/13/thu-nhan-enzym-papain-de-ung-dung-vao-phan-ung-thuy-phan-protein-trong-banh-dau-4-1-120x90.jpg)
![Phương Pháp Xác Định Đạm Formol (Phương Pháp Sorensen)[1, 4]](https://tailieuthamkhao.com/uploads/2023/06/13/thu-nhan-enzym-papain-de-ung-dung-vao-phan-ung-thuy-phan-protein-trong-banh-dau-5-1-120x90.jpg)


