thay thế nước ngọt. Đồng thời nước thải từ hệ thống cống rãnh có thể ngấm xuống đất
mang theo các sinh vật gây bệnh và nhiều hoá chất độc hại do các nhà máy thải ra.
Các yếu tố gây ô nhiễm nước Do các chất hữu cơ phân hủy
Các chất hữu cơ tháo vào sông hồ có nguồn gốc từ thực vật như xác cây cỏ, hoa quả, các chất mùn. Nguyên tố cơ bản của chất bẩn là carbon. Các chất hữu cơ có nguồn gốc động vật do các chất thải của con người như nước chế biến thức ăn, nước tắm giặt, nước từ các nhà tiêu tự hoại, nước thải của các nhà máy chế biến thực phẩm, lò giết mổ, trại chăn nuôi v.v. Nguyên tố cơ bản trong chất bẩn là nitơ. Các loại vi khuẩn hoại sinh trong nước đóng vai trò chính trong việc phân huỷ các chất hữu cơ thành các chất vô cơ vô hại, đồng thời cũng làm tăng thêm lượng vi khuẩn trong 1 đơn vị thể tích nước.
Trong nước bị ô nhiễm ít, hàm lượng oxy hoà tan trong nước ở trên mức giới hạn cho phép, các chất hữu cơ sẽ được phân huỷ bởi các vi khuẩn hiếu khí để tạo thành các sản phẩm cuối cùng như nitrat sulphat, phosphat, CO2 … Khi nguồn nước bị ô nhiễm nặng và liên tục bởi các chất hữu cơ, hàm lượng oxy hoà tan trong nước giảm xuống còn rất thấp, quá trình phân huỷ các chất hữu cơ do các vi khuẩn yếm khí đảm nhiệm và tạo thành các sản phẩm trung gian, làm cho nước có mùi hôi, màu đen, xuất hiện các khí thối như H2S, NH3, CH4 và aldehyd.
Để đánh giá mức độ nhiễm bẩn trong nước bởi các chất hữu cơ, người ta thường
dùng các chỉ số sau:
Nồng độ oxy hoà tan trong nước.
Nhu cầu oxy về hoá học (COD).
Nhu cầu oxy về hoá sinh học (BOD).
Trong đó:
DO là lượng oxy hoà tan trong nước cần thiết cho sự hô hấp của các sinh vật sống trong nước như cá, lưỡng cư, động thực vật thuỷ sinh, côn trùng... DO thường được tạo ra do sự hoà tan oxy từ khí quyển hoặc do quang hợp của tảo. Nồng độ oxy hoà tan trong nước thường nằm trong khoảng 8-10 ppm. Tuy nhiên, nồng độ này thay đổi phụ thuộc vào nhiệt độ, sự phân huỷ các chất và sự quang hợp của tảo… Khi nồng độ DO thấp, các loài sinh vật sống trong nước giảm hoạt động hoặc thậm chí có thể bị
chết. Do vậy, DO là một chỉ số quan trọng để đánh giá sự ô nhiễm nước của các thủy vực.
BOD (biological oxygen demand) là lượng oxy cần thiết để vi sinh vật oxy hoá các chất hữu cơ theo phản ứng
Vi khuẩn
![]()
Chất hữu cơ +O2 CO2 + H2O + Tế bào mới + Sản phẩm trung gian Trong môi trường nước, khi quá trình oxy hoá sinh học xảy ra thì các vi sinh vật
sử dụng oxy hoà tan, vì vậy xác định tổng lượng oxy hoà tan cần thiết cho quá trình phân huỷ sinh học là phép đo quan trọng đánh giá ảnh hưởng của một dòng thải đối với nguồn nước. BOD cho ta biết lượng chất thải hữu cơ trong nước có thể bị phân huỷ bằng các vi sinh vật.
COD (chemical oxygen demad) là lượng oxy cần thiết để oxy hoá các hợp chất hoá học trong nước bao gồm cả vô cơ và hữu cơ. Như vậy, COD là lượng oxy cần thiết để oxy hoá toàn bộ các chất hoá học trong nước, trong khi đó BOD là lượng oxy cần thiết để oxy hoá một phần các hợp chất hữu cơ dễ phân huỷ bởi vi sinh vật.
Toàn bộ lượng oxy sử dụng cho các phản ứng trên được lấy từ oxy hoà tan trong nước (DO). Do đó, nếu nhu cầu oxy hoá học và oxy sinh học cao thì sẽ làm giảm nồng độ oxy hoà tan trong nước, có hại cho sinh vật sống trong nước và hệ sinh thái nước nói chung. Nước thải sinh hoạt, nước thải công nghiệp và nông nghiệp là các tác nhân làm gia tăng giá trị BOD và COD của môi trường nước.
Do các yếu tố sinh học
Nước là môi trường trung gian truyền bệnh, đặc biệt là các bệnh đường ruột và gây ra các vụ dịch lớn như vụ tả Hăm Buốc năm 1892 có 18.000 người bị bệnh và làm chết 8.605 người, tại Xanh-Petécbua năm 1908 có 20.835 người mắc bệnh và làm chết
4.000 người. Nguyên nhân chính là do nước bị nhiễm phẩy khuẩn tả.
Từ năm 1845 đến 1935 đã có 124 vụ dịch thương hàn và phó thương hàn. Năm 1965, vụ dịch thương hàn ở Mỹ có 16.000 mắc bệnh và người ta đã tìm thấy vi khuẩn thương hàn trong nước máy của thành phố. Nhiều công trình nghiên cứu khoa học đã tìm thấy vi khuẩn lỵ, vi khẩn gây bệnh ỉa chảy ở trẻ em, các vi khuẩn Leptospira và Tularensia, vi khuẩn đường ruột, virus viêm gan v.v. Nước còn bị nhiễm bẩn bởi các loại ký sinh trùng như amíp, trứng giun sán các loại. Con người có thể mắc bệnh ký
sinh trùng khi dùng nước không sạch. Bảng 3.2 trình bày các sinh vật gây bệnh chính
sống trong nước.
Bảng 4.2. Các sinh vật gây bệnh chính sống trong nước
Tầm quan trọng tới sức khỏe con người | Thời gian sống sót trong đường cung cấp nước | Khả năng kháng lại clo | Liều gây nhiễm tương đối | Tầm quan trọng của động vật trong việc chứa vi sinh vật gây hại | |
Vi khuẩn | |||||
Campylobacter jejuni, E. coli | Cao | Trung bình | Thấp | Trung bình | Có |
E. coli gây bệnh | Cao | Trung bình | Thấp | Cao | Có |
Salmonella typhi | Cao | Trung bình | Thấp | Cao | Không |
Các loài Salmonella sp | Cao | Dài | Thấp | Cao | Có |
Shigella spp. | Cao | Ngắn | Thấp | Trung bình | Không |
Vibrio cholera | Cao | Ngắn | Thấp | Cao | Không |
Yersinia enterocolitica | Cao | Dài | Thấp | Cao | Có |
Pseudomona aeruginosa | Trung bình | Có thể nhân lên | Trung bình | Cao | Không |
Aeromonas spp. | Trung bình | Có thể nhân lên | Thấp | Cao | Không |
Virus | |||||
Các Adenovirus | Cao | Dài | Trung bình | Thấp | Không |
Virus đường ruột | Cao | Trung bình | Thấp | Không | |
Virus viêm gan A | Cao | Trung bình | Thấp | Không | |
Virus viêm gan E | Cao | Thấp | Không | ||
Virus Norwalk | Cao | Trung bình | Không | ||
Rotavirus | Cao | Trung bình | Không | ||
Virus tròn nhỏ | Trung bình | Thấp | Không | ||
Động vật nguyên sinh | |||||
Entamoeba histolytica | Cao | Trung bình | Cao | Thấp | Không |
Giardia intestinalis | Cao | Trung bình | Cao | Thấp | Có |
Cryptosporidium parvum | Cao | Dài | Cao | Thấp | Có |
Giun sán | |||||
Dracunculus medinensis | Cao | Trung bình | Trung bình | Thấp | Có |
Có thể bạn quan tâm!
-
 Các Chất Ônkk Và Những Ảnh Hưởng Của Chúng
Các Chất Ônkk Và Những Ảnh Hưởng Của Chúng -
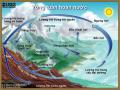
 Vòng Tuần Hoàn Nước Trong Tự Nhiên
Vòng Tuần Hoàn Nước Trong Tự Nhiên -
 Mối Liên Quan Giữa Chất Lượng Nước Và Sức Khỏe Con
Mối Liên Quan Giữa Chất Lượng Nước Và Sức Khỏe Con -
 Kiểm Soát Ô Nhiễm Nước Và Quản Lý Chất Lượng Nước
Kiểm Soát Ô Nhiễm Nước Và Quản Lý Chất Lượng Nước -
 Giải Pháp Chiến Lược Để Kiểm Soát Chấn Thương Ở 3 Giai Đoạn Khác
Giải Pháp Chiến Lược Để Kiểm Soát Chấn Thương Ở 3 Giai Đoạn Khác -
 An Toàn Môi Trường Trong Các Hoạt Động Vui Chơi, Giải Trí
An Toàn Môi Trường Trong Các Hoạt Động Vui Chơi, Giải Trí
Xem toàn bộ 116 trang tài liệu này.

Do các yếu tố hóa học
Nguồn nước gây ra ô nhiễm nước bởi các chất hóa học chủ yếu là do chất thải công nghiệp, đặc biệt là ngành công nghiệp hoá chất. Chất độc hoá học vào nước làm cho nước có màu sắc, mùi vị khó chịu, ảnh hưởng rất lớn đến quá trình tự làm sạch tự nhiên của nước, có hại đến hệ thống sinh vật sống trong nước bị tiêu diệt hoặc di chuyển nơi sinh sống, tiêu diệt hoặc làm giảm các nguồn thuỷ sản làm thức ăn cho con người và gia súc, ảnh hưởng xấu tới chất lượng nước ngầm, nước bề mặt, đó là nguồn cung cấp nước cho cộng đồng. Có tới 55.000 hợp chất hoá học thải vào môi trường xung quanh. Những ngành công nghiệp tháo nước thải có chứa các chất hoá học phải kể đến ngành công nghiệp khai thác, chế biến dầu mỏ, công nghiệp luyện kim màu, luyện kim đen, công nghiệp sản xuất hoá chất nói chung và hoá chất trừ sâu diệt cỏ, các bột giặt.
Ngoài các chất hoá học do con người thải vào môi trường thì nước còn bị ô nhiễm bởi các nguồn tự nhiên. Một ví dụ rất điển hình là ô nhiễm arsen trong nước ngầm. Tổ chức Y tế Thế giới mô tả thực trạng ô nhiễm arsen tại Bangladesh là một thảm họa môi trường lớn nhất từ trước tới nay. Ở quốc gia đứng đầu khu vực châu Á về số lượng giếng khoan bơm tay này hiện đã có khoảng 35 đến 77 triệu người có nguy cơ bị nhiễm độc. Ở Việt Nam, theo một số nghiên cứu mới được thực hiện tại một số tỉnh đồng bằng Sông Hồng, sông Cửu Long cho thấy nồng độ arsen trong nước ngầm đã vượt quá nhiều lần tiêu chuẩn cho phép của Bộ Y tế và của WHO. Tại một số điểm lấy mẫu ở đồng bằng Sông Hồng có tới 80% mẫu vượt quá tiêu chuẩn của WHO.
Ngoài các tác nhân ô nhiễm môi trường nêu trên người ta còn quan tâm tới sự ô
nhiễm nước bởi nhiệt độ và các chất phóng xạ.
IV. XỬ LÝ NƯỚC VÀ KIỂM SOÁT Ô NHIỄM NƯỚC
4.1.Lọc nước
Để đảm bảo nước ăn uống và sinh hoạt đạt tiêu chuẩn vệ sinh, nước cần phải được xử lý trước khi sử dụng. Cần phải lọc sạch nước nếu dùng nước sông để cung cấp nước uống. Hệ thống lọc ở các nhà máy nước có mục đích làm cho nước mất các chất đục và trở nên trong, đồng thời cũng cải thiện các tính chất lý học (như màu sắc) và giảm đi một phần vi sinh vật. Nước sông thường có rất nhiều chất đục vì dòng nước lôi theo đất cát ở lòng sông và hai bên bờ.
Nếu các chất lơ lửng trong nước hơi nặng hoặc to thì có thể làm trong ở các bể lắng sơ bộ. Nhưng nếu có những hạt keo nhỏ (như đất sét) làm đục nước, thì không thể làm lắng cặn trong một thời gian ngắn được mà cần phải sử dụng chất keo tụ để tăng nhanh quá trình này.
a. Làm đông tụ
Muốn làm cho nước mất hết các hạt nhỏ, người ta áp dụng phương pháp làm đông tụ. Làm đông tụ là phương pháp liên kết các hạt phân tán trong nước thành từng đám. Các dung dịch keo có tính ổn định là nhờ các hạt có mang điện tích.
Các hạt lơ lửng trong n ư ớ c thiên nhiên có điện tích âm là do tính chất hoá học của nó. Các hạt keo thường là SiO2 có điện tích âm nhờ sự phân ly của các phân tử H2SiO3. Các hạt đất sét lơ lửng trong nước chủ yếu là aluminium silicat có nhiều điện ly âm nên có điện tích âm. Các chất mùn (humus) ở trong nước thiên nhiên cũng có điện tích âm vì nó có nhiều acid humic có nhiều điện ly âm.
Nếu cho chất làm đông tụ vào nước (hoá chất, điện cực, chất điện tích) thì trong nước sản sinh một hỗn dịch keo gồm các hạt có điện tích dương. Lúc đó, các hạt này cùng các hạt làm đục nước tự nhiên tác dụng lẫn nhau. Điện tích âm dương của chúng trung hoà nhau, hút nhau và ngưng tụ thành từng đám. Khi các đám ngưng tụ lắng xuống đáy, chúng sẽ kéo theo các chất lơ lửng khác trong nước.
Người ta dùng các hoá chất dưới đây để làm đông tụ: Nhôm sulfate: Al2(SO4)3.10H2O.
Sắt sulfate: Fe2(SO4)3.
Sắt (III) clorid: FeCl3.
Khi cho nhôm sulfate vào nước sẽ phát sinh các phản ứng hoá học sau đây: nhôm sunfate sẽ thuỷ phân và đồng thời tạo thành muối calci.
![]()
Al2(SO4)3 + 3Ca(O H )2 + 6 H2O 2Al(OH)3 + 3CaSO4 + 6H2O
Al(OH)3 sản sinh một dung dịch keo mà các hạt có điện tích dương làm trung hoà các hạt có điện tích âm của nước đục. Đối với nước có tính kiềm, ít nhất cần phải cho thêm vôi tôi Ca(OH)2 vào nước trước khi cho chất làm đông.
Việc lọc trong nước thực hiện bằng các phương pháp sau đây:
- Làm đông rồi làm lắng hoặc làm lắng ngay.
- Lọc.
Làm lắng ngay thường chỉ có thể áp dụng với nước cung cấp cho các xí nghiệp.
Đối với nước cung cấp cho nhân dân cũng có thể làm lắng ngay nếu nước chỉ hơi đục. Thời gian làm lắng lâu ít nhất 2-3 giờ. Ở các nhà máy nước thường dùng nước sông, bao giờ cũng làm đông tụ rồi làm lắng.
b. Bể lắng: làm lắng thực hiện ở các bể chứa. Tuỳ theo tính chất chuyển động
của nước, người ta phân biệt hai loại bể lắng: bể ngang và bể đứng.
Bể lắng ngang: dùng ở các nhà máy phải cung cấp nhiều nước (trên 40.000 m3 mỗi ngày). Bể đào ở trong đất, xây bằng bê tông cốt sắt hình chữ nhật, dài 10 - 30 m, rộng 5 -15 m và sâu 2 - 6 m; tốc độ nước chảy là 10- 12 mm/giây (5mm/giây) nếu làm lắng ngay.
Bể lắng đứng: là những bể xây bằng bê tông cốt sắt hình trụ (đường kính 6 - 8 m; bề cao 3-5 m). Nước nguồn chuyển động từ dưới lên trên, với tốc độ 0,5 - 0,75 mm/giây. Các bể lắng này dùng ở các nhà máy có lưu lượng vừa hoặc nhỏ.
c. Bể lọc: sau khi qua bể lắng, nước còn có khá nhiều hạt nhỏ cho nên cần phải
lọc để được trong hẳn. Có hai loại bể lọc:
Bể lọc chậm: tốc độ lọc không quá 10 cm/giờ. Trong một tháng, nước lọc qua cát các chất lơ lửng, các vi sinh vật và vi khuẩn lắng thành váng ở trên cát; hiện nay ít khi dùng bể lọc chậm.
Bể lọc nhanh: tốc độ lọc cao tới 3 - 5 m/giờ. Là những bể bằng bê tông cốt sắt, đựng đầy cuội, cát xếp riêng thành lớp cao tất cả 0,7 - 0,9 m. Bể có hai đáy, đáy trên có lỗ thủng. Từ đáy lên trên có các lơp sau đây: cuội to ở dưới, cát nhỏ ở trên. Tốc độ lọc là 8 m/giờ.
Nước chảy từ bể lắng vào rãnh, rồi lọc qua lớp cát, lớp sỏi và theo ống chảy sang bể chứa nước sạch. Các hạt lơ lửng đọng lại ở trên các hạt cát thành một váng lọc. Cần phải mất 10 - 15 phút để váng này hình thành. Dần dần các chất này đọng lại sẽ làm bẩn bể lọc, cho nên ít lâu lại phải rửa sạch bằng cách cho nước sạch chảy ngược chiều các lớp lọc với tốc độ 10 - 15 lít mỗi m2/giây. Cát, cuội sẽ được rửa sạch bùn.
Hiện nay người ta chỉ xây những bể lọc nhanh. Gần đây, người ta xây một kiểu mới để đồng thời làm lắng và lọc, gọi là bể lọc tiếp xúc. Bể lọc tiếp xúc là một bể bằng bê tông cốt sắt đựng cát. Nước tới phía dưới bể chảy qua các lớp cát hạt nhỏ dần và đá lọc trong khi lên bề mặt. Tốc độ của dòng nước là 4,5 - 5,5 m/giờ hay 1,25 - 1,55
mm/giây.
4.2. Khử chất sắt trong nước
Một số mạch nước ngầm có nhiều sắt (tới vài chục mg/lít), chất sắt dù có rất ít trong nước uống cũng ảnh hưởng không tốt tới mùi, vị, màu sắc và độ trong. Theo tiêu chuẩn vệ sinh thì nồng độ sắt ở trong nước uống không được quá 0,3 mg/lít. Trong thực tế, nếu sắt trong nước nguồn quá 1 mg/lít thì phải khử chất sắt. Nguyên lý của sự khử chất sắt căn cứ theo sự biến đổi của sắt hoá trị 2 thành sắt hoá trị 3 và có khả năng kết tủa.
Cách khử sắt khác nhau, tuỳ theo tính chất hoá học của sắt. Khử sắt sẽ dễ nếu sắt ở trong nước dưới hình thái bicarbonate Fe(HCO3)2 vì bicarbonate không bền và dễ thuỷ phân trong nước:
![]()
![]()
Fe(HCO3)2 + 2H2O Fe(OH)2 + 2H2CO3 H2CO3 H2O + CO2
Fe(OH)2 bị oxy hoá khi tiếp x ú c với oxy của không khí thành Fe(OH)3.
![]()
4Fe(OH)2 + H2O + O2 4Fe(O H )3 + 2Fe2O3 ![]() + 6H2O
+ 6H2O
![]()
2Fe(O H )3 Fe2O3 ![]() + H2O
+ H2O
Bể lọc và bể lắng dùng sau khi khử sắt cũng giống các bể dùng để lọc nước.
4.3. Làm mất mùi và dư vị
Nước uống phải không có mùi. Mùi lạ dù nhẹ cũng khó chịu, cho dù nước có
thành phần hoá học tốt và không truyền bệnh. Nước có mùi lạ vì:
+ Có H2S (nhất là trong nước ngầm).
+ Có nhiều thực vật sống ở trong nước (nhất là nước hồ ao).
+ Có lẫn nước bẩn kỹ nghệ (hoá hợp hữu cơ), các chất này hoá hợp với chất Clo cho thêm vào nước uống.
Do vậy, cần thiết phải làm mất mùi nước dùng cho mục đích ăn uống và sinh hoạt. Tùy theo nguồn gốc của nước mà người ta sử dụng các phương pháp khác nhau để khử mùi của nước.
Làm thoáng khí nước để khử H2S bằng cách tăng diện tích tiếp xúc với không khí, phun nước; làm nước chảy lắt léo thành lớp mỏng trên các tấm ván hoặc thổi không khí nén qua lớp nước. H2S hoà tan trong nước sẽ bay ra không trung, nhờ sự
chênh lệch giữa áp lực riêng phần giữa không khí và H2S hoà tan. Nếu nguồn gốc của
H2S là sinh vật sống ở trong nước thì loại bỏ nó đi. Nếu nước có H2S vì có lẫn nước bẩn kỹ nghệ thì chế hoá nước bằng đồng sulfate, rồi bằng than hoạt tính có khả năng hút rất cao. Cách tốt nhất là cho thêm than bột vào nước, trước khi nước chảy vào bể lắng hay bể lọc. Than bột sẽ đọng thành váng trên cát của bể lọc và hút hết các chất làm nước có mùi, màu và dư vị.
Cách làm mất mùi bằng Clo cũng r ấ t tốt. Các liều lượng Clo thấp sẽ hoà hợp với các chất hữu cơ và sinh vật mùi lạ và dư vị. Liều lượng Clo cần thiết phải tính thử trong phòng thí nghiệm. Cần nhớ rằng nước chế hoá bằng clo sẽ có mùi khó chịu nếu nước chỉ có vết phenol. Phenol dù pha rất loãng (10 triệu lần) cũng sinh với clo các hoá hợp có mùi, vị không thể chịu được. Nước thiên nhiên không có phenol, nguồn gốc của nó là nước thải công nghiệp. Cách hợp lý nhất để tránh phenol là cấm thải nước bẩn công nghiệp vào các nguồn nước uống. Nếu không thể được sẽ phải dùng tới amoniac. Clo sẽ hoà hợp với amoniac để sinh chloramin và sẽ không có clorophenol. Tuy vậy, amoniac không thể làm mất mùi đã có sẵn.
4.4.Giảm độ cứng của nước
Giảm độ cứng của nước là giảm nồng độ của muối calci và magiê trong nước.
Có hai cách thông dụng để giảm độ cứng:
+ Giảm độ cứng bằng hoá chất: xử lý nước bằng các chất hoá hợp với các điện ly Ca++ và Mg++ thành các hợp chất không hoà tan. Thông thường người ta thường xử lý nước bằng các dung dịch vôi hoặc sôđa. Vôi tôi Ca(OH)2 phản ứng với Ca(HCO3)2 hay Mg(HCO3)2 để sinh ra carbonat không hoà tan.
![]()
![]()
Ca(HCO3)2 + Ca(OH)2 2 CaCO3 + 2 H2O
Đối với muối không phải là c a r b o n a t sẽ có phản ứng sau đây:
![]()
![]()
Ca SO4 + Na2CO3 Ca CO3 + Na2SO4
Với các hoá chất, người ta đã giảm được độ cứng của nước xuống 4o và 6o
+ Giảm bằng cách trao đổi các điện ly: lọc nước qua các chất đặc biệt ví dụ chất zeolithes có điện ly Na+ và H+. Các điện ly Na+ và H+ sẽ thay thế các điện ly Ca2+ và Mg2+ trong nước cứng. Các chất trao đổi điện ly âm của nó gọi là cation, các chất trao điện ly dương của nó gọi là anion. Các phản ứng hoá học xảy ra ở trên mặt chất zeolithes. Các lượng tương đương điện ly trao đổi với nhau: tình trạng cân bằng có rất