* Tính các giá trị nồng độ Cti theo công thức (2.1) và độ chệch các điểm nồng độ khi xây dựng đường chuẩn theo công thức (2.2), từ kết quả tính đánh giá đường chuẩn phân tích tổng Mn và đường chuẩn phân tích tổng Cr.
* Để xác định giá trị LOD, LOQ của đường chuẩn phân tích tổng Mn trong lá chè, chuẩn bị song song 14 dung dịch Mn 0,1 mg/L trong HNO3 1%. Đối với phân tích tổng Cr trong lá chè, chuẩn bị song song 14 dung dịch Cr 2,0 µg/L trong môi trường HNO3 0,5%. Phân tích nồng độ Mn, Cr trong 14 mẫu trên sử dụng đường chuẩn phân tích tổng Mn, tổng Cr đã xây dựng. Tính giá độ lệch chuẩn theo công thức (2.3), LOD theo công thức (2.4) và LOQ theo công thức (2.5).
2.4.3. Xây dựng và đánh giá đường chuẩn CPE phân tích dạng Mn, Cr
2.4.3.1. Xây dựng đường chuẩn CPE phân tích dạng Mn, Cr
Chiết điểm mù các dung dịch chuẩn Mn nồng độ lần lượt là: 0,1; 0,5; 1,0; 2,0 mg/L; 3,0; 4,0 và 5,0 mg/L trong điều kiện tối ưu đã khảo sát. Mẫu trắng được tiến hành tương tự như mẫu chuẩn nhưng thay dung dịch chuẩn Mn bằng nước cất.
Đo độ hấp thụ của Mn bằng phương pháp FAAS ở bước sóng 279,5nm. Kết quả xây dựng đường chuẩn CPE phân tích dạng Mn trong nước chè được trình bày trong 3.2.3.
Chiết điểm mù các dung dịch chuẩn Cr với các nồng độ lần lượt là: 6, 12, 18, 24 và 36 µg/L trong điều kiện tối ưu đã khảo sát. Mẫu chuẩn được tiến hành trong điều kiện tương tự nhưng thay dung dịch chuẩn Cr bằng nước cất 2 lần.
Đo độ hấp thụ của Cr bằng phương pháp GFAAS ở bước sóng 357,9nm. Kết quả xây dựng đường chuẩn CPE phân tích dạng Cr trong nước chè được trình bày trong 3.2.4.
2.4.3.2. Đánh giá giới hạn chấp nhận của đường chuẩn và tính giới hạn phát hiện (LOD), giới hạn định lượng (LOQ)
* Tính các giá trị nồng độ Cti theo công thức (2.1) và độ chệch các điểm nồng độ khi xây dựng đường chuẩn theo công thức (2.2), từ kết quả tính đánh giá đường chuẩn phân tích dạng Mn, Cr bằng chiết điểm mù.
* Xác định giá trị LOD và LOQ của đường chuẩn CPE phân tích dạng Mn trong nước chè bằng cách CPE song song 14 dung dịch Mn 0,1mg/L. Đo độ hấp thụ của Mn bằng kỹ thuật FAAS. Đối với đường chuẩn CPE phân tích dạng Cr, tiến hành CPE song song 14 dung dịch Cr(III) 2,0 µg/L, phân tích Cr trong mẫu chiết bằng kỹ thuật GFAAS. Tính giá độ lệch chuẩn theo công thức (2.3), LOD theo công thức (2.4) và LOQ theo công thức (2.5).
2.5. Các điều kiện đo Mn, Cr trên máy AAS ZEEnit 700
2.5.1. Điều kiện đo FAAS đối với Mn
Lựa chọn phân tích hàm lượng Mn trong mẫu chè bằng kỹ thuật FAAS vì qua khảo sát mẫu bằng phương pháp ICP-MS hàm lượng Mn trong chè Mn cao. Mặt khác, Mn có nhiệt độ bay hơi không cao nên nhiệt độ ngọn lửa khi đốt hỗn hợp axetilen/không khí phù hợp cho quá trình nguyên tử hóa. Các điều kiện phân tích mẫu đã được khảo sát để tối ưu hóa đối với phép phân tích Mn, tiến hành đối với dung dịch mẫu chuẩn Mn(II) 1,0 mg/L thu được kết quả trình bày trong bảng 2.3.
Bảng 2.3. Các điều kiện tối ưu phép đo FAAS đối với Mn
Thông số | Đơn vị | Giá trị | |
1 | Vạch phổ | nm | 279,5 |
2 | Độ rộng khe đo | nm | 0,2 |
3 | Cường độ đèn HCL Mn | mA | 7,0 |
4 | Cường độ đèn HCL D2 | mA | 5,0 |
5 | Chiều cao đầu đốt | mm | 6 |
6 | Tốc độ C2H2/không khí | L/giờ | 90 |
7 | Tốc độ hút mẫu | mL/phút | 4,0 |
Có thể bạn quan tâm!
-
 Điều Kiện Tự Nhiên Và Kinh Tế - Xã Hội Của Khu Vực Nghiên Cứu
Điều Kiện Tự Nhiên Và Kinh Tế - Xã Hội Của Khu Vực Nghiên Cứu -
 Hệ Thống Quang Phổ Hấp Thụ Nguyên Tử Tử Aas Zeenit 700
Hệ Thống Quang Phổ Hấp Thụ Nguyên Tử Tử Aas Zeenit 700 -
 Vị Trí Thu Hái Các Mẫu Chè Tại Xã Tà Xùa, Huyện Bắc Yên
Vị Trí Thu Hái Các Mẫu Chè Tại Xã Tà Xùa, Huyện Bắc Yên -
 Sự Ảnh Hưởng Của Ph Đối Với Cpe Cr(Iii) Thuốc Thử 8-Hq
Sự Ảnh Hưởng Của Ph Đối Với Cpe Cr(Iii) Thuốc Thử 8-Hq -
 Sự Ảnh Hưởng Của Nồng Độ Tx-100 Đến Hiệu Suất Chiết Cr(Iii)
Sự Ảnh Hưởng Của Nồng Độ Tx-100 Đến Hiệu Suất Chiết Cr(Iii) -
 Sự Ảnh Hưởng Của Nồng Độ Nacl Đến Hiệu Suất Cpe Mn(Ii)
Sự Ảnh Hưởng Của Nồng Độ Nacl Đến Hiệu Suất Cpe Mn(Ii)
Xem toàn bộ 175 trang tài liệu này.
2.5.2. Các điều kiện đo GFAAS đối với Cr
Theo kết quả khảo sát sơ bộ mẫu chè bằng phương pháp ICP-MS, hàm lượng Cr cỡ µg/kg do đó chọn kỹ thuật GFAAS có độ nhạy cao để định lượng Cr. Mặt khác, Cr là nguyên tố có nhiệt độ nóng chảy và bay hơi cao nên phân tích bằng kỹ thuật GFAAS đảm bảo yêu cầu nhiệt độ để nguyên tử hóa mẫu phân tích. Khảo sát các điều
kiện đo phổ Cr bằng kỹ thuật GFAAS, tiến hành với dung dịch Cr(III) 20 µg/L theo nguyên tắc thay đổi từng thông số và cố định các thông số còn lại. Các điều kiện tối ưu của phép đo GFAAS đối với Cr được trình bày trong bảng 2.4.
Trong kỹ thuật phân tích Cr bằng kỹ thuật lò graphit, chương trình nhiệt độ là yếu tố quyết định đến kết quả của phép phân tích. Kết quả khảo sát chương trình nhiệt độ của phép phân tích Cr được trình bày trong bảng 2.5.
Bảng 2.4. Các điều kiện đo phổ GFAAS của Cr
Thông số | Đơn vị | Giá trị | |
1 | Vạch phổ | nm | 357,9 |
2 | Độ rộng khe đo | nm | 0,8 |
3 | Cường độ đèn HCL Cr | mA | 5,0 |
4 | Bổ chính nền bằng hiệu ứng Zeeman | ||
5 | Khí môi trường Ar | ||
6 | Chất cải biến nền dung dịch Mg(NO3)2 | % | 0,1 |
Bảng 2.5. Chương trình nhiệt độ đo phổ GFAAS của Cr
Thông số | Nhiệt độ (oC) | Tốc độ tăng nhiệt (oC/s) | Thời gian duy trì (s) | |
1 | Sấy khô | Bước 1: 90 | 5 | 20 |
Bước 2: 105 | 3 | 20 | ||
Bước 3: 110 | 2 | 10 | ||
2 | Tro hóa luyện mẫu | 950 | 250 | 10 |
3 | Auto zero | 950 | 0 | 6 |
4 | Nguyên tử hóa | 2450 | 5,8 | |
5 | Làm sạch cuvet | 2550 | 500 | 4 |
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Kết quả khảo sát các điều kiện tối ưu và xây dựng quy trình phân tích dạng Mn, Cr bằng phương pháp CPE-AAS
3.1.1. Khảo sát đồng thời giá trị pH và loại chất tạo phức
Tác nhân tạo phức là một trong những yếu tố quan trọng quyết định đến hiệu suất chiết điểm mù. Khả năng tạo phức lần lượt của 8- hydroxyquinoline (8-HQ) và 1-(2 pyridylazo)-2-naphtol (PAN) với Mn(II) và Cr(III) đã được khảo sát khi thay đổi giá trị pH, giữ nguyên các điều kiện khác. Sự ảnh hưởng của pH đã được nghiên cứu với các dung dịch đệm pH 4, 5, 6 (đệm axetat), 7, 8 (đệm photphat), 9, 10, 11 (đệm borat), 12 (đệm NaOH - KCl). Vì mixen chất hoạt động bề mặt bền trong môi trường trung tính và môi trường kiềm nên tiêu chí lựa chọn pH trong khoảng từ trung tính đến kiềm.
3.1.1.1. Phép chiết điểm mù Mn(II)
Mn(II) | + 2 | → |
| + 2H+ | (3.1) |
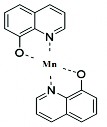
Mn(II) phản ứng với thuốc thử 8-HQ tạo thành phức tạo thành phức màu vàng [102]. Phản ứng tạo phức xảy ra theo phản ứng sau:
MnQ2 có
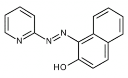
Đối với thuốc thử PAN, Mn(II) phản ứng tạo thành phức Mn(PAN)2 [103] theo phản ứng sau:
+ 2 |
| → |
| + 2H+ | (3.2) |
Các phản ứng tạo phức (3.1) và (3.2) phụ thuộc vào pH của dung dịch. Tiến hành khảo sát sự ảnh hưởng của pH đến quá trình tạo phức của Mn(II) và 8-HQ, PAN theo quy trình thí nghiệm như sau:
+ Hút 1,0 mL dung dịch chuẩn Mn(II) 2,0 mg/L trong nước cho vào ống ly tâm thủy tinh thể tích 10 mL. Tiếp theo thêm 2,0 mL dung dịch đệm pH với các giá
trị pH thay đổi từ 4 đến 12.
+ Thêm tiếp 1,0 mL dung dịch 8- HQ 4.10-3 M hoặc 1,0 mL dung dịch PAN 4.10-3 M. Thêm 1,0 mL dung dịch chất hoạt động bề mặt Triton X - 100 4%, thêm 1,0 mL dung dịch NaCl 5,0% để thúc đẩy quá trình tách pha tạo mixen của các phân tử chất hoạt động bề mặt theo cơ chế tách nước.
+ Định mức đến 10 mL bằng nước cất 2 lần, đun cách thủy trong bể ổn nhiệt ở 95oC trong 40 phút.
+ Sau đó, ly tâm 10 phút với tốc độ ly tâm 3500 vòng/phút, làm lạnh bằng cách ngâm vào nước đá 10 phút. Tách bỏ pha nước thu lấy pha nhớt, hòa tan pha nhớt bằng 1,0 mL dung dịch axit HNO3 0,1 M và phân tích nồng độ Mn sử dụng phương pháp FAAS bằng đường chuẩn đã xây dựng.
Từ đó xác định được hiệu suất chiết điểm mù bằng tỉ số nồng độ xác định được với nồng độ ban đầu. Tiến hành thí nghiệm 3 lần, hiệu suất chiết trung bình được trình bày trong bảng 3.1.
Bảng 3.1. Khảo sát đồng thời pH và chất tạo phức CPE Mn(II)
pH | Hiệu suất chiết (%) | ||
8-HQ | PAN | ||
1 | 4 | 0,9 ± 0,7 | 0 |
2 | 5 | 1,8 ± 0,2 | 0 |
3 | 6 | 65,5 ± 0,7 | 4,5 ± 1,6 |
4 | 7 | 84,3 ± 2,4 | 30,3 ± 2,3 |
5 | 8 | 88,1 ± 2,1 | 81,2 ± 2,5 |
6 | 9 | 96,8 ± 2,3 | 83,9 ± 2,7 |
7 | 10 | 97,8 ± 1,8 | 87,8 ± 1,2 |
8 | 11 | 95,3 ± 2,2 | 86,5 ± 1,8 |
9 | 12 | 93,1 ± 2,2 | 86,0 ± 1,7 |
Biểu diễn sự phụ thuộc của hiệu suất chiết Mn(II) trong trường hợp dùng thuốc thử 8-HQ khi thay đổi pH bằng đồ thị, thu được hình 3.1. Từ kết quả thu được, nhận thấy cation Mn(II) tạo phức tốt với 8-HQ khi giá trị pH ≥ 8, tại giá trị pH = 10 tối ưu cho phản ứng tạo phức. Kết quả này hoàn toàn phù hợp vì 8-HQ có pKa = 9,82 do đó môi trường pH = 10 chất tạo phức tồn tại dạng ion A- và khi đó Mn(II) không tạo phức hiđroxo nên thuận lợi cho quá trình tạo phức. Khi pH > 10 xảy ra quá trình tạo
phức hiđroxo của Mn(II), do đó hiệu suất chiết giảm.
100
80
60
40
20
pH
0
4
5
6
7
8
9 10 11 12
H (%)
S. Yalçin và cộng sự công bố quá trình CPE phản ứng tạo phức giữa Mn(II) với 8-HQ tối ưu khi pH ≥ 9 [88]. Trong nghiên cứu của M. A. Farajzadeh và cộng sự, chọn hệ đệm có pH = 7 làm môi trường cho phản ứng tạo phức giữa Mn(II) với 8- HQ, do đó hiệu suất chiết thấp trong khoảng 59,4% ÷ 70,9%. Nguyên nhân là do ở giá trị pH = 7 thuốc thử 8-HQ tồn tại ở dạng phân tử HA nên không thuận lợi cho phản ứng tạo phức. Khi đó Mn(II) không tạo phức hoàn toàn vẫn tồn tại một phần ở dạng tự do nên không bị chiết vào pha chất hoạt động bề mặt.
Hình 3.1. Sự ảnh hưởng của pH đối với CPE Mn(II) thuốc thử 8-HQ
C = 0,2 mg/L; C = 4.10- 4 M; C = 0,4%
Mn(II) 8-HQ TX-100
100
80
60
40
20
pH
0
4
5
6
7
8
9
10 11 12
H (%)
Sự phụ thuộc của hiệu suất chiết Mn(II) trong trường hợp sử dụng chất tạo phức PAN khi thay đổi giá trị pH môi trường được biểu diễn trong hình 3.2.
Hình 3.2. Sự ảnh hưởng của pH đối với CPE Mn(II) thuốc thử PAN
- 4
CMn(II) = 0,2 mg/L; CPAN = 4.10 M; CTX-100 = 0,4%
Thuốc thử PAN có giá trị pKa1 = 2,9 và pKa2 = 11,6 nên khi pH ≥ 10 là khoảng pH tối ưu cho phản ứng tạo phức giữa Mn(II) và PAN. So sánh kết quả khảo sát sự ảnh hưởng của pH tới quá trình chiết điểm mù với các nghiên cứu khác cho thấy có sự phù hợp. Giá trị pH =10 tối ưu cho quá trình tạo phức giữa Mn(II) và PAN cũng được xác nhận trong nghiên cứu của M. S. Arain và cộng sự [83].
Hiệu suất chiết điểm mù Mn(II) trong trường hợp dùng thuốc thử 8-HQ cao hơn so với hiệu suất chiết Mn(II) trong trường hợp dùng chất tạo phức PAN. Do đó, chúng tôi lựa chọn sử dụng thuốc thử 8-HQ trong phép chiết Mn(II).
3.1.1.2. Phép chiết điểm mù Cr(III)
Cr(III) phản ứng với 8-HQ tạo thành phức CrQ3 màu vàng [104] theo phản ứng 3.3.
+ 3 |
| → |
| + 3H+ | (3.3) |
Cation Cr3+ phản ứng với chất tạo phức PAN tạo thành phức Cr(PAN)2+ màu đỏ [105] theo phản ứng 3.4.
+ 2 |
| → |
| + 2H+ | (3.4) |
Qua khảo sát mẫu lá chè bằng phương pháp ICP - MS thu được kết quả hàm lượng tổng Cr trong lá chè trong khoảng 1,543 - 2,392 mg/kg, như vậy nồng độ Cr trong nước chè cỡ µg/L. Do đó, chúng tôi khảo sát tìm điều kiện tối ưu chiết điểm mù với mẫu chuẩn có nồng độ Cr cỡ µg/L.
Quy trình thí nghiệm như sau:
+ Hút 1,0 mL dung dịch chuẩn Cr(III) 20 µg/L cho vào ống ly tâm thủy tinh thể tích 10 mL, thêm 1,0 mL dung dịch đệm pH với các giá trị pH từ 4 ÷ 12. Thêm
tiếp 1,0 mL dung dịch 8-HQ 2.10-3 M hoặc 1,0 mL dung dịch PAN 2.10-3 M.
+ Thêm 1,0 mL dung dịch Triton X-100 2% và 1,0 mL dung dịch NaCl 5,0% để thay đổi lực ion và tăng quá trình tách nước của các phân tử chất hoạt động bề mặt. Định mức đến 10 mL bằng nước cất 2 lần, đun cách thủy trong bể ổn nhiệt ở 95oC trong 40 phút.
+ Sau đó, lấy ra ly tâm 10 phút với tốc độ ly tâm 3500 vòng/phút, làm lạnh bằng cách ngâm vào nước đá 10 phút để đông đặc pha giàu chất hoạt động bề mặt.
+ Tách bỏ pha nước thu lấy pha nhớt, hòa tan pha nhớt bằng 1,0 mL dung dịch axit HNO3 0,1 M trong CH3OH và định lượng Cr bằng GFAAS.
Từ đó xác định được hiệu suất chiết điểm mù bằng tỉ số nồng độ xác định được với nồng độ ban đầu. Kết quả hiệu suất chiết Cr(III) trung bình của 3 lần thí nghiệm được trình bày trong bảng 3.2.
Bảng 3.2. Khảo sát đồng thời pH và chất tạo phức CPE Cr(III)
pH | H (%) | ||
8 - HQ | PAN | ||
1 | 4 | 6,0 ± 1,0 | 2,4 ± 1,0 |
2 | 5 | 40,2 ± 1,2 | 31,2 ± 1,9 |
3 | 6 | 84,1 ± 1,8 | 72,4 ± 2,3 |
4 | 7 | 92,3 ± 1,6 | 80,8 ± 3,0 |
5 | 8 | 95,4 ± 1,9 | 86,5 ± 3,6 |
6 | 9 | 92,5 ± 2,1 | 84,1 ± 4,0 |
7 | 10 | 91,6 ± 1,9 | 86,5 ± 3,9 |
8 | 11 | 90,3 ± 2,6 | 83,8 ± 3,7 |
9 | 12 | 89,7 ± 2,4 | 82,6 ± 2,8 |
Hình 3.3 thể hiện sự phụ thuộc của hiệu suất chiết điểm mù Cr(III) vào thuốc chất tạo phức 8-HQ khi thay đổi giá trị pH môi trường. Từ hình 3.3 nhận thấy, môi trường axit pH < 7 không thuận lợi cho phản ứng tạo phức giữa Cr(III) với 8-HQ, khi đó cation Cr(III) tồn tại một phần ở dạng tự do và phức yếu nên không bị chiết vào pha mixen của chất hoạt động bề mặt. Sự tạo phức giữa Cr(III) với các thuốc thử 8-HQ tốt nhất tại pH = 8. Do đó, lựa chọn dung dịch đệm photphat pH = 8 là môi