NT Neutralization test (thử nghiệm trung hòa)
PHK Primary Hamster kidney (thận chuột Hamster tiên phát)
PreM Premium membrane (Protein tiền màng)
PRNT50 Plaque reduction neutralization test (Trung hòa giảm 50% đám hoại tử)
TCCS Tiêu chuẩn cơ sở
TCYTTG/WHO Word Health Organization (Tổ chức Y tế thế giới) THGĐHT Trung hòa giảm đám hoại tử
TNLS Thử nghiệm lâm sàng
TNMD Thử nghiệm miễn dịch
VNNB Viêm não Nhật Bản
VABIOTECH Công ty TNHH MTV vắc xin và sinh phẩm số 1
Có thể bạn quan tâm!
-
 Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 1
Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 1 -
 Dịch Tễ Học Phân Tử Của Vi Rút Viêm Não Nhật Bản
Dịch Tễ Học Phân Tử Của Vi Rút Viêm Não Nhật Bản -
 Sự Phát Triển Của Vắc Xin Viêm Não Nhật Bản Trên Tế Bào
Sự Phát Triển Của Vắc Xin Viêm Não Nhật Bản Trên Tế Bào -
 Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1
Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1
Xem toàn bộ 178 trang tài liệu này.
VERO Verda Reno (Tế bào thường trực thận khỉ xanh châu Phi) VX Vắc xin

vii
DANH MỤC CÁC BẢNG
Bảng 1. 1. Các loại vắc xin VNNB và công nghệ sản xuất hiện nay 12
Bảng 1. 2. Tỷ lệ mắc VNNB ở bệnh nhân VNVR năm 1991-2019 13
Bảng 2.1. Cỡ mẫu sử dụng trong nghiên cứu 35
Bảng 2. 2. Sinh phẩm sử dụng trong nghiên cứu 36
Bảng 2.3. Môi trường, hóa chất sử dụng trong nghiên cứu 37
Bảng 2.4. Trang thiết bị, vật tư tiêu hao sử dụng trong nghiên cứu 37
Bảng 2.5. Trang thiết bị, vật tư tiêu hao sử dụng trong nghiên cứu 38
Bảng 2.6. Chỉ tiêu nghiên cứu trên lô chủng gốc BV-MSV-0210 và lô chủng sản xuất BV-WSV-0310 39
Bảng 2.7. Chỉ tiêu nghiên cứu trên vắc xin JECEVAX 40
Bảng 2.8. Thông tin về trình tự vùng gen E của các chủng vi rút VNNB phân lập ở Việt Nam trong các năm khác nhau và từ các vật chủ khác nhau sử dụng trong nghiên cứu 45
Bảng 3.1. Kết quả nhận dạng của chủng gốc và chủng sản xuất bằng phương pháp ELISA 54
Bảng 3.2. Kết quả kiểm tra LD50 trên não chuột Swiss của chủng gốc BV- MSV-0210 56
Bảng 3.3. Kết quả kiểm tra LD50trên não chuột Swiss của chủng sản xuất BV- WSV-0310 56
Bảng 3.4. Kết quả kiểm tra hiệu giá chủng gốc BV-MSV-0210bằng thử nghiệm tạo đám hoại tử (PFU) trên tế bào BHK21 57
Bảng 3.5. Kết quả kiểm tra hiệu giá chủng sản xuất BV-WSV-0310 bằng thử nghiệm tạo đám hoại tử (PFU) trên tế bào BHK21 57
Bảng 3.6. Tỷ lệ tương đồng về nucleotide và protein gen mã hóa kháng nguyên E của chủng gốc (BV-MSV-0210) và chủng sản xuất (BV-WSV-0310) so với trình tự vùng gen E của các chủng virút VNNB phân lập ở Việt Nam trong các năm khác nhau và từ các vật chủ khác nhau 61
Bảng 3.7. Vị trí các epitope và vị trí của các axit amin quyết định tính kháng nguyên thuộc epitope protein E của chủng sản xuất (BV-WSV-0310), chủng tham chiếu (Beijing-1 Kanonji), chủng vi rút VNNB phân lập ở người năm 2014 và chủng vắc xin SA14-14-2. 62
viii
Bảng 3.8. Tính ổn định hiệu giá chủng gốcBV-MSV-0210 và chủng sản xuất BV- WSV-0310 khi bảo quản trong nitrogen lỏng 63
Bảng 3.9. Hiệu giá chủng sản xuất BV-WSV-0310 khi bảo quản ở -20oC 63
Bảng 3.10. Hiệu giá chủng sản xuất BV-WSV-0310 khi bảo quản ở 2-8oC 64
Bảng 3.11. Kết quả thử nghiệm vô trùng 64
Bảng 3.12. Kết quả kiểm tra Mycoplasma chủng gốc và chủng sản xuất 65
Bảng 3.13. Kết quả kiểm tra vi rút ngoại lai trên động vật thử nghiệm của chủng gốc và chủng sản xuất 65
Bảng 3.14. Kết quả kiểm tra vi rút ngoại lai trên tế bào của chủng gốc và chủng sản xuất ..66 Bảng 3.15. Kết quả kiểm tra an toàn chung trên chuột nhắt và chuột lang thí nghiệm của 10 lô vắc xin JECEVAX 67
Bảng 3.16. Kết quả kiểm tra chất gây sốt trên thỏ của 10 lô vắc xin JECEVAX 68
Bảng 3.17. Kết quả đánh giá cảm quan, tỷ trọng và vô trùng của 10 lô vắc xin JECEVAX 69
Bảng 3.18. Kết quả kiểm định các chỉ số hóa học của 10 lô vắc xin JECEVAX 69
Bảng 3.19. Kết quả đánh giá tính sinh miễn dịch (công hiệu/hiệu giá kháng thể trung hòa (HGKTTH)) của các lô vắc xin JECEVAX trên động vật thực nghiệm 70
Bảng 3.20. Kết quả nghiên cứu tiêu chuẩn chất lượng của chủng sử dụng để sản xuất vắc xin VNNB bất hoạt trên tế bào Vero tại Việt Nam 72
Bảng 3.21. Xây dựng tiêu chuẩn về số đời cấy chuyển, tế bào cấy chuyển và nhiệt độ bảo quản chủng gốc và chủng sản xuất 73
Bảng 3.22. Xây dựng tiêu chuẩn về tính ổn định di truyền và hiệu giá vi rút chủng gốc và chủng sản xuất 74
ix
DANH MỤC CÁC HÌNH VẼ, ĐỒ THỊ
Hình 1.1. Cấu trúc bộ gen của vi rút VNNB 5
Hình 1.2. Các tác nhân gây sốt 17
Hình 1.3. Một số vắc xin VNNB sản xuất từ chủng Beijing-1 22
Hình 1.4. Hình ảnh 1 số vắc xin VNNB sản xuất từ chủng SA14-14-2 24
Hình 1.5. Vắc xin VNNB bất hoạt sản xuất từ chủng 821564-XY 26
Hình 1.6. Sơ đồ thiết lập ngân hàng chủng gốc (BV-MSV-0210) và chủng sản xuất (BV-WSV-0310) 33
Hình 2.1. Hình ảnh ống chủng Beijing-1 và vắc xin JECEVAX 36
Hình 2.2. Sơ đồ nghiên cứu 38
Hình 2. 3. Quy trình giải trình tự gen E vi rút Viêm não Nhật Bản 44
Hình 3.1. Kết quả giải trình tự gen và xây dựng cây phả hệ dựa trên trình tự nucleotide (A) và axít amin (B) của chủng gốc và chủng sản xuất với chủng Beijing chuẩn 55
Hình 3.2. Hình ảnh plaque (đám hoại tử- đốm trắng) của chủng sản xuất BV-WSV- 0310 ở các độ pha 10-6; 10-7; 10-8 57
Hình 3.3. Hình ảnh plaque (đám hoại tử- đốm trắng) của chủng sản xuất BV-WSV- 0310 trên dòng tế bào BHK21 và dòng tế bào Vero. 58
Hình 3.4. Điện di gel agarose 1% kiểm tra sản phẩm RT-PCR khuếch đại gen mã hóa kháng nguyên E của các chủng: chủng gốc BV-MSV-0210 (đường chạy số 1); chủng sản xuất BV-WSV-0310 (đường chạy số 2); chủng chuẩn tham chiếu JEV Beijing-1 Kanonji (đường chạy số 3). M: Farmentas 1 kb DNA ladder. 58
Hình 3.5. Trình tự acid amin kháng nguyên E của vi rút VNNB lô chủng giống gốc BV-MSV-0210 (A) và sản xuất BV-WSV-0310 (B) 59
Hình 3.6. Trình tự nucleotide gen mã hóa kháng nguyên E của vi rút VNNB lô chủng giống gốc BV-MSV-0210 (A) và lô chủng sản xuất BV-WSV- 0310 (B)m 60
Hình 3.7. Kết quả kiểm tra an toàn đặc hiệu trên nhắt của 10 lô vắc xin JECEVAX ...67 Hình 3.8. Hiệu giá kháng thể trung hòa của vắc xin JECEVAX và vắc xin mẫu chuẩn BR209 71
Hình 3.9. Công hiệu tương quan của vắc xin JECEVAX và vắc xin mẫu chuẩn BR209 71
x
MỞ ĐẦU
Viêm não Nhật bản (VNNB) là một trong các bệnh gây nhiễm trùng thần kinh cấp tính với nhiều mức độ khác nhau, đáng ngại hơn cả là bệnh thường để lại di chứng thần kinh (như điếc, mù, động kinh, yếu liệt cứng toàn thân hoặc liệt tay chân…)và tỷ lệ tử vong cao. Bệnh lan truyền rộng rãi ở hầu hết các nước ở Châu Á (như Nhật Bản, Trung Quốc, Triều Tiên, Thái Lan, Philippin, Việt Nam, Ấn Độ…), vùng viễn đông của Liên bang Nga... Cho đến nay gần 3 tỷ người sống trong vùng có lưu hành dịch và có khoảng 25.000-50.000 ca bệnh hàng năm, trong số đó 20-30% tử vong, 30-50% sống sót đã để lại di chứng thần kinh[1,2]. Theo thống kê ở Việt Nam, hàng năm ước tính có khoảng 2.000-3.000 trường hợp bị hội chứng viêm não cấp nghi ngờ do vi rút; Trong số này 70-75 % được xác định do vi rút VNNB. Nguồn lây bệnh chủ yếu là do muỗi đốt truyền vi rút cho người. Cho đến nay chưa có thuốc đặc trị bệnh VNNB, do vậy biện pháp phòng bệnh hiệu quả nhất là tiêm vắc xin.
Vi rút VNNB có rất nhiều chủng, nhưng hiện nay hầu hết các chủng sử dụng để sản xuất vắc xin đều thuộc genotype 3 gồm chủng Nakayama; Beijing -1; Beijing- 3 và SA-14-14-2. Từ các chủng này, bằng các công nghệ sản xuất khác nhau đã tạo ra rất nhiều loại vắc xin VNNB như vắc xin VNNB sống giảm độc lực (RS-JEV của Trung Quốc), vắc xin VNNB bất hoạt sản xuất trên não chuột (Jevax- Vabiotech- Việt Nam; JE-VAX - Biken - Nhật Bản, JEV-GCC của Hàn Quốc, JE-BM), vắc xin VNNB bất hoạt sản xuất trên tế bào (IC51 hay IXIARO hay JESPECT; KD-287 của Nhật Bản); vắc xin VNNB dạng sống giảm độc lực tái tổ hợp (ChimeriVax-JE hay Imojev – Sanofi Pasteur)… Nhật Bản là nước đầu tiên nghiên cứu, sản xuất thành công vắc xin VNNB. Việc sử dụng vắc xin VNNB trong cộng đồng đã góp phần giảm tỷ lệ mắc bệnh VNNB đáng kể[3, 4, 5].
Việt Nam bắt đầu nghiên cứu sản xuất và sử dụng vắc xin VNNB bất hoạt sản xuất trên não chuột từ năm 1989, đem lại hiệu quả phòng bệnh rất tốt cho cộng đồng. Dù vậy, theo xu thế chung, từ năm 2006, công ty vắc xin và sinh phẩm số 1 đã nghiên cứu sản xuất vắc xin bất hoạt trên tế bào Vero, sử dụng chủng Beijing-1 (JECEVAX) để sớm đưa vào sử dụng tại Việt Nam thay thế cho vắc xin VNNB bất hoạt sản xuất
trên não chuột[6, 7]. Đây là một vắc xin mới, lần đầu nghiên cứu sản xuất tại Việt Nam. Để sản xuất và đưa vắc xin mới này vào sử dụng là một vấn đề không đơn giản, đòi hỏi phải có rất nhiều nghiên cứu chứng minh tính an toàn và hiệu quả bảo vệ theo các tiêu chuẩn của tổ chức Y tế thế giới (WHO). Do vậy, việc kiểm soát tốt chất lượng của chủng vi rút trước khi đưa vào sản xuất vắc xin đại trà là yêu cầu cần thiết vì chủng vi rút là nguyên liệu chính, thành phấn chính trong vắc xin sau này và chất lượng của chủng sẽ ảnh hưởng đến tất cả các công đoạn còn lại của sản xuất vắc xin. TCYTTG đã đưa ra một số hướng dẫn về việc thiết lập chủng cho sản xuất vắc xin này (WHO TRS số 963). Tuy vậy, TCYTTG mới chỉ đưa ra tiêu chuẩn cho 1 số chỉ tiêu cơ bản áp dụng chung cho hầu hết các chủng vi rút để sản xuất vắc xin (như tiêu chuẩn về vô trùng, Mycoplasma, vi rút ngoại lai); còn rất nhiều chỉ tiêu như hiệu giá, độ ổn định về hiệu giá, độ ổn định về di truyền của chủng, số đời cấy chuyển tối đa từ chủng gốc sang chủng sản xuất… TCYTTG mới chỉ khuyến cáo NSX kiểm tra chứ không đưa ra tiêu chuẩn vì nó mang tính đặc thù riêng cho từng sản phẩm.
Chính vì vậy tôi đã lựa chọn đề tài: “Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam”.
Mục tiêu nghiên cứu của luận án
Xây dựng được tiêu chuẩn chất lượng của chủng (chủng gốc và chủng sản xuất) vi rút Beijing-1 để sản xuất vắc xin VNNB bất hoạt trên tế bào Vero tại Việt Nam.
Nội dung nghiên cứu của luận án
Để thực hiện các mục tiêu nghiên cứu nêu trên, đề tài đã thực hiện các nội dung nghiên cứu dưới đây:
1. Nghiên cứu tính ổn định về hiệu giá, ổn định về di truyền và tính sinh miễn dịch của chủng vi rút sản xuất vắc xin VNNB theo thời gian (sau sản xuất: 0, 3, 4, 6, 8, 9, 10 năm) ở nhiệt độ Nitrogen lỏng; Ở các nhiệt độ bảo quản khác (-20oC sau bảo quản: 1, 3, 6 tháng; 2-8oC sau bảo quản: 1, 3, 5, 7 ngày).
2. Nghiên cứu sự tương đồng nucleotide và axít amin Protein E của chủng sản xuất so với các chủng VNNB lưu hành ở Việt Nam từ 1964-2014.
3. Đánh giá tính an toàn và tính sinh miễn dịch bảo vệ của chủng trong 10 lô vắc xin JECEVAX được sản xuất từ lô WSV ở quy mô phòng thí nghiệm.
4. Xây dựng 9 chỉ tiêu, phương pháp & tiêu chuẩn chất lượng của chủng (chủng gốc và chủng sản xuất) để sản xuất vắc xin VNNB bất hoạt trên tế bào Vero tại Việt Nam.
Những đóng góp mới của luận án
Luận án là công trình đầu tiên ở Việt Nam nghiên cứu một cách có hệ thống về tiêu chuẩn chất lượng cho chủng gốc, chủng sản xuất Beijing-1 để sản xuất vắc xin VNNB bất hoạt trên tế bào Vero tại Việt Nam.
1. Đưa ra được dải nhiệt độ phù hợp giúp chủng Beijing-1 duy trì sự ổn định về hiệu giá ≥ 6log PFU/ml trong ít nhất 10 năm sau sản xuất là điều kiện bảo quản trong nitrogen lỏng; ở -20oC trong 3 tháng và ở 2-8oC trong 3 ngày.
2. Xác định được các tỷ lệ tương đồng về trình tự nucleotide và trình tự axit amin vùng gen sinh tổng hợp kháng nguyên E của lô chủng gốc BV-MSV-0210, chủng sản xuất BV-WSV-0310 với chủng chuẩn tham chiếu Reference JEV Beijing-1 Kanonji và các chủng vi rút VNNB trên người, muỗi và lợn tại Việt Nam ở các giai đoạn khác nhau.
3. Xây dựng được 9 chỉ tiêu chất lượng và phương pháp kiểm định chủng(chủng gốc và chủng sản xuất) Beijing-1 để sản xuất vắc xin VNNB bất hoạt trên tế bào Vero tại Việt Nam.
Ý nghĩa khoa học và thực tiễn của luận án
Kết quả luận án cung cấp các dữ liệu khoa học giúp nhà sản xuất Vabiotech trong việc xây dựng các tiêu chuẩn chất lượng cơ sở của chủng vi rút VNNB Beijing- 1 sử dụng trong sản xuất vắc xin VNNB bất hoạt trên tế bào Vero (JECEVAX) tại Việt Nam và áp dụng các tiêu chuẩn này để quản lý chất lượng của chủng đạt chất lượng ổn định nhằm tạo ra các lô vắc xin có tính an toàn và hiệu quả ổn định cho người sử dụng .
Bố cục của luận án
Luận án gồm 114 trang, trong đó phần mở đầu 3 trang, tổng quan tài liệu 30 trang, vật liệu và phương pháp nghiên cứu 19 trang, kết quả và bàn luận 49 trang, kết luận và kiến nghị 2 trang, danh mục các công trình công bố 1 trang, tài liệu tham khảo 9 trang gồm 98 tài liệu. Trong luận án có 18 hình, 32 bảng và 48 trang phụ lục.
CHƯƠNG 1
TỔNG QUAN NGHIÊN CỨU
1.1. Vi rút Viêm não Nhật Bản
1.1.1. Đặc điểm cấu trúc
Vi rút VNNB là một thành viên của vi rút Arbo (arthropod borne viruses), là những vi rút do côn trùng tiết túc truyền cho động vật có xương sống qua đường máu. Tất cả các vi rút arbo đều có hệ gen (genome) là RNA[8].
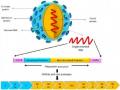
Vi rút VNNB thuộc họ Flaviviridae, chi Flavivirus nhóm B và có liên quan chặt chẽ với virus West Nile và virus viêm não St. Louis… Flavivirus có đường kính 40- 50 nm; bề mặt ngoài là màng lipit kép có nguồn gốc từ tế bào chủ gắn với lớp vỏ là glycoprotein E và protein màng (M). Vật liệu di truyền là 1 sợi RNA đơn phân cực dương xoắn, được bao bọc bởi nucleocapsit. Hạt vi rút VNNB tinh khiết bao gồm sợi RNA chiếm 6%, protein chiếm 66%, lipit 17% và carbohydrate chiếm 9%[1, 8, 9].
Cấu trúc phân tử của sợi RNA gồm 11.000 nucleotide, tương ứng với 3.400 axit amin. Hệ gen của vi rút VNNB mã hóa cho 10 protein gồm 3 protein cấu trúc và 7 protein không cấu trúc trong một khung đọc mở liên tục và trật tự từ đầu 5’ đến đầu 3’ và các vùng không mã hóa [8].Vi rút VNNB có tỷ trọng 1,19-1,2 g/cm3 trong đường và 1,22- 1,24 g/cm3 trong Cesium chlorid, hệ số lắng 200S, trọng lượng phân tử: 60-70 x106 dalton, độ bền vững: Bền với pH=7-9, thích hợp nhất là pH=8.
Vi rút VNNB dễ bị bất hoạt bởi nhiệt độ cao: 50oC trong 50 phút, 37oC trong vài giờ; nhiệt độ thấp như -80oC, -20oC vi rút tồn tại trong nhiều năm và trong Nitrogen lỏng (-196oC) vi rút tồn tại lâu dài. Vi rút VNNB rất nhậy với dung môi hòa tan lipit như ether, sodium deoxycholate, dễ dàng bị bất hoạt bởi tia cực tím, formaldehyde...[1], [8].
1.1.2. Kháng nguyên và các yếu tố độc lực của vi rút
Vi rút VNNB có kháng nguyên gây ngưng kết hồng cầu (HA) và hoạt tính trung hòa là glycoprotein trên preM và E (vỏ và tiền màng của vi rút). Đây cũng chính là kháng nguyên sinh kháng thể ức chế ngưng kết hồng cầu (HI) và kết hợp bổ thể (CF), kháng thể trung hòa (NT) - tức kích thích cơ thể sinh kháng thể bảo vệ [1, 10].