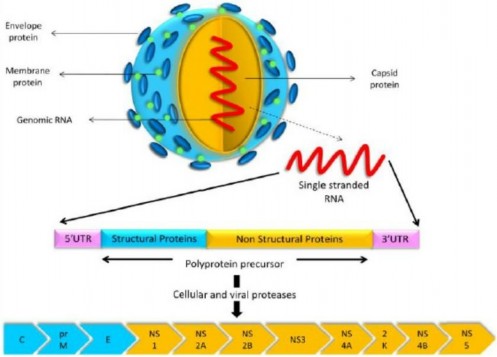
Hình 1.1. Cấu trúc bộ gen của vi rút VNNB
(Nguồn: Bobade S. S, Gade R. M. Zika Virus –A Vector Borne Zoonotic Disease: an International Public Health Emergency. Biosc.Biotech.Res.Comm. 2016;9(2).
Available from: https://bit.ly/2MLfJRM)
Bộ gen RNA gồm: 3 protein cấu trúc và 7 protein không cấu trúc.
Các protein cấu trúc:
Protein C (Capsid): Rất nhỏ, chỉ 9-12 Kda gồm 112-127 axit amin được tạo thành rất vững chắc gồm 1 số lớn axit amin Lys và Arg. Các axit amin trong protein C liên kết với nhau rất chặt chẽ, có thể loại trừ khả năng trung hòa của phân tử RNA của vi rút với các tác nhân liên quan[11].
Protein M (Membrane): có 2 dạng là protein preM chưa trưởng thành trong tế bào chủ và protein M.
+Protein preM: có 165 axit amin không trùng lặp với protein E. Trước khi vi rút được giải phóng ra ngoài tế bào, preM được phân cắt bởi một phân tử protease để tạo thành protein M hoàn chỉnh. PreM chưa trưởng thành không tự tiến tới tế bào đích nhưng lại rất cần thiết cho hoạt động duy trì nòi giống của vi rút trưởng thành [1, 11, 12].
+Protein M: Có trong vi rút trưởng thành ngoài tế bào. Hạt vi rút trưởng thành có khả năng kháng axit kém hơn hạt vi rút chưa trưởng thành khoảng 400 lần, vì vậy khả năng tiếp cận với vi rút dễ dàng hơn. Sự ly giải preM khi ra ngoài tế bào tạo ra
sự sắp xếp lại các cấu trúc Oligo trên bề mặt hạt vi rút, do đó làm tăng khả năng gây nhiễm của vi rút trưởng thành tới vật chủ [1, 12].
Protein E (Envelope): Có trọng lượng phân tử 55-60 Kda, là một glycoprotein bao gồm 494-501 axit amin là thành phần cấu tạo chính của vỏ (E). So sánh chuỗi axit amin tương đồng cho thấy, protein E là một protein cấu trúc có tính bảo tồn cao trong các vi rút thuộc nhóm Flavivirus. Protein E liên quan chặt chẽ đến chức năng sinh học của vi rút như chức năng bám dính, cảm thụ, ngưng kết hồng cầu, trung hòa kháng thể, điều chỉnh pH nội nguyên sinh chất của tế bào chủ [1, 11, 12].
Các protein không cấu trúc (NS:nonstructural)
NS1: Có trọng lượng phân tử 42-50 Kda, là một glycoprotein gồm 353-354 axit amin. Chức năng chưa rõ, có thể như một bổ thể hòa tan cố định kháng nguyên khi bộc lộ trên tế bào cảm nhiễm.
NS3: Có trọng lượng phân tử 67-70 Kda gồm 618-623 axit amin, có tính bảo tồn cao trong chuỗi nucleotit của nhóm Flavivirus, đóng vai trò mã hóa cho enzym protease và helicase[1, 13].
NS5: Có trọng lượng phân tử 104-106 Kda gồm 900-905 axit amin, có tính bảo tồn cao trong chuỗi nucleotit. NS5 gắn liền với sự tạo vỏ capsit của RNA.
NS2A, NS2B, NS4A & NS4B: Đều rất nhỏ, có tính bảo tồn kém trong chuỗi nucleotit, sự mã hóa của chúng có thể liên quan đến protein M.
Trong quá trình vi rút phóng thích khỏi tế bào, protein PreM được tách ra nhờ enzym protease để thành protein trưởng thành và đây là thành phần có khả năng gây nhiễm của vi rút. Bộ gen của vi rút được bọc trong lớp lipit và protein E rồi hoàn thiện với protein C. Protein E chịu trách nhiệm tấn công đến tế bào đích và hòa màng tế bào; chính protein E mang các kháng nguyên bề mặt là kháng nguyên ngưng kết hồng cầu (HA) và hoạt tính trung hòa để tạo kháng thể trung hòa. Đây chính là tiêu chuẩn để chọn bất kỳ chủng dự tuyển nào cho sản xuất vắc xin VNNB.
Vi rút VNNB được phân thành 5 kiểu gen (I-V) dựa trên cấu trúc gen vỏ (protein E) nhưng chỉ có 1 type huyết thanh được biết đến[14].
Phương pháp phân biệt và nhận dạng kháng nguyên
Theo các nghiên cứu cho thấy kháng nguyên của các Flavivirus có phản ứng chéo với nhau, 3 nhóm vi rút có kháng nguyên quan hệ mật thiết và khăng khít với nhau đó là các vi rút gây bệnh sốt Tây sông Nile (West Nile fever), viêm não Louis (Louis encephalitis) và VNNB (Japanese encephalitis), do đó các phản ứng huyết thanh với kháng thể đa dòng rất khó phân biệt. Vì vậy,để phân biệt và nhận dạng kháng nguyên của các vi rút này sử dụng phản ứng trung hòa (NT) là nhậy nhất rồi đến phản ứng kết hợp bổ thể (CF) tiếp đến là phản ứng miễn dịch huỳnh quang (IF).
Do đó việc đánh giá đáp ứng miễn dịch sau khi tiêm vắc xin bằng kỹ thuật trung hòa là đặc hiệu nhất, đặc biệt là trung hòa giảm 50% đám hoại tử (PRNT50) trên tế bào; hoặc dùng kháng thể đơn dòng để định loại Flavivirus và phân biệt với vi rút VNNB. Hiện nay sử dụng các kỹ thuật sinh học phân tử hiện đại như PCR, với cặp mồi đặc hiệu, hoặc dùng phương pháp phân tích trình tự gen... có thể định loại được type vi rút trong các Flavivirus cũng như phân loại được các chủng vi rút VNNB khác nhau rất nhanh chóng và chính xác.
1.1.3. Sự nhân lên của vi rút trên tế bào
Chu kỳ nhân lên của vi rút RNA
Khi vi rút gặp tế bào cảm thụ và nhận biết các thụ thể trên màng tế bào, tiến đến và bám vào thụ thể, màng tế bào bị tác động và tạo khe hở cho vi rút thâm nhập vào bên trong tế bào gây cảm ứng tổng hợp RNA[1, 15]. Sau đó sợi RNA được bộc lộ là RNA đơn polymerase để tạo thành RNA phân cực (-) bổ sung thành chuỗi RNA kép nhờ phiên mã sớm và thông tin trung gian sao chép sợi RNA kép được làm khuôn để tổng hợp các sợi RNA mới theo cách bán bảo tồn và không đối xứng. Khung đọc mở được đồng dịch mã bằng cách cắt đoạn protein liên tiếp thành các đoạn protein cấu trúc và không cấu trúc. RNA và protein của vi rút được tổng hợp trên lưới nội chất có hạt, vùng quanh nhân trong nguyên sinh chất của tế bào chủ. Sự nhân lên của vi rút liên quan đến phát triển của lưới nội chất tạo thành các nội bào đặc trưng. Các sản phẩm tổng hợp được lắp ráp ở màng tế bào chất. Sau đó các hạt virion được giải phóng qua mạng lưới Golgi bằng ngoại bào xuất tiết và các virion mới tiếp tục xâm nhập vào tế bào khác và bắt đầu một chu kỳ mới.
Sự nhân lên của vi rút trong tế bào
Vi rút VNNB nhân lên trên nhiều loại tế bào cả ở trên tế bào tiên phát và tế bào thường trực có nguồn gốc từ người, khỉ, gặm nhấm, lợn, chim, gia cầm và muỗi(tế bào C6/36 muỗi Albobitus).Tế bào tiên phát gồm thận bào thai người, thận khỉ, thận lợn, tế bào phôi gà...hay các dòng tế bào thường trực như GMK2, Vero (thận khỉ), BHK21 (thận chuột hamster)[1]. Trong tế bào nuôi vi rút nhân lên gây hủy hoại tế bào (CPE) nhưng cũng có một số loại tế bào quan sát dưới kính hiển vi quang học, không thấy hiện tượng CPE. Hiệu giá vi rút đạt được tùy thuộc vào tế bào chủ, loại cảm ứng và trong điều kiện thích hợp vi rút nhân lên tốc độ nhanh, thời gian tạo CPE nhanh sau 1-2 ngày gây nhiễm (tế bào C6/36, Vero và BHK21).
Hình ảnh tổn thương tế bào được quan sát trên kính hiển vi quang học cho thấy: Tế bào phình to, các tiểu thể hạt xuất hiện ở lưới nội chất làm rối loạn chức năng phân chia tế bào, vỏ màng nội bào tạo thành các không bào căng phồng và các tiểu thể trong nhân bị méo mó. Có biểu hiện tăng sinh tiểu thể Lysosom và làm loãng nguyên sinh chất của tế bào. Do đó hoạttính enzym lysosom tăng lên trong tổ chức tế bào nhiễm.
1.1.4. Dịch tễ học phân tử của vi rút Viêm não Nhật Bản
Dịch tễ sinh học phân tử tập trung khai thác khía cạnh di truyền, dựa trênsự so sánh trình tự nucleotide của một gen đích hoặc toàn bộ gen của các chủng vi rút VNNB được phân lập từ nhiều nguồn khác nhau để dự đoán tình hình lưu hành dịch, giúp kiểm soát tốt nguy cơ dịch bệnh,đồng thời là cơ sở cho lựa chọn chủng trong sản xuất vắc xin… [2].
Hiện nay, dịch tễ học phân tử là phương pháp hiện đại nhất để xác định về đặc điểm phân tử của tác nhân gây bệnh trên cơ sở đó xác định được nguồn gốc của căn nguyên gây bệnh, sự lan truyền của tác nhân gây bệnh theo không gian, thời gian ở cấp độ phân tử; theo dõi được sự thay đổi các chủng gây bệnh ở mức phân tử theo thời gian và phân vùng địa lý; sự thay đổi trong quá trình cấy chuyển nhân giống, cất giữ chủng trong sản xuất vắc xin; trong một số trường hợp nó còn là cơ sở để phân biệt vi rút vắc xin hay vi rút hoang dại…
Nghiên cứu dịch tễ học phân tử vi rút VNNB được thực hiện từ những năm 1990 với những phân tích về sự phát triển, tiến hoá của vi rút VNNB dựa vào cấu trúc vùng gen PrM do nhóm tác giả nghiên cứu ở Indoneisia[16]. Tuy nhiên đây là đoạn gen có độ dài khoảng 500 bp và tương đối ổn định, nên khi nghiên cứu về sự tiến hoá của vi rút VNNB có thể sẽ bị hạn chế nếu sử dụng vùng gen này. Nhờ sự phát triển của sinh học phân tử, đặc biệt là sự ra đời của máy giải trình tự gen, có thể giúp nghiên cứu các vùng gen có kích thước lớn hơn. Do vậy, vùng gen E với độ dài 1500 bp, là vùng có liên quan đến độc lực và tính sinh miễn dịch của vi rút đã được chọn là vùng gen lý tưởng để nghiên cứu sự tiến hoá, sự phát tán, sự biến đổi, sự khác nhau của các chủng vi rút VNNB. Cho đến nay có rất nhiều chủng vi rút VNNB đã được phát hiện nhưng nhờ có sinh học phân tử mà phân ra 5 genotype. Ở Việt Nam có rất nhiều chủng vi rút VNNB được phát hiện và hầu hết đều thuộc genotype 1 và genotype 3[17, 18, 19].
1.2. Vắc xin Viêm não Nhật Bản
1.2.1. Lịch sử phát triển vắc xin VNNB
Năm 1938, Takanouchi và cs đã nghiên cứu sản xuất vắc xin VNNB bất hoạt từ não chuột. Sau đó thử công hiệu của vắc xin này trên chuột, kết quả đã phát hiện có kháng thể trung hòa ở chuột sau khi tiêm vắc xin. Những nghiên cứu tiếp theo của Mitamura trên thực địa lâm sàng trên người và nhận xét có đáp ứng miễn dịch ở vùng không lưu hành dịch và đáp ứng miễn dịch kém hơn ở vùng có lưu hành dịch[3, 20].
Năm 1946-1949, hợp tác nghiên cứuvề miễn dịch của các nhà khoa học Mỹ và Nhật về công hiệu của vắc xin VNNB do Nhật Bản sản xuất, đã chọn vùng có lưu hành dịch là Okayama để thử nghiệm tiêm vắc xin. Kết quả thống kê cho thấy tỷ lệ mắc giảm 1/4 đến 1/3. Tuy nhiên vắc xin này gây ra nhiều phản ứng phụ đáng kể và gây viêm não dị ứng sau khi tiêm vắc xin vì protein của não chuột chưa được loại bỏ hết[6].
Năm 1957, công nghệ sản xuất và chất lượng vắc xin đã được cải thiện một bước, hàm lượng protein trong vắc xin được quy định là ≤2 mg/ml. Với các tiêu chuẩn này vắc xin VNNB vẫn chưa đạt độ tinh khiết vì vậy nhiều trường hợp phản ứng phụ nghiêm trọng đã xảy ra[6].
Năm 1962 tại Nhật Bản có 2 nhóm nghiên cứu là “Biken” ở Osaka và “Nisseiken” ở Tokyo. Họ đã nghiên cứu tinh chế vắc xin bằng siêu ly tâm để loại bỏ protein tạp và đã giảm được hàm lượng protein trong vắc xin xuống 10 lần (từ 0,2 mg/ml xuống 0,02 mg/ml)[21].
Năm 1965, Nhật Bản tiếp tục nghiên cứu nhằm nâng cao tính an toàn và hiệu quả bảo vệ bằng các phương pháp hóa lý của Takaku.Kết quả đã tạo ra vắc xin đạt độ tinh khiết rất cao, hàm lượng protein trong vắc xin chỉ còn10-25 µg/ml. Vắc xin này có hiệu quả bảo vệ cao và rất an toàn khi tiêm cho trẻ em, các phản ứng phụ không đáng kể, chúng chỉ xảy ra ở một số cá thể có cơ địaquá mẫncảm[22].
Năm 1959-1981, một trường phái khác ở Trung Quốc đã nghiên cứu sản xuất vắc xin sống giảm độc lực từ chủng vi rút độc lực. Bằng cách cấy truyền 110 lần trên tế bào phôi gà sau đó tiếp tục cấy truyền trên tế bào thận chuột đất 100 lần nhưng vắc xinvẫn còn yếu tố gây độc tế bào thần kinhdo đó chủng vi rútvắc xin tiếp tục được lựa chọn bằng phương pháp tạo đám hoại tử và sau đócó được chủng 12.1.7 [23, 24].
Năm 1973, Yu và cs sử dụng chủng 2.8 bắt nguồn từ chủng 12.1.7 đượctiếp tục giảm độc lực bằng tia cực tím[6].
Năm 1974, Chen và Wang chọn lọc chủng vi rút thuần khiết về di truyền bằng kỹ thuật tạo đám hoại tử để có được 1 chủng cho sản xuất vắc xin. Sau đó đã sử dụng chủng này đểsản xuất vắc xin thử nghiệm và đánh giá thực địa lâm sàng trên 8000 trẻ em sống ở vùng không có lưu hành dịch. Kết quả cho thấy 50% trẻcó đáp ứng kháng thể[6].
Năm 1981, Yu và cs lại tiếp tục chuyển chủng 2.8 bằng đường tiêm dưới da cho chuột ổ và đã đạt được 1 chủng giảm độc lực cao đó là chủng 12.4. Sau đó tác giả tiếp tục lựa chọn, thuần khiết để cuối cùng có được 1 chủng nhân lên mạnh mẽ hơn và tính miễn dịch cao hơn trên tế bào so với chủng ban đầu[6].
Song song với việc nghiên cứu vắc xin sống giảm độc lực, Li và cs đã nghiên cứu vắc xin bất hoạt từ tế bào nuôi, loại vắc xin này an toàn nhưng khả năng bảo vệ thấp hơn [6].
Từ năm 1968, quy trình công nghệ sản xuất vắc xin từ não chuột của Takaku là công nghệ được coi là công nghệ tiên tiến nhất. Thử nghiệm thực địa được tiến
hành ở nhiều nơi, riêng ởThái Lan vắc xin đượcđánh giá rộng rãi trên trẻ em và tỷ lệ đối tượngcó đáp ứng kháng thể đạt được đến91%. Vắc xin này được tiêm phòng trong các quần thể dân cư ở một số nơi như Nhật Bản, Đài Loan, Trung Quốc và Thái Lan đạt hiệu quả cao, đặc biệt không có các phản ứng phụ đáng kể cũng như không có trường nào viêm não dị ứng sau khi tiêm vắc xin[6].
Năm 1971, Viện Biken được chỉ đạo của Giáo sư Fukai (nguyên Chủ tịch Hiệp Hội nghiên cứu vắc xin và Sinh phẩm của Nhật Bản) đã nghiên cứu tinh chế vắc xin để đạt độ tinh khiết với hàm lượng protein ≤ 80 µg/ml. Đây là hàm lượng tiêu chuẩn của protein cho phép trong vắc xin VNNB sản xuất từ não chuột theo phương pháp hóa lý của Takaku. Cho đến nay phương pháp tinh chế này vẫn là tiên tiến nhất được TCYTTG công nhận. Năm 1989, VN cũng nhận chuyển giao công nghệ sản xuất vắc xin VNNB từ não chuột (vắc xin JEVAX). Vắc xin thế hệ 2 là vắc xin sản xuất trên tế bào (Nhật, Áo, Ấn Độ, Pháp, Trung Quốc, Thái Lan, Hàn Quốc, Việt Nam…). Vắc xin thế hệ 3 bằng phương pháp công nghệ gen cho đến nay có rất nhiều tác giả nghiên cứu nhưng hầu hết cũng chỉ dừng lại ở mức nghiên cứu thử nghiệm ở phòng thí nghiệm[4,25].
Hiện nay có bốn loại vắc xin đang sản xuất và sử dụng rộng rãi dựa trên các công nghệ sản xuất vắc xin đã nêu trên bao gồm (1) Công nghệ sản xuất vắc xin bất hoạt trên não chuột (chủng Nakayama và Beijing -1); (2) Công nghệ sản xuất vắc xin bất hoạt trên tế bào Vero (chủng Beijing -1, SA14-14-2); (3) Công nghệ sản xuất vắc xin sống giảm độc lực trên tế bào PHK (chủng SA14-14-2); (4) Sản xuất vắc xin tái tổ hợp theo công nghệ khảm (chimeric –JE and YF-17D vắc xin, chủng SA14-14-2).
Trong bốn loại này thì trừ loại đầu sản xuất trên não chuột (thực tế có 2 vắc xin của Việt Nam, Hàn Quốc) còn lại đều là công nghệ sản xuất trên tế bào. Điều đó để thấy xu hướng chung của thế giới hiện nay chính là dần chuyển sang công nghệ sản xuất vắc xin VNNB trên tế bào.
Bảng 1. 1. Các loại vắc xin VNNB và công nghệ sản xuất hiện nay
Tên VX | Chủng vi rút | Công nghệ SX | Dạng VX | NSX | |
1 | JE vaccinee GCCa | Nakayama-NIH | Não chuột | Bất hoạt, dung dịch | Green Cross, Berna-Korea |
2 | JEVAXa | Nakayama-NIH | Não chuột | Bất hoạt, dung dịch | Vabiotech, Việt Nam |
3 | Japanese encephalitis vaccinee | Beijing-3 | TB PHK | Bất hoạt, dung dịch | Beijing, Inst of Biological Products |
4 | RS.JEVa | SA-14-14-2. | TB PHK | Sống giảm độc lực, đông khô | Chengdu, China |
5 | SA14-14- 2Inactivated vaccinee | SA-14-14-2. | TB PHK | Bất hoạt, dung dịch | Intercell AG (Biological E, WRAIR), Áo |
6 | JE-VC | SA-14-14-2 | TB Vero | Sống giảm độc lực, đông khô | Novartis Vaccinees |
7 | IC51 (hay IXIARO ®hay JESPECT®) | SA-14-14-2 | TB Vero | Bất hoạt, hấp phụ | Novatis |
8 | JEEVa | SA-14-14-2 | TB Vero | Bất hoạt, hấp phụ | B/E (Biological E. limited), India |
9 | ChimeriVax-JE (marketed as IMOJEV)a | SA-14-14-2 (chimeric Vero cell-derived- YF | TB Vero | Sống giảm độc lực, đông khô | Sanofi Pasteur, Pháp |
10 | JENVAC | 821564-XY | TB vero | Bất hoạt | Bharat, India |
11 | ENCEVAC ®/KD- 287 | Beijing-1 | TB Vero | Bất hoạt, đông khô | Kaketsuken, Japan |
12 | BK-VJE | Beijing-1 | TB Vero | Bất hoạt, đông khô | Biken (Japan) |
13 | JECEVAX (*) | Beijing-1 | TB Vero | Bất hoạt | Vabiotech, Việt Nam |
Có thể bạn quan tâm!
-
 Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 1
Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 1 -
 Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 2
Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 2 -
 Sự Phát Triển Của Vắc Xin Viêm Não Nhật Bản Trên Tế Bào
Sự Phát Triển Của Vắc Xin Viêm Não Nhật Bản Trên Tế Bào -
 Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1
Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1 -
 Tóm Tắt Quy Trình Thiết Lập Ngân Hàng Chủng (Beijing-1) Để Sản Xuất Vắc Xin Viêm Não Nhật Bản Bất Hoạt Trên Tế Bào Vero Tại Việt Nam
Tóm Tắt Quy Trình Thiết Lập Ngân Hàng Chủng (Beijing-1) Để Sản Xuất Vắc Xin Viêm Não Nhật Bản Bất Hoạt Trên Tế Bào Vero Tại Việt Nam
Xem toàn bộ 178 trang tài liệu này.
(a): Các vắc xin đã và đang lưu hành ở VN
(*): Vắc xin đã xong các nghiên cứu trên lâm sàng và đang hoàn thiện các thủ tục đăng ký xin cấp phép lưu hành.