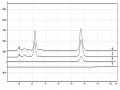
Sử dụng phần mềm trình duyệt hình ảnh LSM, diện tích nhân đã được đo. Dữ liệu chỉ ra rằng kích thước nhân của các tế bào được xử lý bằng oxostephanin hoặc VX-680 lớn hơn gấp ba lần so với ở nhóm đối chứng (Hình 3.29). Kết hợp với nhau, những kết quả này đã chứng minh rằng oxostephanin ức chế sự tăng sinh của tế bào OVCAR-8 trong phạm vi vi cực. Tác dụng theo thời gian thực của oxostephanin có thể so sánh với tác dụng của VX-680, một chất ức chế Aurora kinase.
Hình 3.29. Kích thước trung bình của vùng nhân tế bào sau khi ủ với oxostephanin và VX-680 trong 48 giờ (*P < 0.05 so sánh với đối chứng)
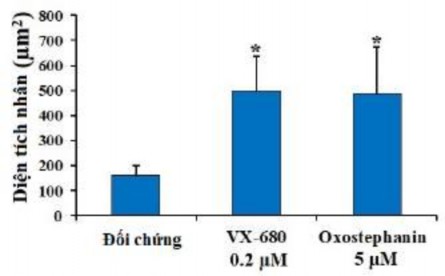
Cảm ứng apoptosis là một đặc điểm của chất ức chế Aurora kinase [42], [129]. Do đó, nghiên cứu đã kiểm tra xem liệu oxostephanin có thể gây ra quá trình apoptosis của các tế bào ung thư OVCAR-8 hay không. Ở nồng độ oxostephanin 5 μM, quan sát thấy sự biểu hiện của phân tử phosphatidylserine, một dấu hiệu apoptosis, liên kết với Annexin-V trên bề mặt tế bào sau 24 giờ ủ (Hình 3.30). Hình ảnh miễn dịch huỳnh quang của các tế bào đối chứng và được xử lý bằng oxostephanin được nhuộm bằng Annexin V ‐ FITC cho thấy sự biểu hiện cao hơn của các phân tử phosphatidylserine trên bề mặt tế bào ở các tế bào được xử lý (màu xanh lục).
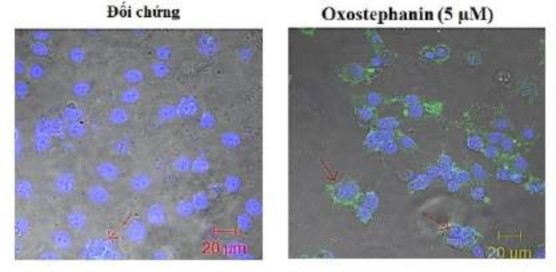
Tỷ lệ tế bào dương tính với Annexin-V được tính từ tổng của góc phần tư Q1-1 (apoptosis sớm) và Q2-1 (apoptosis muộn) trong biểu đồ đo tế bào dòng chảy (Hình 3.31). Theo đó, tỷ lệ tế bào được xử lý với oxostephanin (5 μM) dương tính với Annexin-V là 30,4 ± 6,8%, cao gấp 7,4 lần so với đối chứng (4,1 ± 0,8%).
Hơn nữa, 33,7 ± 5,1% tế bào dương tính với Annexin-V khi được xử lý bằng 0,2 μM VX-680.
Hình 3.30. Oxostephanin gây ra quá trình apoptosis của tế bào OVCAR-8
Có thể bạn quan tâm!
-
 Tỷ Lệ (%) Diện Tích Pic Của Oxostephanin Khi Chạy Hplc Bằng Các Pha Động Khác Nhau
Tỷ Lệ (%) Diện Tích Pic Của Oxostephanin Khi Chạy Hplc Bằng Các Pha Động Khác Nhau -
 Thẩm Định Phương Pháp Định Lượng Oxostephanin Bằng Hplc
Thẩm Định Phương Pháp Định Lượng Oxostephanin Bằng Hplc -
 Hình Thái Các Dòng Tế Bào Thử Nghiệm Dưới Tác Dụng Của Sd1, Sd2, Sd3, Sd4 Và Sd5 Tại Thời Điểm 48H (Vk 10X, Zoom 5,6)
Hình Thái Các Dòng Tế Bào Thử Nghiệm Dưới Tác Dụng Của Sd1, Sd2, Sd3, Sd4 Và Sd5 Tại Thời Điểm 48H (Vk 10X, Zoom 5,6) -
 Đường Cong Ức Chế Tăng Trưởng Đáp Ứng Liều Đối Với Oxostephanin Của Ba Loại Tế Bào
Đường Cong Ức Chế Tăng Trưởng Đáp Ứng Liều Đối Với Oxostephanin Của Ba Loại Tế Bào -
 Về Bước Đầu Nghiên Cứu Xây Dựng Phương Pháp Phân Lập Và Phương Pháp Định Lượng Để Theo Dõi Hàm Lượng Oxostephanin Trong Dược Liệu Theo Thời Gian Thu
Về Bước Đầu Nghiên Cứu Xây Dựng Phương Pháp Phân Lập Và Phương Pháp Định Lượng Để Theo Dõi Hàm Lượng Oxostephanin Trong Dược Liệu Theo Thời Gian Thu -
 Về Xây Dựng Và Thẩm Định Phương Pháp Định Lượng
Về Xây Dựng Và Thẩm Định Phương Pháp Định Lượng
Xem toàn bộ 368 trang tài liệu này.
Hình 3.31. Phân tích định lượng phần trăm apoptosis trong các tế bào được xử lý bằng oxostephanin và VX-680
3.3.2.2. Oxostephanin ức chế sự phát triển của khối u OVCAR‐8
Tác động của oxostephanin lên sự phát triển của tế bào OVCAR-8 trong nuôi cấy 3D đã được nghiên cứu. Với điều kiện xử lý thứ nhất, khi thêm chất thử vào thời điểm chuẩn bị khối u, oxostephanin này đã ngăn chặn 70% sự hình thành khối u ở 5 μM và 58% sự hình thành hình cầu ở 1 μM. Một kết quả tương tự cũng thu được với VX-680; chỉ có 22,5% khối u có thể được hình thành ở nồng độ 0,2 μM. Hơn nữa, thể tích của các khối u được tạo thành nhỏ hơn so với thể tích của đối chứng (Hình 3.32). Sau khi chuyển các khối u vào đĩa thạch, sự phát triển không thay đổi ở nồng độ 1 μM, trong khi điều này giảm ở nồng độ 5 μM sau thời gian nuôi cấy ngay cả khi không có oxostephanin (Hình 3.33).
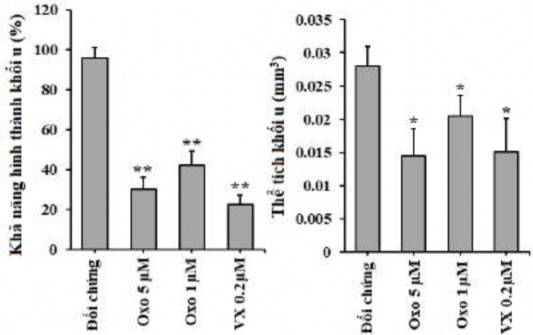
Hình 3.32. Khả năng hình thành và phát triển của khối u OVCAR-8 sau khi ủ với oxostephanin và VX-680
(*P < 0.05 và **P < 0.01 so với đối chứng)
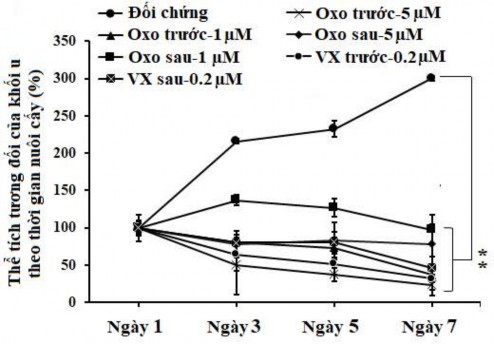
Hình 3.33. Ảnh hưởng của oxostephanin và VX-680 lên thể tích tương đối của khối u
(Số ngày được tính từ thời điểm chuyển khối u từ giọt treo sang đĩa thạch)
Đối với điều kiện xử lý thứ hai, oxostephanin được thêm vào và duy trì trong môi trường sau khi các khối u được chuyển vào đĩa thạch. Trong điều kiện này, sau 7 ngày, oxostephanin ức chế sự phát triển của các khối u, với kích thước giảm 4,3 lần ở 5 μM và 2,7 lần ở 1 μM. Tác động của oxostephanin đối với sự phát triển của hình u thậm chí còn nổi bật hơn so với VX-680 ở 0,2 μM, với sự giảm 2,1 lần về thể tích vào ngày điều trị thứ 7. Mặt khác, đối chứng đã làm tăng thể tích khối u lên gấp 3 lần vào ngày thứ 7 của nuôi cấy trên thạch (Hình 3.33).
Hơn nữa, hình thái của các khối u được xử lý trong cả hai điều kiện: i) các chất thử được thêm vào tại thời điểm chuẩn bị khối u; và ii) các chất thử được thêm vào, duy trì trong môi trường để phát triển khối u trong đĩa thạch cũng được thay đổi thành các cụm tế bào lỏng lẻo với nhiều tế bào được bao bọc riêng biệt, trái ngược với các khối u có cấu trúc chặt chẽ ở đối chứng (Hình 3.34).
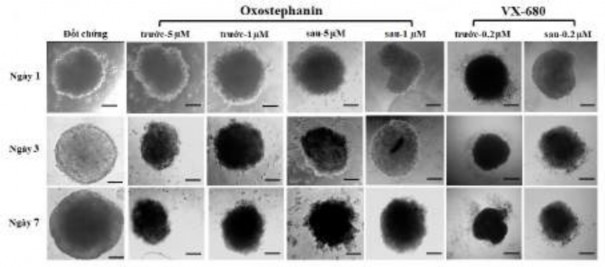
Hình 3.34. Hình thái của khối u được xử lý trong hai điều kiện
(Thanh tỷ lệ, 100 μm)
3.3.2.3. Oxostephanin ức chế sự biểu hiện và hoạt động của Aurora kinase
Để xác định oxostephanin như một chất ức chế Aurora kinase mới, tác động của hợp chất này lên quá trình phosphoryl hóa của H3S10ph đã được đánh giá trong các tế bào ung thư OVCAR-8. Để thu thập tế bào ở giai đoạn phân bào, quần thể tế bào được đồng bộ hóa bằng cách bổ sung paclitaxel, sau đó ủ với oxostephanin và VX-680 ở nồng độ lần lượt là 5 và 0,2 μM. Các hình ảnh cho thấy tín hiệu huỳnh quang của H3S10ph đã giảm rõ rệt trong các tế bào phân bào
được ủ với oxostephanin và VX-680, ngay cả khi có hoặc không có paclitaxel (Hình 3.35). Quá trình phosphoryl hóa histone H3 ở serine 10 đã bị gián đoạn trong các tế bào ung thư OVCAR-8 được xử lý bằng oxostephanin và VX-680 thể hiện ở tín hiệu của H3S10ph (màu xanh lục) bị khử khi có mặt oxostephanin (5 μM) và VX-680 (0,2 μM) trong 15 giờ
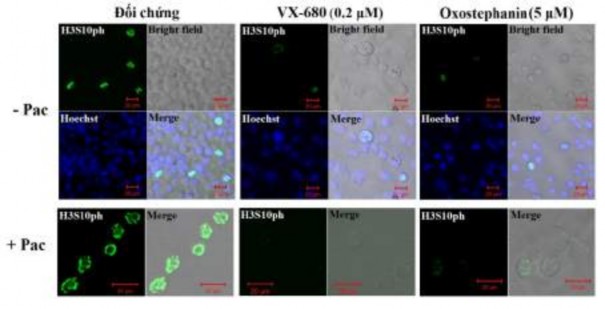
Hình 3.35. Ảnh hưởng của oxostephanin và VX-680 lên quá trình phosphoryl hoá của H3S10ph
Ngoài ra, sự phân bố của Aurora B bị ảnh hưởng bởi các hợp chất này. Những quan sát thu nhận được khi phân tích trên hệ thống LSM 510 cho thấy trong các tế bào OVCAR-8 nguyên phân, Aurora B kinase vẫn được biểu hiện trong tế bào tại vị trí tương ứng là trên vùng kinetochore khi NST ở kỳ đầu giữa và kỳ giữa. Tuy nhiên, các protein không biểu hiện tập trung mà có xu hướng phân tán lên toàn bộ NST (Hình 3.36).
Bên cạnh đó, RT-qPCR tiết lộ rằng biểu hiện mRNA của Aurora B đã giảm sau khi ủ với oxostephanin trong các tế bào OVCAR-8 (Hình 3.37).
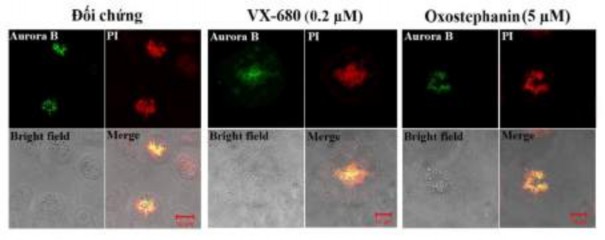
Hình 3.36. Ảnh hưởng của oxostephanin và VX-680 lên sự phân bố của Aurora kinase B
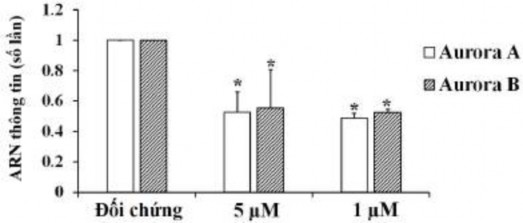
Hình 3.37. Sự biểu hiện của Aurora A và Aurora B đã giảm ở mức mRNA sau khi xử lý bằng oxostephanin và VX-680
(* P <0,05, so với đối chứng)
Để xác định ảnh hưởng của oxostephanin đối với sự định vị của Aurora B kinase, các tế bào HeLa biểu hiện ổn định Aurora kinase B-GFP đã được sử dụng. Đáng chú ý, sự khuếch tán của Aurora B đã được quan sát thấy ở cả tế bào HeLa sống và đã cố định (Hình 3.38). Ở cả hai điều kiện là theo dõi tế bào sống hoặc tế bào đã cố định đều quan sát thấy ở mẫu đối chứng, tín hiệu của Aurora B thể hiện ở dạng các chấm phát huỳnh quang mạnh trên vùng kinetochore của NST. Còn ở mẫu xử lý với VX-680 hoặc oxostephanin, tín hiệu huỳnh quang dàn trải trên các cánh NST chứ không tập trung thành điểm. Sự phân tán của Aurora B kinase là do bản thân protein này cũng bị ức chế khả năng tự phosphoryl hóa, dẫn đến sự thay đổi vị trí biểu hiện của phân tử, qua đó ành hưởng đến chức năng của protein
này. Như vậy có thể thấy oxostephanin, tương tự như VX-680, đã ảnh hưởng đến vị trí biểu hiện của Aurora kinase.
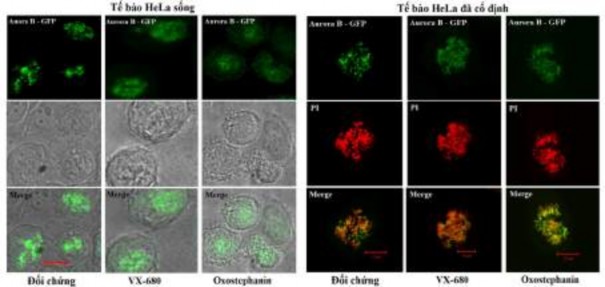
Hình 3.38. Ảnh hưởng của oxostephanin và VX-680 đến sự biểu hiện của Aurora kinase B trong tế bào nguyên phân
Tóm lại, những dữ liệu này minh họa rằng việc xử lý tế bào bằng oxostephanin đã ảnh hưởng đến sự biểu hiện của Aurora B trong chu kỳ tế bào theo cách tương tự như VX-680, nhưng với hiệu quả thấp hơn.
3.3.2.4. Oxostephanin gây độc tế bào có chọn lọc trên các loại tế bào khác nhau
Nghiên cứu chọn ba dòng tế bào, bao gồm UC-MSCs, hUVECs và hFBs của người để kiểm tra độc tính tế bào oxostephanin. Đầu tiên, sự biểu hiện của gen kinase Aurora A và Aurora B so với gen đối chứng actin đã được kiểm tra ở tế bào bình thường và tế bào ung thư. Kết quả cho thấy những gen này được biểu hiện cao ở cấp độ mRNA, với mức cao nhất được quan sát thấy trong các tế bào hUVECs và OVCAR-8, và thấp nhất trong hFBs (Hình 3.39).
Thứ hai, các tế bào được ủ với oxostephanin để phân tích quá trình chết của tế bào. Sau 24 giờ ủ với oxostephanin, sự chết của tế bào hUVECs được quan sát thấy ở hai nồng độ cao nhất. Sau 48 và 72 giờ, số lượng tế bào chết tăng liên tục trong các giếng chứa hUVECs. Kết quả tương tự cũng được phát hiện trong UC- MSCs. Mặt khác, trong các giếng của hFBs, không có tế bào chết nào được quan sát thấy (Hình 3.40).
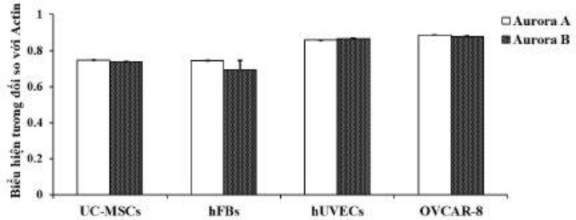
Hình 3.39. Ảnh hưởng của oxostephanin lên biểu hiện mRNA của kinase Aurora A và Aurora B trong các dòng tế bào ung thư và bình thường
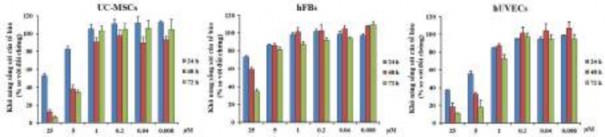
Hình 3.40. Khả năng sống sót của các tế bào UC-MSCs, hUVECs và hFBs được xử lý với các nồng độ oxostephanin khác nhau sau 24, 48 và 72 giờ ủ
Ngoài ra, các giá trị IC50 phù hợp với những quan sát này. Các giá trị IC50 của hUVECs lần lượt là 7,9 ± 0,6; 3,1 ± 0,5 và 1,9 ± 0,5 μM sau 24, 48 và 72 giờ ủ. Tuy nhiên, không thể xác định giá trị IC50 của hFBs sau 24 và 48 giờ, nhưng là 17,1 ± 0,8 μM sau 72 giờ ủ. Đáng chú ý, tác dụng gây độc tế bào của oxostephanin trên UC-MSCs thấp hơn so với hUVECs, nhưng cao hơn trên hFBs, với giá trị IC50 ở 48 và 72 giờ lần lượt là 4,7 ± 0,8 và 5,1 ± 0,7 μM. Đường cong ức chế tăng trưởng theo liều của oxostphanin đối với ba dòng tế bào được thể hiện trong Hình
3.41. Những dữ liệu này, cũng như kết quả của cấp độ mRNA chỉ ra rằng oxostephanin có thể độc hại hơn đối với tế bào ung thư OVCAR-8 và hUVECs, nhưng ít hơn đối với hFBs và UC-MSCs.