a
b
Hình 3.24. Hình thái tế bào OVCAR-8
Từ hình ảnh thu được có thể nhận thấy được hình dạng đặc trưng của năm dòng tế bào HeLa, HepG2, OVCAR-8, MCF7, N87 ở giếng đối chứng và đối chứng dung môi đều có trạng thái bám dính chắc chắn, mật độ che phủ tế bào phù hợp. Hình ảnh cũng cho thấy không có sự khác biệt về hình thái tế bào giữa 2 giếng hình (a) tế bào đối chứng sinh học và tế bào được xử lý với môi trường 0,5% DMSO hình (b). Kết quả định lượng tế bào cũng thu được mật độ tế bào tại giếng bổ sung dung môi đều > 95% so với giếng đối chứng sinh học. Điều này chứng tỏ môi trường chứa 0,5% DMSO (dung môi pha thuốc) không có tác động đáng kể nào lên tế bào nuôi cấy. Kết quả này đảm bảo đạt chuẩn là cơ sở để so sánh với hình thái tế bào ở các giếng thí nghiệm. Kết quả tác động gây độc của các hợp chất lên hình thái các dòng tế bào ở các nồng độ chất thử khác nhau được thể hiện trong hình 3.25.
Với dòng tế bào Hela, hợp chất SD3 là có tác dụng gây độc mạnh nhất, làm hình thái tế bào biến dạng, toàn bộ tế bào co tròn với nồng độ cao nhất [C1] - 65,5 μM và nồng độ [C2] – 32,75 μM, từ nồng độ thứ [C3] – 16,38 μM mới bắt đầu xuất hiện tế bào bám nhưng mật độ khá thấp. Quan sát hình thái tế bào được ủ với các hợp chất khác, cho kết quả không có sự khác biệt rõ ràng giữa các chất ở các nồng độ thử nghiệm. Ngay cả khi được ủ với nồng độ cao các dòng tế bào vẫn bám dính chắc chắn, chỉ có hợp chất SD5 ở nồng độ cao nhất [C1] – 187 μM làm tế bào cũng co tròn, tuy nhiên vẫn còn thấy một vài tế bào bám đáy và hình thái bám đặc trưng thể hiện ở ngay nồng độ [C2] – 93,5 μM.
Với dòng tế bào ung thư gan HepG2 sau 48h ủ hợp chất từ hình ảnh thu được cho thấy hợp chất SD3 và SD4 có tác dụng gây độc tế bào. Hợp chất SD3 có tác dụng gây độc tế bào mạnh nhất, tại nồng độ cao nhất [C1] – 65,5 μM và
nồng độ [C2] – 32,75 μM tế bào co tròn, teo tóp theo từng cụm. Khi giảm nồng độ xuống đến [C3] – 16,38 μM lúc này tế bào thể hiện bám dính đặc trưng, tuy nhiên mật độ vẫn thấp. Hợp chất SD4 cũng chỉ gây độc tế bào ở nồng độ cao nhất [C1] – 156,4 μM, tại đây mật độ tế bào có giảm nhưng về hình thái vẫn bám dính và chưa nhận thấy sự khác biệt rõ rệt. Các hợp chất còn lại là SD1, SD2 và SD5 đều cho hình thái như nhau và không có sự sai khác gì so với đối chứng ngay ở các nồng độ cao nhất.
Với dòng tế bào ung thư vú MCF7 chỉ có hợp chất SD3 là có tác dụng gây độc tế bào, ở nồng độ cao [C1] – 65,5 μM và nồng độ [C2] – 32,75 μM toàn bộ tế bào co tròn với số lượng ít chỉ chiếm 12-15%, đến nồng độ [C3] – 16,38 μM tế bào mới bắt đầu bám đáy và tăng sinh. SD1, SD2, SD4 và SD5 là các hợp chất không có tác dụng gây độc nào cho tế bào MCF7, ngay ở nồng độ cao nhất [C1] hình thái quan sát cho thấy tế bào vẫn bám đáy đặc trưng và số lượng tế bào khá cao chiếm 60-70% bề mặt đĩa nuôi cấy.
Với dòng tế bào ung thư dạ dày N87 cho kết quả có ba hợp chất SD3, SD4 và SD5 có tác dụng gây độc tế bào. Trong đó hợp chất SD3 và SD4 có tác dụng gây độc tế bào mạnh nhất; ở nồng độ cao nhất [C1] hình thái tế bào biến đổi rõ rệt, gần như toàn bộ tế bào co dúm và mật độ giảm mạnh. Khi giảm nồng độ thì ngay nồng độ sau [C2], cả mật độ cũng như hình thái tế bào không thấy có sự sai khác rõ rệt giữa thí nghiệm và đối chứng. SD5 với kết quả thu được cho thấy không có tác dụng gây độc mạnh như SD3 và SD4, với nồng độ cao nhất [C1] – 187 μM chỉ làm giảm số lượng tế bào và hình thái tế bào gần như không có sự thay đổi. Hai hợp chất SD1, SD2 không có ảnh hưởng nào lên tế bào, hình thái tế bào không có biến đổi, mật độ tế bào chiếm khá cao đạt trên 70-90%.
Với dòng ung thư buồng trứng OVCAR-8 từ hình ảnh thu được cho thấy hợp chất SD3 và SD4 có tác dụng gây độc tế bào. Về mặt hình thái cũng như số lượng tế bào quan sát được thì SD3 có tác dụng gây độc mạnh hơn, ở nồng độ cao SD3 làm cho tế bào co tròn toàn bộ, số lượng tế bào giảm hẳn chỉ đạt 9-10%. Với hợp chất SD4, tế bào vẫn bám đáy đặc trưng, mật độ tế bào có giảm nhưng vẫn đạt trên 30%. Các hợp chất còn lại SD1, SD2 và SD5, tương tự như dòng Hela và HepG2 chưa quan sát thấy có sự ảnh hưởng nào lên tế bào ung thư buồng trứng OVCAR-8.
Đối chứng sinh học | Tế bào trong DMSO 0,5% | SD1 | SD2 | SD3 | SD4 | SD5 | ||||||
Y | N | Y | N | Y | N | Y | N | Y | N | |||
OVCAR-8 |
|
|
|
|
|
|
|
|
| |||
[C] μM | 239 | 563 | 4,1 | 2,05 | 39,1 | 19,55 | 187 | |||||
HeLa |
|
|
|
|
|
|
|
|
| |||
[C] μM | 239 | 563 | 32,75 | 16,38 | 156,4 | 187 | 93,5 | |||||
HepG2 |
|
|
|
|
|
|
|
|
| |||
[C] μM | 239 | 563 | 4,1 | 2,05 | 156,4 | 78,2 | 187 | |||||
MCF7 |
|
|
|
|
|
|
|
| ||||
[C] μM | 239 | 563 | 4,1 | 2,05 | 156,4 | 187 | ||||||
N87 |
|
|
|
|
|
|
|
|
|
| ||
[C] μM | 239 | 563 | 65,5 | 32,75 | 78,2 | 39,1 | 187 | 93,5 |
Có thể bạn quan tâm!
-
 Số Liệu Phổ Nmr (Δ Ppm) Của Sd8 Và Hợp Chất Tham Khảo
Số Liệu Phổ Nmr (Δ Ppm) Của Sd8 Và Hợp Chất Tham Khảo -
 Tỷ Lệ (%) Diện Tích Pic Của Oxostephanin Khi Chạy Hplc Bằng Các Pha Động Khác Nhau
Tỷ Lệ (%) Diện Tích Pic Của Oxostephanin Khi Chạy Hplc Bằng Các Pha Động Khác Nhau -
 Thẩm Định Phương Pháp Định Lượng Oxostephanin Bằng Hplc
Thẩm Định Phương Pháp Định Lượng Oxostephanin Bằng Hplc -
 Kích Thước Trung Bình Của Vùng Nhân Tế Bào Sau Khi Ủ Với Oxostephanin Và Vx-680 Trong 48 Giờ (*p < 0.05 So Sánh Với Đối Chứng)
Kích Thước Trung Bình Của Vùng Nhân Tế Bào Sau Khi Ủ Với Oxostephanin Và Vx-680 Trong 48 Giờ (*p < 0.05 So Sánh Với Đối Chứng) -
 Đường Cong Ức Chế Tăng Trưởng Đáp Ứng Liều Đối Với Oxostephanin Của Ba Loại Tế Bào
Đường Cong Ức Chế Tăng Trưởng Đáp Ứng Liều Đối Với Oxostephanin Của Ba Loại Tế Bào -
 Về Bước Đầu Nghiên Cứu Xây Dựng Phương Pháp Phân Lập Và Phương Pháp Định Lượng Để Theo Dõi Hàm Lượng Oxostephanin Trong Dược Liệu Theo Thời Gian Thu
Về Bước Đầu Nghiên Cứu Xây Dựng Phương Pháp Phân Lập Và Phương Pháp Định Lượng Để Theo Dõi Hàm Lượng Oxostephanin Trong Dược Liệu Theo Thời Gian Thu
Xem toàn bộ 368 trang tài liệu này.
Ghi chú: Y. Nồng độ thấp nhất có tác dụng; N. Nồng độ cao nhất không có tác dụng
Hình 3.25. Hình thái các dòng tế bào thử nghiệm dưới tác dụng của SD1, SD2, SD3, SD4 và SD5 tại thời điểm 48h (VK 10X, Zoom 5,6)
103
3.3.1.2. Đánh giá tác dụng gây độc tế bào bằng phương pháp nhuộm MTS
MTS [3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4- sulfophenyl)-2H-tetrazolium] là một loại mới của muối tetrazolium, khi có mặt PMS (phenazine methyl sulfate) được một loại enzym trong ty thể của tế bào sống chuyển hoá tạo ra sản phẩm formazan tan trong môi trường nuôi cấy tế bào, hấp thụ ánh sáng tối đa ở bước sóng 490 - 500 nm trong đệm PBS. Hàm lượng của chất tạo ra tỷ lệ thuận với số lượng tế bào sống tham gia phản ứng, lượng formazan được định lượng bằng phương pháp đo quang ở bước sóng 490 nm.
Sau 48h ủ thuốc, bằng phương pháp MTS [3-(4,5-dimethylthiazol-2-yl)-5- (3- carboxymethoxyphenyl)-2-(4- sulfophenyl)-2H-tetrazolium], đo phổ hấp phụ tại bước sóng 490nm, bằng máy đọc Elisa SpectraMAX Plus 384.
Với chỉ số OD đo được, bằng các phương pháp toán học trong Excel xử lý số liệu và thu được trung bình tỷ lệ % tế bào sống (A%) tương ứng với các nồng độ. Số liệu về giá trị IC50 của từng chất được thể hiện ở bảng 3.25.
Bảng 3.25. IC50 của các hợp chất trên các dòng tế bào ung thư trong thử nghiệm MTS (μM)
OVCAR-8 | HeLa | HepG2 | MCF7 | N87 | |
SD1 | ND | ND | ND | ND | ND |
SD2 | ND | ND | ND | ND | ND |
SD3 | 3,4 ± 0,007 R2 = 0,99 | 22,4 ± 0,7 R2 = 0,99 | 3,2 ± 0,18 R2 = 0,97 | 3,1 ± 0,06 R2 = 0,99 | 33 ± 0,08 R2 = 0,98 |
SD4 | 30 ± 1,4 R2 = 0,98 | 97,4 ± 4,6 R2 = 0,98 | 122.9 ± 5,7 R2 = 0,98 | ND | 66,1 ± 0,9 R2 = 0,98 |
SD5 | ND | 160,3 ± 9,2 R2 = 0,99 | ND | ND | 115,3 ± 1,34 R2 = 0,97 |
Kết quả thử nghiệm bằng phương pháp MTS tương quan với kết quả định tính so sánh hình thái thu được ở hình 3.25.
Nhìn một cách tổng thể thì hợp chất SD3 gây độc mạnh cho các dòng tế bào thử nghiệm. Ở nồng độ cao nhất, cả 5 dòng tế bào ung thư thử nghiệm đều bị
ức chế đáng kể, đặc biệt trên dòng tế bào MCF7, HepG2 và OVCAR-8, làm tế bào biến dạng và mật độ giảm mạnh. Khả năng ức chế sự sống của tế bào giảm dần theo chiều giảm của nồng độ thuốc thử. Tại nồng độ [C1] = 65,5 μM số lượng tế bào của ba dòng MCF7, HepG2 và OVCAR-8 lần lượt với A% chỉ đạt trung bình khoảng 20%, 17% và 9% và lần lượt là 23%, 22% và 16% ở nồng độ [C2] = 32,75 μM. Ở nồng độ thấp nhất, hợp chất không còn khả năng ảnh hưởng đến sự sống của tế bào, chỉ số A% đều lớn hơn 90%.
Hai hợp chất SD4 và SD5 chưa gây độc mạnh cho các dòng tế bào thử nghiệm, rõ nhất với dòng ung thư vú MCF7. Hai hợp chất này gây độc với các dòng tế bào ung thư cổ tử cung Hela và dạ dày N87, gây giảm đáng kể mật độ tế bào khi thử ở các nồng độ cao như [C1], [C2] và [C3]. Với hợp chất SD4, tại nồng độ [C1] = 156,4 μM số lượng tế bào OVCAR-8 chỉ đạt trung bình khoảng 28% và 40% ở nồng độ [C2] = 78,2 μM.Tác động của hợp chất SD5 trên hai dòng OVCAR-8, HepG2 tại nồng độ cao có gây giảm về mật độ tế bào tuy nhiên mức độ giảm không đáng kể.
Ngoài ra, hai hợp chất SD1, SD2 chưa có tác dụng gây độc trên cả 5 dòng tế bào thử nghiệm (Hela, HepG2, MCF7, N87 và OVCAR-8), chưa thể hiện ảnh hưởng nào lên tế bào, hình thái tế bào không có biến đổi, mật độ tế bào chiếm khá cao.
3.3.2. Nghiên cứu cơ chế tác dụng gây độc tế bào của oxostephanin
3.3.2.1. Ảnh hưởng của oxostephanin theo thời gian thực đối với tế bào ung thư OVCAR‐8
Nghiên cứu thực hiện phân tích độc tính tế bào của oxostephanin bằng cách sử dụng dòng tế bào OVCAR-8 với hệ thống xCELLigence RTCA. Trong thời gian ủ > 200 h, khả năng sống sót, số lượng, hình thái và khả năng kết dính của các tế bào được ghi lại và hiển thị dưới dạng đồ thị (Hình 3.26). Các tiện ích trong phần mềm RTCA Control Unit cho phép tạo đường cong đáp ứng liều và tính giá trị IC50 của thuốc tại các thời điểm khác nhau. Kết quả cho thấy oxostephanin và VX-680 có tác dụng tương tự đối với sự tăng sinh tế bào; nồng độ của các hợp chất càng cao thì tác dụng ức chế sự phát triển của tế bào càng lớn.
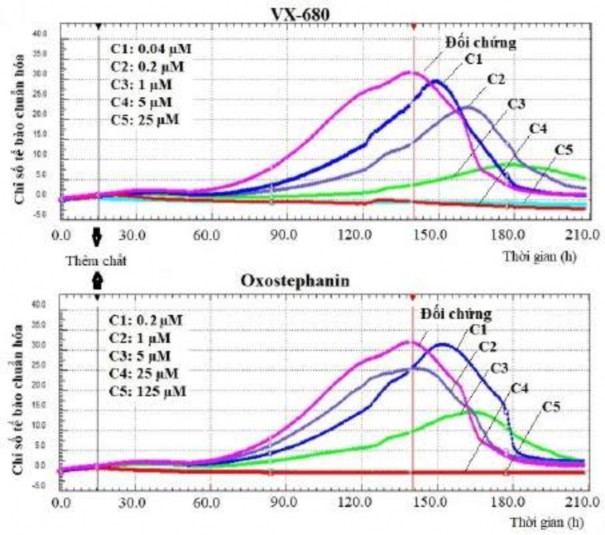
Hình 3.26. Ảnh hưởng của oxostephanin và VX-680 theo thời gian thực lên tế bào OVCAR-8
Trong các giếng đối chứng, các giá trị chỉ số tế bào tăng dần và đạt đỉnh tại thời điểm 140 h, với CI là 32 (Hình 3.26). Trong các giếng được xử lý với hai nồng độ cao nhất là 125 và 25 μM oxostephanin, sự tăng sinh tế bào bị ức chế hoàn toàn so với đối chứng với các giá trị CI giảm sau 3 giờ ủ, cho thấy rằng các tế bào không thể phát triển mà đã chết. Ở nồng độ oxostephanin 5 μM, tốc độ tăng sinh tế bào xấp xỉ một nửa so với đối chứng, với thời gian để đạt được đỉnh của giá trị CI là 165 giờ. Ở nồng độ oxostephanin 1 μM, đỉnh đạt được cùng lúc nhưng với giá trị nhỏ hơn, tương đương với 78% đối chứng. Ở nồng độ nhỏ nhất 0,2 μM oxostephanin, sự tăng sinh tế bào thấp hơn so với đối chứng. Đối với các giếng
được xử lý bằng VX-680, trong khi tất cả các tế bào đều bị giết ở hai nồng độ cao nhất, giá trị CI ở các đỉnh kết hợp với các nồng độ khác nhỏ hơn và được quan sát tại các thời điểm muộn hơn so với các giá trị của đối chứng (Hình 3.26). Sử dụng phần mềm RTCA, các giá trị IC50 tại các thời điểm ủ khác nhau từ 24 đến 120 h đã được tính toán. Giá trị IC50 là từ 3,8-7,3 μM đối với oxostephanin và 0,2-0,6 μM đối với VX-680 (Bảng 3.26).
Bảng 3.26. Giá trị IC50 của oxostephanin và VX-680 đối với tế bào ung thư OVCAR-8 với thời gian ủ khác nhau
Thời gian ủ (h) | |||||
24 | 48 | 72 | 96 | 120 | |
VX-680 (μM) | 0,3±0,02 | 0,6±0,06 | 0,2±0,04 | 0,2±0,07 | 0,2±0,05 |
Oxostephanin (μM) | 7,3±1,5 | 6,6±0,9 | 5,6±0,7 | 4,6±0,8 | 3,8±0,5 |
Thời gian nhân đôi của các tế bào OVCAR-8 cũng bị ảnh hưởng bởi hai hợp chất này. Sau khi xử lý bằng VX-680, các tế bào không phát triển và chết nhanh chóng sau khi bổ sung chất được biểu thị bằng các giá trị âm của thời gian nhân đôi ở ba nồng độ cao nhất. Với oxostephanin, phần lớn thời gian nhân đôi cao hơn so với đối chứng, cho thấy sự tăng sinh của tế bào đã bị ức chế (Hình 3.27).
Đáng chú ý, sự thay đổi kích thước của các tế bào được xử lý bằng oxostephanin và VX-680 ở nồng độ thấp đã được quan sát thấy. Các tế bào tăng kích thước sau thời gian ủ. Không chỉ kích thước tế bào, mà phương pháp nhuộm miễn dịch của những tế bào này cũng chỉ ra rằng có sự gia tăng đáng kể diện tích nhân tế bào (Hình 3.28). Ngoài ra, hình thái của nhân tế bào đã bị thay đổi, với các nhân trở nên không đồng nhất, nhiều thùy và mở rộng, không đồng nhất hoặc hình bầu dục như trong đối chứng (Hình 3.28).
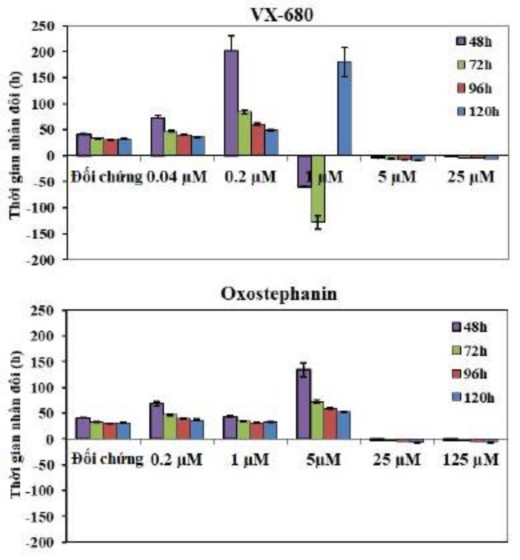
Hình 3.27. Ảnh hưởng của oxostephanin và VX-680 lên thời gian nhân đôi của tế bào OVCAR-8
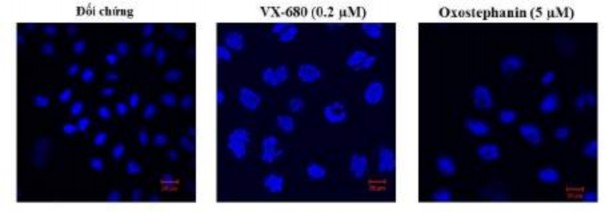
Hình 3.28. Hình ảnh nhân tế bào sau khi ủ với oxostephanin và VX-680 trong 48 giờ