và sấy khô ở 105°C (trọng lượng không đổi). Ở bước thứ hai, cân 10 gam Hydrochar thêm vào 200 mL dung dịch KOH có nồng độ lần lượt (0,1, 0,25, 0,5, 1, 2M), dùng máy khuấy từ để khuấy trong 30 phút; hỗn hợp sau đó được thủy nhiệt ở nhiệt độ lần lượt 110, 130, 150, 170°C, trong thời gian lần lượt là 0,5, 1, 2, 3, 4 giờ. Các thông số khảo sát được tham khảo từ tài liệu [116]. Sản phẩm thủy nhiệt thu được bằng cách lọc (không rửa) và sau đó sấy khô ở 105oC trong 12 giờ. Các mẫu tiếp tục được nhiệt phân ở nhiệt độ 700°C, tốc độ gia nhiệt là 4oC/ phút, thời gian lưu 2 giờ, trong môi trường nitơ (95,995%). Sau đó, sản phẩm được rửa nhiều lần cho đến khi dung dịch nước rửa đạt pH bằng 7, sấy khô hoàn toàn ở 105°C để thu được mẫu Hydrochar hoạt hóa thủy nhiệt (CHhydro và CChydro).
2.4.2. Điều chế Hydrochar từ tính (CHmagnet và CCmagnet)
Hydrochar từ tính được tạo ra trong quy trình gồm 2 bước: Bước đầu tiên điều chế tiền chất Hydrochar giống trong mục 2.4.1, bước thứ hai từ hóa Hydrochar bằng FeCl3.6H2O trong môi trường kiềm, sau đó được nhiệt phân để tạo ra sản phẩm cuối, như trong Hình 2.5.
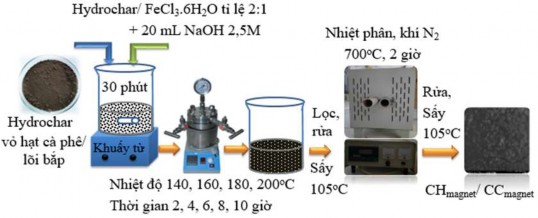
Hình 2.5. Quy trình điều chế Hydrochar từ tính (CHmagnet và CCmagnet)
Thí nghiệm từ hóa Hydrochar được tiến hành với tỉ lệ Hydrochar/ FeCl3.6H2O là 2:1, hòa tan trong 50 mL nước khử ion, khuấy đều bằng máy khuấy từ trong 30 phút. Sau đó thêm 20 mL NaOH 2,5 mol/L tiếp tục khuấy đều để phân tán đồng nhất, các thông số thực hiện được tham khảo từ tài liệu [112]. Cho hỗn hợp vào Autoclave lót Teflon 400mL gia nhiệt lần lượt 140, 160, 180, 200oC, lưu trong thời gian 2, 4, 6, 8, 10 giờ. Các sản phẩm rắn được thu hồi bằng nam châm và rửa kỹ bằng nước khử ion và ethanol nhiều lần cho đến khi dung dịch nước rửa đạt pH bằng 7, sau đó sấy khô ở nhiệt độ 105oC trong 12 giờ. Các mẫu tiếp tục được nhiệt phân ở nhiệt độ 700°C, tốc độ gia nhiệt là 4oC/ phút, thời gian lưu 2 giờ, trong
môi trường nitơ (95,995%). Sau đó, sản phẩm được rửa nhiều lần cho đến khi dung dịch nước rửa đạt pH bằng 7, sấy khô hoàn toàn ở 105°C để thu được mẫu Hydrochar từ tính (CHmagnet và CCmagnet).
2.4.3. Điều chế Hydrochar hoạt hóa ngâm tẩm (CHimpreg và CCimpreg).
Hydrochar hoạt hóa ngâm tẩm được tạo ra trong quy trình gồm 2 bước: Bước đầu tiên điều chế tiền chất Hydrochar giống trong mục 2.4.1, bước thứ hai hoạt hóa ngâm tẩm khô Hydrochar với tác nhân KOH, sau đó được nhiệt phân để tạo ra sản phẩm cuối, như trong Hình 2.6.

Hình 2.6.Quy trình điều chế Hydrochar hoạt hóa ngâm tẩm (CHimpreg và CCimpreg)
Thí nghiệm tiến hành điều chế Hydrochar hoạt hóa ngâm tẩm được thực hiện như sau: Hydrochar được ngâm tẩm khô với KOH theo tỉ lệ Hydrochar/ KOH lần lượt là 2:1, 1:1, 1:2, 1:3. Thời gian ngâm tẩm Hydrochar với KOH lần lượt là 12, 24, 36, 48 giờ. Các thông số được tham khảo theo các tài liệu [32, 117]. Sau đó sấy khô ở điều kiện nhiệt độ 105oC trong 12 giờ. Các mẫu tiếp tục được nhiệt phân ở nhiệt độ 700°C, tốc độ gia nhiệt là 4oC/ phút, thời gian lưu 2 giờ, trong môi trường nitơ (95,995%). Sau đó, sản phẩm được rửa nhiều lần cho đến khi dung dịch nước rửa đạt pH bằng 7, sấy khô hoàn toàn ở 105°C để thu được mẫu Hydrochar hoạt hóa ngâm tẩm (CHimpreg và CCimpreg).
2.4.4. Điều chế Hydrochar hoạt hóa một giai đoạn (CHactiv và CCactiv).
Nhằm rút ngắn giai đoạn điều chế Hydrochar tác giả đã tiến hành điều chế Hydrochar hoạt hóa bằng cách kết hợp quá trình HTC và hoạt hóa với tác nhân KOH trong cùng một giai đoạn, sau đó được nhiệt phân để tạo ra sản phẩm cuối, như trong Hình 2.7.
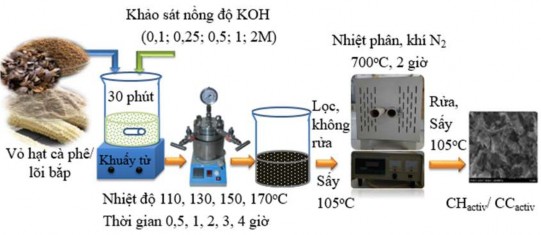
Hình 2.7. Quy trình điều chế Hydrochar hoạt hóa (CHactiv và CCactiv).
Thí nghiệm tiến hành điều chế Hydrochar hoạt hóa được thực hiện như sau: cân 10g vỏ hạt cà phê/ lõi bắp nghiền mịn cho vào 200 mL dung dịch KOH có nồng độ lần lượt (0,1, 0,25, 0,5, 1, 2 M), khuấy đều bằng máy khuấy từ trong 30 phút. Hỗn hợp này được cho vào bình Autoclave lót Teflon 400mL thực hiện quá trình HTC gia nhiệt lần lượt ở các nhiệt độ (110, 130, 150, 170oC) trong thời gian lần
lượt (0,5, 1, 2, 3, 4 giờ). Các thông số khảo sát được tham khảo từ tài liệu [116]. Sản phẩm thủy nhiệt thu được bằng cách lọc (không rửa) và sau đó sấy khô ở 105oC trong 12 giờ. Các mẫu tiếp tục được nhiệt phân ở nhiệt độ 700°C, tốc độ gia nhiệt là 4oC/ phút, thời gian lưu 2 giờ, trong môi trường nitơ (95,995%). Sau đó, sản phẩm được rửa nhiều lần cho đến khi dung dịch nước rửa đạt pH bằng 7, sấy khô hoàn toàn ở 105°C để thu được mẫu Hydrochar hoạt hóa (CHactiv và CCactiv).
2.4.5. Điều chế Biochar hoạt hóa (CHbiochar và CCbiochar).
Biochar hoạt hóa được điều chế bằng phương pháp nhiệt phân 2 bước, phổ biến hiện nay để làm vật liệu so sánh: bước đầu tiên nhiệt phân để tạo ra Biochar ở nhiệt độ cao, bước thứ hai hoạt hóa ngâm tẩm Biochar với tác nhân KOH, sau đó mẫu tiếp tục nhiệt phân để tạo ra sản phẩm cuối, như trong Hình 2.8.

Hình 2.8. Quy trình điều chế Biochar hoạt hóa.
Thí nghiệm tiến hành điều chế Biochar hoạt hóa được tham khảo từ các tài liệu [32, 80, 117-119] thực hiện như sau: bước đầu tiên, điều chế Biochar bằng phương pháp nhiệt phân (vỏ hạt cà phê/ lõi bắp) trong lò nung ống, trong dòng khí N2, ở nhiệt độ nung 500oC, tốc độ gia nhiệt 4oC/ phút và thời gian lưu 2 giờ. Sản phẩm Biochar thu được bằng cách lọc chân không, rửa bằng nước cất và sấy khô ở 105°C (trọng lượng không đổi). Ở bước thứ hai, Biochar được tẩm với KOH theo tỉ lệ Biochar/ KOH (1:1), trong 36 giờ, sấy khô ở điều kiện nhiệt độ 105oC trong 12 giờ. Sản phẩm tiếp tục được nhiệt phân ở nhiệt độ 700°C, tốc độ gia nhiệt là 4oC/ phút, thời gian lưu 2 giờ, trong môi trường nitơ (95,995%). Sau đó, sản phẩm được rửa nhiều lần cho đến khi dung dịch nước rửa đạt pH bằng 7, sấy khô hoàn toàn ở 105°C để thu được mẫu Biochar hoạt hóa (CHbiochar và CCbiochar).
2.4.6. Khảo sát ảnh hưởng quá trình nhiệt phân cuối đến than sinh học hoạt hóa
Các mẫu than sinh học hoạt hóa được tạo ra bằng nhiều phương pháp hoạt hóa khác nhau, để thuận lợi cho việc đánh giá các vật liệu với nhau nên giai đoạn nhiệt phân cuối trong tất cả quy trình điều chế cần thống nhất. Mẫu Hydrochar hoạt hóa tính thủy nhiệt (CHhydro và CChydro) đã được lựa chọn để nghiên cứu ảnh hưởng của yếu tố nhiệt độ và thời gian nhiệt phân cuối đến các mẫu than sinh học hoạt hóa. Quy trình cụ thể: Hydochar (vỏ hạt cà phê/ lõi bắp) sau khi hoạt hóa thủy nhiệt với KOH 1 M, ở điều kiện nhiệt độ 130oC, thời gian 2 giờ, sản phẩm thu được sẽ lọc (không rửa), sấy 105oC đến khô để dùng khảo sát quá trình nhiệt phân. Khảo sát nhiệt độ nhiệt phân tại các điều kiện nhiệt độ thay đổi lần lượt là 600, 700, 800oC, trong thời gian lưu 2 giờ, với tốc độ gia nhiệt 4oC/ phút được tham khảo từ tài liệu [112]. Sau đó, khảo sát thời gian nhiệt phân tại các mốc thời gian thay đổi lần lượt là 0,5, 1, 2, 3 giờ, với nhiệt độ nhiệt phân tối ưu trên. Đánh giá, lựa chọn điều kiện nhiệt độ và thời gian nhiệt phân phù hợp theo mục tiêu của luận án tạo ra vật liệu vừa có khả năng hấp phụ MB và vừa có hoạt tính xúc tác cho phản ứng thủy phân cellulose thành Gluocoe. Điều kiện thực hiện quá trình hấp phụ MB của các vật liệu là cố định nồng độ MB ban đầu là 100 mg/L, thời gian tiếp xúc 480 phút, hàm lượng vật liệu là 1 g/L. Đánh giá hoạt tính xúc tác cho phản ứng thủy phân cellulose thành glucose của các loại vật liệu dựa trên hiệu suất đường khử tạo thành. Điều kiện thực hiện phản ứng thủy phân: trong 40 mL H2O (chứa 0,012% HCl), ở nhiệt
độ 180oC, trong 2 giờ. Các thông số tham khảo tài liệu [2]. Hàm lượng đường khử sau
quá trình thủy phân được xác định bằng phương pháp Imoto [120]. Đồng thời, thông số độ acid tổng của các vật liệu cũng được xác định bằng phương pháp chuẩn độ bằng máy chuẩn độ điện thế.
2.5. Các phương pháp xác định đặc trưng tính chất nguyên liệu, vật liệu
2.5.1. Phương pháp phân tích nhiệt trọng lượng (TGA) của nguyên liệu thô.
Phân tích nhiệt trọng lượng được thực hiện trên máy TGA Q500 V20.10 Build 36, Viện Khoa học Vật liệu Ứng dụng – Viện Hàn Lâm Khoa học Công nghệ Việt Nam. Điều kiện nhiệt độ phân tích từ 30oC – 1200oC, tốc độ nâng nhiệt 10oC/ phút trong môi trường khí CO2.
2.5.2. Phương pháp phân tích giản đồ nhiễu xạ tia X (XRD)
Giản đồ nhiễu xạ tia X (X-ray diffraction - XRD) phân tích đặc trưng cấu trúc tinh thể của các vật liệu rắn. Các giản đồ XRD được thực hiện trên máy XRD Advance A8 – Bruker – Model 2006 tại Viện Khoa học Vật liệu Ứng dụng – Viện Hàn Lâm Khoa học Công nghệ Việt Nam và thiết bị XRD, D800 Bruker tại trung tâm dịch vụ phân tích thí nghiệm thành phố Hồ Chí Minh. Điều kiện đo mẫu bột, góc quét 2 từ 10 – 80oC, bước quét 0,020273o, sử dụng tia X là CuKα , bước sóng
= 0,154 nm.
2.5.3. Phương pháp kính hiển vi điện tử
Hình thái cấu trúc được nghiên cứu bằng phương pháp kính hiển vi quét (Scanning Electron Microscopy - SEM) đo trên thiết bị (Hitachi S – 4800 tại trung tâm nghiên cứu triển khai khu công nghệ cao TP. Hồ Chí Minh) và phương pháp kính hiển vi truyền qua (Transmission Electron Microscopy - TEM) được đo trên thiết bị TEM tại trường đại học Bách Khoa TP. Hồ Chí Minh.
2.5.4. Phương pháp quang phổ hồng ngoại biến đổi Fourrier (FTIR)
Bản chất các liên kết của các nhóm cấu trúc được xác định bằng phương pháp quang phổ hồng ngoại biến đổi Fourrier (Fourrier Transform Ingrared – FTIR), sử dụng thiết bị quang phổ hồng ngoại FT-IR Spectrum Two, hãng Perkin Elmer tại Viện khoa học Vật liệu Ứng dụng – Viện Hàn Lâm Khoa học Công nghệ Việt Nam và thiết bị Tensor 27 - Bruker – Germany tại Viện Hóa – Viện Hàn Lâm Khoa học Công nghệ Việt Nam. Khối lượng mẫu mỗi lần đo là 3,3 mg, được ép thành tấm mỏng với một lượng xác định KBr (tỉ lệ khối lượng mẫu trong hỗn hợp với KBr là 1%), tốc độ quét 1 lần/ giây.
2.5.5. Phương pháp phổ tán sắc năng lượng tia X (EDX)
Sự hiện diện của các nguyên tố Fe, O, C được xác định bằng phương pháp phổ tán sắc năng lượng tia X (EDX) sử dụng thiết bị Hitachi S – 4800 tại trung tâm nghiên cứu triển khai khu công nghệ cao TP. Hồ Chí Minh. Phổ EDX được tiến hành kết hợp với ảnh SEM, ghi nhận thông tin về sự tồn tại của nguyên tố trong một đơn vị diện tích bề mặt được phân tích (kỹ thuật bề mặt – “mapping”), hoặc hàm lượng và thành phần các nguyên tố trong khu vực đại diện của mẫu (kỹ thuật điểm – “point” hoặc đường – “line”). Điện thế chụp là 10kV, chế độ chụp điện tử thấp SE(U).
2.5.6. Phương pháp hấp phụ N2 Brunauer–Emmett–Teller (BET)
Diện tích bề mặt riêng và kích thước mao quản của các mẫu vật liệu trong nghiên cứu này được phân tích bằng phương pháp hấp phụ N2 Brunauer–Emmett– Teller (BET) trên thiết bị Autosorb iQ (Quantachrome Instrument - Mỹ) tại Viện khoa học Vật liệu Ứng dụng – Viện Hàn Lâm Khoa học Công nghệ Việt Nam. Mẫu được làm sạch độ ẩm ở nhiệt độ 300oC trong môi trường chân không. Quá trình hấp phụ vật lý N2 được tiến hành trong dòng N2 ở nhiệt độ -196oC. Quá trình giải hấp
phụ được tiến hành bằng cách nâng nhiệt độ từ -196oC lên nhiệt độ phòng. Lượng
N2 hấp phụ và giải hấp phụ được xác định bằng đầu dò TCD. Quá trình đo kết thúc khi giá trị P/Po bằng 0,35. Xác định kích thước mao quản của vật liệu cùng theo quy trình trên nhưng phép đo được thực hiện với các giá trị P/Po thay đổi từ 0,05 đến 0,98 và ngược lại.
2.5.7. Xác định nhóm chức bề mặt bằng phương pháp chuẩn độ Boehm.
Hàm lượng nhóm chức acid bề mặt của than sinh học hoạt hóa được xác định bằng phương pháp chuẩn độ Boehm [121], với việc dùng các dung dịch có tính base khác nhau để phản ứng với các tâm acid trên bề mặt than. Sau đó, lượng dư của các dung dịch base này được xác định bằng phương pháp chuẩn độ với chất chuẩn HCl 0,1M, trên thiết bị chuẩn độ điện thế – model 848 Titrno plus. Các dung dịch base được sử dụng là dung dịch NaOH 0,1M; dung dịch NaHCO3 0,1M và dung dịch Na2CO3 0,1M. Dung dịch NaOH sẽ phản ứng với tất cả các nhóm chức carboxylic, phenolic và lactone. Do vậy, thí nghiệm ngâm than với dung dịch NaOH 0,1M sẽ xác định được độ acid tổng trên bề mặt than. Dung dịch NaHCO3 chỉ phản ứng với nhóm acid carboxylic, nên khi ngâm than với dung dịch này sẽ xác định được số
tâm acid carboxylic. Dung dịch Na2CO3 phản ứng với nhóm carboxylic và lactone. Do đó, các tâm acid lactone và phenolic được tính như sau:
- Số tâm (lactone) = (Số tâm acid đã phản ứng với dung dịch Na2CO3 – Số tâm acid đã phản ứng với NaHCO3)
- Số tâm (phenolic) = Độ acid tổng - Số tâm (acid carboxylic) - Số tâm (lactone)
Quy trình tiến hành thí nghiệm được thực hiện như sau: Cân 0,3 gam than vào bình tam giác có chứa 20 ml mỗi dung dịch NaOH 0,1 M; Na2CO3 0,1 M; NaHCO3 0,1M, lắc ở tốc độ 600 vòng/ phút ở nhiệt độ phòng trong 48 giờ. Sau đó dung dịch được đánh siêu âm trong 5 phút để loại bỏ CO2 hòa tan trong dung dịch. Nồng độ dung dịch sau ngâm được xác định bằng phương pháp chuẩn độ Boehm trên thiết bị chuẩn độ điện thế – model 848 Titrno plus. Tiến hành mẫu trắng (không than) song song cùng mẫu môi trường. Hàm lượng tâm acid trên bề mặt than đã phản ứng với NaOH, NaHCO3 và Na2CO3 (mmol/g) được xác định bằng công thức:
Tâm acid (NaOH, Naଶ
COଷ
, NaHCOଷ) =
൫ಹభ
ିಹమ
୫
൯×ಹ×ೇబ
ೇ
ഀ
(2.4)
Trong đó: 𝑉ுభ: thể tích dung dịch HCl tiêu tốn khi chuẩn độ mẫu trắng (mL); 𝑉ுమ: thể tích dung dịch HCl tiêu tốn khi chuẩn độ mẫu (mL); CHCl: nồng độ của dung dịch HCl (mol/L); V0: thể tích của dung dịch NaOH/ Na2CO3/ NaHCO3/ ban đầu (mL); Vα: thể tích hút ra từ Vođem đi chuẩn độ (mL); m: khối lượng than sinh học hoạt hóa (g).
2.6. Nghiên cứu hấp phụ xanh methyelne của các mẫu than sinh học hoạt hóa
2.6.1. Lập phương trình đường chuẩn xanh methylen
Để khảo sát sự thay đổi nồng độ xanh methylen (MB) trong quá trình hấp phụ, ta sử dụng phương pháp phân tích quang phổ UV–VIS trên thiết bị UV–VIS Genesis 10 (Thermo Spectronic). Trong phương pháp này, xây dựng đường chuẩn mô tả mối quan hệ giữa nồng độ MB và hằng số cường độ hấp thu A, dựa trên sự thay đổi nồng độ dung dịch MB theo Bảng 2.5. Bước sóng hấp thu tối ưu của dung dịch MB được xác định bằng cách quét bước sóng dung dịch MB 50 mg/L trong vùng bước sóng từ 200 – 900 nm trình bày trong Hình 2.9.
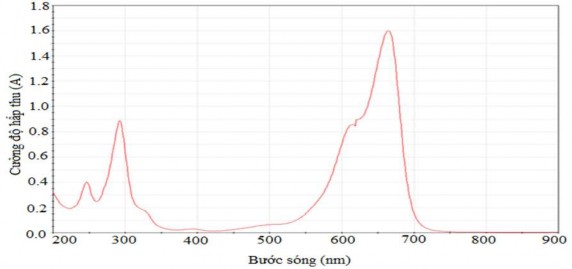
Hình 2.9. Độ hấp thu của MB nồng độ 50mg/L được quét theo bước sóng
Kết quả trên Hình 2.9 cho thấy chọn bước sóng λ = 665 nm là bước sóng tối ưu cho việc khảo sát sự thay đổi nồng độ của MB trong quá trình hấp phụ trên các mẫu than sinh học hoạt hóa.
Quy trình lập đường chuẩn xanh methylen được xây dựng như sau:
Bảng 2.5. Quy trình lập đường chuẩn
1 | 2 | 3 | 4 | 5 | 6 | |
Hút V ml MB chuẩn 50 mg/L | 0 | 1 | 3 | 6 | 9 | 12 |
Định mức nước cất | Định mức 50 ml | |||||
Nồng độ MB (mg/L) | 0 | 1 | 3 | 6 | 9 | 12 |
Lắc đều, tiến hành đo quang ở bước sóng λ = 665 nm | ||||||
Có thể bạn quan tâm!
-
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 5
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 5 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 6
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 6 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 7
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 7 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 9
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 9 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 10
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 10 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 11
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 11
Xem toàn bộ 180 trang tài liệu này.
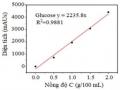
Kết quả phương trình đường chuẩn MB (Hình 2.10) thể hiện quan hệ giữa nồng độ MB và độ hấp thu (A) ở bước sóng λ = 665 nm, với R2= 0,9994 phụ thuộc tuyến tính với nồng độ MB theo phương trình: y = 0,2145x + 0,0038 (2.5)
Trong đó: y: độ hấp thu (A) và x: nồng độ dung dịch MB (mg/L)
3
Độ hấp thu (A)
2.5
2
1.5
1
0.5
0
y = 0.2145x + 0.0038 R² = 0.9994
0 5 10 15
Nồng độ xanh methylen (mg/L)
Hình 2.10. Phương trình đường chuẩn xanh methylen