2.6.2. Các yếu tố ảnh hưởng đến quá trình hấp phụ
2.6.2.1. Ảnh hưởng của tốc độ khuấy
Thí nghiệm ảnh hưởng của tốc độ khuấy được thực hiện thay đổi từ 50 vòng/ phút đến 400 vòng/ phút. Các thông số còn lại được cố định ở điều kiện: hàm lượng vật liệu hấp phụ là 1 g/L, nồng độ MB 100 mg/L, thời gian 480 phút, pH =7, quá trình hấp phụ được thực hiện trên máy Jartest.

Hình 2.11. Thiết bị Jartest Ovan model JT60E sử dụng hấp phụ MB.
2.6.2.2. Ảnh hưởng của pH
Thí nghiệm ảnh hưởng của pH dung dịch được thực hiện bằng cách thay đổi pH dung dịch từ 3 đến 11. Các thông số còn lại được cố định ở điều kiện: hàm lượng vật liệu hấp phụ là 1 g/L, thời gian 480 phút, nồng độ MB là 100 mg/L, tốc độ khuấy là 100 vòng/ phút, theo Bảng 2.6.
Bảng 2.6. Thí nghiệm ảnh hưởng của pH
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
pH | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
Hàm lượng vật liệu hấp phụ | 1 g/L | ||||||||
Nồng độ xanh methylen | 100 mg/L | ||||||||
Tốc độ khuấy (vòng/ phút) | 100 | ||||||||
Thời gian hấp phụ | 480 phút | ||||||||
Có thể bạn quan tâm!
-
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 6
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 6 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 7
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 7 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 8
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 8 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 10
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 10 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 11
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 11 -
 Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 12
Nghiên cứu than hóa phụ phẩm nông nghiệp vỏ hạt cà phê, lõi bắp bằng phương pháp carbon hóa thủy nhiệt, ứng dụng làm vật liệu hấp phụ và xúc tác - 12
Xem toàn bộ 180 trang tài liệu này.
2.6.2.3. Ảnh hưởng của hàm lượng vật liệu hấp phụ
Thí nghiệm ảnh hưởng của hàm lượng vật liệu hấp phụ được thực hiện thay đổi từ 0,25; 0,50; 0,75; 1,00; 1,25; 1,50; 2,00 mg/L. Các thông số còn lại được cố định ở điều kiện: nồng độ MB là 100 mg/L, tốc độ 100 vòng/ phút, thời gian 480 phút, pH =7, theo Bảng 2.7.
Bảng 2.7. Thí nghiệm ảnh hưởng của hàm lượng vật liệu hấp phụ
1 | 2 | 3 | 4 | 5 | 6 | 7 | |
Hàm lượng vật liệu hấp phụ (g/L) | 0,25 | 0,50 | 0,75 | 1,00 | 1,25 | 1,50 | 2,00 |
Nồng độ MB | 100 mg/L | ||||||
Tốc độ khuấy (vòng/ phút) | 100 | ||||||
Thời gian hấp phụ | 480 phút | ||||||
2.6.2.4. Ảnh hưởng của thời gian tiếp xúc và nồng độ MB ban đầu
Thí nghiệm ảnh hưởng của thời gian tiếp xúc và nồng độ MB ban đầu đến sự hấp phụ MB được thực hiện ở điều kiện trong khoảng thời gian 16 giờ và nồng độ MB ban đầu lần lượt là 50, 100, 200, 300, 400, 500 mg/L. Các thông số còn lại được cố định: hàm lượng vật liệu hấp phụ là 1 g/L, pH = 7, tốc độ khuấy 100 vòng/ phút, theo Bảng 2.8.
Bảng 2.8. Thí nghiệm ảnh hưởng thời gian cân bằng theo từng nồng độ
Hàm lượng mvlhp : VMB, | Nồng độ xanh methylen | Thời gian (phút) | λ, nm | |
1 | 30 | |||
2 | 50 mg/L | 60 | ||
3 | 100mg/L | 90 | ||
4 | 1 g/L | 200mg/L 300mg/L | 120 | 665 |
5 | 150 | |||
6 | 400mg/L | 180 | ||
…. | 500mg/L | …. | ||
…. | 960 |
2.6.3. Phương trình đường đẳng nhiệt hấp phụ
Để xác định các phương trình đường đẳng nhiệt hấp phụ, các thí nghiệm cân bằng hấp phụ hàng loạt đã được thực hiện trong một bộ cốc (500 ml) trong đó chứa 300 ml dung dịch xanh methylen có nồng độ ban đầu lần lượt là 50, 100, 200, 300, 400, 500 mg/L, dung dịch pH =7. Khối lượng các loại vật liệu than sinh học hoạt hóa được thêm vào mỗi cốc bằng nhau tương ứng hàm lượng 1 g/L. Sau đó, các cốc được đặt vào máy Jartest để khuấy, ở tốc độ khuấy 100 vòng/ phút, nhiệt độ (30 ± 1oC) trong thời gian 16 giờ để đạt đến trạng thái cân bằng. Mẫu trắng được thực hiện theo
quy trình tương tự đối với một bộ cốc khác có cùng nồng độ thuốc nhuộm MB mà không có than hoạt tính.Tất cả các mẫu được ly tâm trước khi phân tích nồng độ xanh methylen để giảm thiểu sự ảnh hưởng của vật liệu than hoạt tính. Mỗi thí nghiệm được thực hiện lặp lại trong các điều kiện giống nhau. Nồng độ MB trong các dung dịch trước và sau khi hấp phụ được xác định bằng máy quang phổ UV – VIS ở bước sóng 665 nm.
Dung lượng hấp phụ ở trạng thái cân bằng, qe (mg/ g) tính theo công thức:
𝑞
= (బି)
ௐ
(2.6)
Trong đó: Co: là nồng độ pha loãng của thuốc nhuộm ban đầu (mg/L); Ce: là nồng độ của chất bị hấp phụ tại thời điểm cân bằng (mg/L); V: là thể tích của dung dịch (L); w: là khối lượng chất hấp phụ được sử dụng (g)
2.6.3.1. Phương trình đẳng nhiệt hấp phụ Freundlich
Mô hình đẳng nhiệt Freundlich mô tả mối quan hệ giữa dung lượng hấp phụ và nồng độ của chất bị hấp phụ tại thời điểm cân bằng thông qua biểu thức:
𝑞= 𝐾ி. 𝐶ଵ/ (2.7)
Mô hình đẳng nhiệt Freundlich [122] được biểu diễn dưới dạng phương trình logarit như sau:
log 𝑞 = log 𝐾 + ଵ . log 𝐶
(2.8)
ி
Trong đó: qe: dung lượng hấp phụ tại thời điểm cân bằng (mg/g); Ce: là nồng độ của chất bị hấp phụ tại thời điểm cân bằng (mg/L); KF và n: hằng số hấp phụ Freundlich, n đưa ra dấu hiệu về quá trình hấp phụ, KF là khả năng hấp phụ của chất hấp phụ [(mg/g)(L/mg)n]; 1/n : hằng số cường độ hấp phụ
Trên cơ sở các kết quả thực nghiệm thu được, xây dựng đồ thị mô tả mối tương quan giữa logqe và logCe, từ đó xác định được các tham số KF và n.
2.6.3.2. Phương trình đẳng nhiệt hấp phụ Langmuir
Mô hình đẳng nhiệt hấp phụ Langmuir mô tả mối quan hệ giữa dung lượng hấp phụ và nồng độ của chất bị hấp phụ tại thời điểm cân bằng thông qua biểu thức:
𝑞
= 𝑞
.ಽ.
ଵାಽ.
(2.9)
Phương trình đẳng nhiệt hấp phụ Langmuir được biểu diễn tuyến tính theo phương trình [123]:
= +ଵ
(2.10)
ொ ொ.ಽ
Trong đó: qe: dung lượng hấp phụ tại thời điểm cân bằng (mg/g); Ce: là nồng độ của chất bị hấp phụ tại thời điểm cân bằng (mg/L); Qm là dung lượng hấp phụ tối đa (mg/g) và KL là hằng số cân bằng hấp phụ Langmuir (L/mg).
Trên cơ sở các kết quả thực nghiệm, tiến hành xây dựng đồ thị mô tả mối tương quan giữa Ce/qe và Ce, từ đó xác định được các tham số qm và KL
2.6.4. Phương trình động học hấp phụ
Quy trình khảo sát động học quá trình hấp phụ xanh methylen về cơ bản là giống với các quy trình khảo sát đẳng nhiệt hấp phụ. Cụ thể, chuẩn bị 6 cốc chứa 300 mL dung dịch xanh methylen có nồng độ ban đầu lần lượt là 50, 100, 200, 300, 400, 500 mg/L. Khối lượng của các mẫu than sinh học hoạt hóa được thêm vào mỗi cốc bằng nhau tương ứng hàm lượng 1 g/L, pH dung dịch bằng 7. Sau đó, các cốc được đặt vào máy Jartest để khuấy, ở điều kiện tốc độ 100 vòng/ phút, tại mỗi mốc thời gian khác nhau trong quá trình hấp phụ thì sẽ lấy một lượng nhỏ dung dịch xanh methylen đem đi xác định nồng độ. Nồng độ của dung dịch xanh methylen được xác định ở bước sóng hấp phụ 665 nm bằng phổ UV–VIS.
Dung lượng xanh methylen bị hấp phụ tại thời điểm t, qt (mg/ g), được tính theo công thức:
𝑞௧
=(బି)
ௐ
(2.11)
Trong đó: Co: là nồng độ pha loãng của thuốc nhuộm ban đầu (mg/L); Ct: là nồng độ pha loãng của thuốc nhuộm ở thời gian bất kì (mg/L); V: là thể tích của dung dịch (L); W: là khối lượng chất hấp phụ được sử dụng (g)
Các phương trình động học được sử dụng để mô tả động học quá trình hấp phụ là phương trình động học hấp phụ biểu kiến bậc nhất Lagergren và phương trình động học hấp phụ biểu kiến bậc hai.
Mô hình động học hấp phụ bậc 1 được đề xuất bởi Lagergren và các cộng sự [124], biểu diễn dưới dạng phương trình tuyến tính như sau:
ln (qe – qt) = ln (qe) – k1t (2.12)
Trong đó : qe: dung lượng hấp phụ tại thời điểm cân bằng (mg/g); và qt dung lượng hấp phụ tại thời điểm t (mg/g), k1 là hằng số tốc độ cân bằng của phương trình động học bậc 1 (1/ phút).
Mô hình động học bậc 2 [125] được biểu diễn dưới dạng tuyến tính như sau :
௧ = ଵ + ௧
మమ
(2.13)
Trong đó: qe: dung lượng hấp phụ tại thời điểm cân bằng (mg/g); qt là dung lượng hấp phụ tại thời điểm t (mg/g) ; k2 hằng số tốc độ hấp phụ bậc 2 (g/mg min).
2.6.5. Tái sử dụng vật liệu hấp phụ xanh methylen
Vật liệu có khả năng hấp phụ MB tốt nhất là Hydrochar hoạt hóa (CHactiv và CCactiv) đã được lựa chọn để thực hiện khảo sát khả năng tái sử dụng. Mẫu CHactiv và CCactiv sau khi hấp phụ MB ổn định được thu hồi lại, được tách ra sau mỗi lần sử dụng được xử lý bằng siêu âm ở 80 W trong 10 phút trong dung dịch ethanol và sau đó rửa lại với nước cất để loại bỏ MB. Quá trình rửa vật liệu tái sử dụng dừng khi nồng độ MB trong dung dịch nước rửa không thay đổi. Vật liệu sau đó được sấy ở 105oC, thời gian 2 giờ và tái sử dụng cho lần thử nghiệm tiếp theo. Số lần tái chế được thực hiện là 6 lần.
2.7. Nghiên cứu hoạt tính của than sinh học hoạt hóa cho phản ứng thủy phân cellulose rơm rạ thành glucose.
Để khảo sát được hoạt tính của các mẫu than sinh học hoạt hóa cho phản ứng thủy phân cellulose rơm rạ thành glucose bằng thiết bị Autoclave, chúng ta cần thực hiện ba công đoạn: 1) chuẩn bị nguyên liệu giàu cellulose từ rơm rạ; 2) Chuẩn bị tổ hợp xúc tác nghiền cellulose và than sinh học hoạt hóa; 3) Khảo sát các yếu tố ảnh hưởng đến quá trình thủy phân cellulose rơm rạ thành glucose trong thiết bị Autoclave của than. Cụ thể:
2.7.1. Chuẩn bị Cellulose từ rơm rạ bằng phương pháp nổ hơi nước
Trước khi tiến hành quá trình chuyển hóa cellulose trong rơm rạ thành glucose. Rơm rạ được xử lý bằng phương pháp nổ hơi nước [126], nhằm bẻ gẫy các cấu trúc của rơm thành những phân tử nhỏ hơn. Quá trình nổ hơi nước được tính toán dựa trên hệ số làm việc SF theo biểu thức (2.14) [127], các kết quả tính toán được trình bày ở Bảng 3.8.
ቀ𝑻ି𝟏𝟎𝟎
𝑺𝑭 = 𝐥𝐠(𝒕 × 𝒆 𝟏𝟒,𝟕𝟓 ቁ) (𝟐. 𝟏𝟒)
Trong đó: t thời gian lưu (phút); T: nhiệt độ nổ hơi nước (oC)
Tiền xử lý rơm rạ bằng nổ hơi nước tiến hành trên máy SE-Parr Instrument Company USA, thiết bị có thể chịu áp lực tối đa đến 150 bar, nhiệt độ 300oC.
Rơm rạ thô
Nổ hơi nước 170 – 200 oC / 5 phút Rơm rạ nổ hơi nước
Tách hemicellulose
Rơm rạ nổ hơi nước đã tách hemicellulose
Tách lignin NaOH (1-3 % w/v)
Cellulose
Mẫu khảo sát được thực hiện trong khoảng nhiệt độ 170, 180, 190, 200oC, thời gian lưu giữ 5 phút. Rơm rạ sau khi nổ hơi được được thu hồi trong cyclone, sau đó được rửa bằng nước, sấy khô bằng không khí và đem phân tích thành phần hóa học (cellulose, hemicellulose và lignin). Sau quá trình nổ hơi nước chiết lignin ra khỏi rơm rạ nổ hơi nước bằng tác nhân kiềm có nồng độ 1 – 3%, sản phẩm cuối cùng thu được là cellulose [128, 129] theo quy trình mô tả ở Hình 2.12.
Nổ hơi nước 200 oC/ 5 phút
Hình 2.12. Quy trình xử lý rơm rạ bằng phương pháp nổ hơi nước
2.7.2. Chuẩn bị tổ hợp nghiền xúc tác than sinh học hoạt hóa/ cellulose
2.7.2.1. Ảnh hưởng của tốc độ nghiền
Hình 2.13. Máy nghiền bi Fritsch Pulverisette 6
Thực hiện khảo sát ảnh hưởng của tốc độ nghiền: Hỗn hợp than sinh học hoạt hóa (lần lượt CHhydro, CChydro; CHmagnet, CCmagnet; CHimpreg, CCimpreg; CHactiv, CCactiv; CHbiochar, CCbiochar đã được sấy ở nhiệt độ 110oC trong thời gian 24 giờ) và cellulose
được trộn với tỉ lệ Mxúc tác: MCellulose = 15% thực hiện trong máy nghiền bi (Fritsch P6, kích thước bi nghiền là 1,5 cm), tốc độ nghiền lần lượt thay đổi là 160, 260, 360, 460 vòng/ phút, cố định thời gian nghiền là 2 giờ, trước khi thực hiện phản ứng thủy phân.
Điều kiện thực hiện phản ứng thủy phân: trong 40 mL H2O (chứa 0,012% HCl), ở nhiệt độ 180oC, trong 2 giờ. Các thông số tham khảo tài liệu [2]. Hàm lượng đường khử sau quá trình thủy phân được xác định bằng phương pháp Imoto [120].
2.7.2.2. Ảnh hưởng của thời gian nghiền
Thực hiện khảo sát ảnh hưởng của thời gian nghiền: Hỗn hợp xúc tác/ cellulose được trộn với tỉ lệ Mxúc tác: MCellulose = 15%, thực hiện trong máy nghiền bi, sau đó được nghiền lần lượt các mốc thời gian 0,5, 1, 2, 3 giờ, cố định tốc độ nghiền 360 vòng/ phút, trước khi thực hiện phản ứng thủy phân. Các thông số tham khảo tài liệu [2]. Hàm lượng đường khử sau quá trình thủy phân được xác định bằng phương pháp Imoto.
2.7.3. Phản ứng thủy Cellulose rơm rạ thành glucose bằng kỹ thuật Autoclave
2.7.3.1. Khảo sát ảnh hưởng của yếu tố nhiệt độ và thời gian phản ứng đến quá trình thủy phân.
Thí nghiệm được thực hiện với tổ hợp nghiền xúc tác than sinh học hoạt hóa/ cellulose theo các điều kiện thí nghiệm chọn được ở mục 2.7.2. Điều kiện thực hiện phản ứng thủy phân: Khảo sát thời gian thủy phân thay đổi lần lượt là 0,5, 1, 2, 3, 4 giờ, cố định ở nhiệt độ 180oC, trong 40 mL H2O (chứa 0,012% HCl). Khảo sát nhiệt
độ phản ứng thủy phân thay đổi lần lượt là 120, 140, 160, 180, 200oC, cố định ở nhiệt
độ 180oC, trong 40 mL H2O (chứa 0,012% HCl). Các thông số tham khảo tài liệu [2]. Hàm lượng đường khử sau quá trình thủy phân được xác định bằng phương pháp Imoto. Ảnh hưởng của thông số nhiệt độ và thời gian thủy phân đến quá trình thủy phân cellulose thành glucose đánh giá dựa trên hiệu suất tạo thành đường khử.
2.7.3.2. Thực hiện thủy phân cellulose rơm rạ thành glucose
Sơ đồ quy trình thực hiện phản ứng thủy phân cellulose rơm rạ thành glucose được trình bày trong Hình 2.14. Phản ứng thủy phân cellulose từ rơm rạ được thực hiện trong thiết bị Autoclave với tổ hợp nghiền xúc tác/ cellulose, tỉ lệ là 15% theo khối lượng [2] thực hiện trong máy nghiền bi ở điều kiện tốc độ nghiền 360 vòng/ phút trong thời gian 2 giờ, trước khi thực hiện phản ứng thủy phân. Điều kiện thực hiện phản ứng thủy phân: trong 40 mL H2O (chứa 0,012% HCl), ở nhiệt độ 180oC
với thời gian 2 giờ. Hàm lượng đường khử sau quá trình thủy phân được xác định bằng phương pháp Imoto. Xác định hàm lượng glucose bằng phương pháp HPLC.
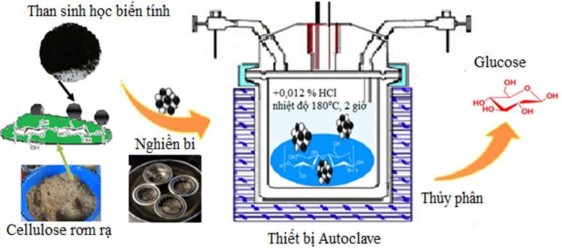
Hình 2.14. Sơ đồ quy trình thực hiện phản ứng thủy phân.
Mặt khác, Kobayashi và các cộng sự [2, 3] đã chứng minh than hoạt tính (K26) có nguồn gốc từ than cốc có thể thủy phân cellulose thành glucose dựa trên cơ chế than hoạt tính hấp phụ cellulose bằng chức năng kỵ nước và cắt liên kết glycosidic bằng các nhóm acid yếu như acid carboxylic [3]. Do đó, tác giả đã lựa chọn nghiên cứu vai trò tâm xúc tác của than sinh học hoạt hóa đối với phản ứng thủy phân cellulose rơm rạ thành glucose được thực hiện trên xúc tác than sinh học hoạt hóa có hiệu suất glucose thu được tốt nhất.
2.7.4. Kiểm tra vai trò tâm xúc tác đối với phản ứng thủy phân cellulose rơm rạ
Hydrochar hoạt hóa thủy nhiệt từ lõi bắp (CChydro) có khả năng chuyển hóa thủy phân cellulose thành glucose tốt nhất được lựa chọn để xác định vai trò tâm xúc tác. Thí nghiệm xác định tâm hoạt tính xúc tác, mẫu CChydro được xử lý bằng lần lượt bằng CH3COOH/CH3COONa (viết tắt AcOH/AcONa, pH = 4,0), NaCl (pH
= 7,0), NaHCO3 (pH = 8,3) và NaOH (pH = 12,6) để trung hòa các vị trí acid tương ứng [3]. Các mẫu không xúc tác, CChydro và CChydro đã được xử lý như trên được thực hiện phản ứng thủy phân trong môi trường 40 mL nước (chứa 0,012% HCl) bằng kỹ thuật Autoclave ở điều kiện nhiệt độ 180oC, trong 2 giờ.
2.7.5. Phương pháp xác định tổng hàm lượng đường khử và Glucose
2.7.5.1. Phương pháp xác định tổng hàm lượng đường khử
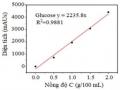
Hàm lượng đường khử được xác định bằng phương pháp Imoto, dựa vào phản ứng tạo phức màu giữa đường khử và thuốc thử 3,5 Dinitrosalicylic (DNS) [130]. Hỗn hợp có chứa 0,5 mL thuốc thử Imoto và 0,5 mL mẫu được làm nóng ở