Bảng trên cho thấy, không có sự khác biệt có ý nghĩa thống kê (p > 0,05) về hoạt độ enzym AST và ALT khi so sánh giữa các lô trong cùng một thời điểm nghiên cứu và khi so sánh giữa các thời điểm khác nhau trong cùng một lô.
+ Đánh giá khả năng gây ảnh hưởng chức năng gan: thông qua đánh giá nồng độ albumin máu (g/l) và nồng độ cholesterol máu (mmol/L):
+ Nồng độ albumin (g/l):
Nồng độ albumin máu chuột của các lô được trình bày trong bảng sau.
Bảng 3.34. Ảnh hưởng của NP(H) đối với nồng độ albumin máu
Lô chứng (n = 10) | Lô trị 1 (n = 10) | Lô trị 2 (n = 10) | p (giữa các lô) | |
Xuất phát điểm | 22,14 ± 2,55 | 21,93 ± 3,17 | 22,09 ± 3,31 | > 0,05 |
Ngày thứ 30 | 22,06 ± 2,46 | 22,17 ± 1,97 | 22,32 ± 1,60 | > 0,05 |
Ngày thứ 60 | 22,36 ± 1,93 | 23,05 ± 1,75 | 22,18 ± 1,74 | > 0,05 |
Ngày thứ 90 | 22,50 ± 2,69 | 22,03 ± 1,52 | 22,68 ± 1,61 | > 0,05 |
p (giữa các thời điểm) | > 0,05 | > 0,05 | > 0,05 |
Có thể bạn quan tâm!
-
 Kết Quả Nghiên Cứu Tác Dụng Kháng U Của Các Cao Định Lượng Np(H) Và Np(O) Trên Chuột Nhắt Trắng Mang Khối U Rắn Sarcoma Tg 180.
Kết Quả Nghiên Cứu Tác Dụng Kháng U Của Các Cao Định Lượng Np(H) Và Np(O) Trên Chuột Nhắt Trắng Mang Khối U Rắn Sarcoma Tg 180. -
 Kết Quả Đánh Giá Nồng Độ Il-2 Và Tnf-Α Máu (N = 10, Mean ± Sd).
Kết Quả Đánh Giá Nồng Độ Il-2 Và Tnf-Α Máu (N = 10, Mean ± Sd). -
 Kết Quả Đánh Giá Tác Dụng Kéo Dài Thời Gian Sống Thêm Của Cao Định Lượng Np(H) Và Np(O) Trên Chuột Mang Khối U Rắn Sarcoma Tg 180.
Kết Quả Đánh Giá Tác Dụng Kéo Dài Thời Gian Sống Thêm Của Cao Định Lượng Np(H) Và Np(O) Trên Chuột Mang Khối U Rắn Sarcoma Tg 180. -
 Ảnh Hưởng Của Các Điều Kiện Hấp Nhiệt Đến Hàm Lượng Saponin Của Rễ Củ Tam Thất
Ảnh Hưởng Của Các Điều Kiện Hấp Nhiệt Đến Hàm Lượng Saponin Của Rễ Củ Tam Thất -
 Về Tác Dụng Ức Chế Sự Phát Triển U Rắn Sarcoma Tg180 (In Vivo)
Về Tác Dụng Ức Chế Sự Phát Triển U Rắn Sarcoma Tg180 (In Vivo) -
 Về Kết Quả Đánh Giá Tác Dụng Chống Oxy Hóa Trên Chuột Mang Khối U Rắn Sarcoma Tg 180.
Về Kết Quả Đánh Giá Tác Dụng Chống Oxy Hóa Trên Chuột Mang Khối U Rắn Sarcoma Tg 180.
Xem toàn bộ 222 trang tài liệu này.

Nhận xét:
Kết quả bảng trên cho thấy: không có sự khác nhau có ý nghĩa (p > 0,05) về nồng độ albumin máu giữa các lô nghiên cứu trong cùng một thời điểm. Đồng thời, cũng không có sự khác biệt có ý nghĩa (p > 0,05) khi so sánh giữa các thời điểm trong cùng một lô.
+ Nồng độ cholesterol (mmol/L):
Nồng độ cholesterol huyết tương của chuột được trình bày trong bảng sau.
Bảng 3.35. Ảnh hưởng của NP(H) đối với nồng độ cholesterol máu
Lô chứng (n = 10) | Lô trị 1 (n = 10) | Lô trị 2 (n = 10) | p (giữa các lô) | |
Xuất phát điểm | 2,01 ± 0,37 | 2,09 ± 0,32 | 2,05 ± 0,52 | > 0,05 |
Ngày thứ 30 | 1,98 ± 0,47 | 1,92 ± 0,28 | 1,88 ± 0,49 | > 0,05 |
2,03 ± 0,53 | 1,99 ± 0,38 | 1,92 ± 0,18 | > 0,05 | |
Ngày thứ 90 | 1,95 ± 0,36 | 1,90 ± 0,53 | 1,82 ± 0,32 | > 0,05 |
p (giữa các thời điểm) | > 0,05 | > 0,05 | > 0,05 |
Ngày thứ 60
Nhận xét:
Kết quả bảng trên cho thấy: không có sự khác nhau có ý nghĩa (p > 0,05) về nồng độ cholesterol máu giữa các lô nghiên cứu trong cùng một thời điểm. Đồng thời, cũng không có sự khác biệt có ý nghĩa (p > 0,05) khi so sánh giữa các thời điểm trong cùng một lô.
+ Đánh giá khả năng gây ảnh hưởng chức năng thận: thông qua đánh giá nồng độ creatinin máu (mmol/L):
Nồng độ creatinin máu chuột của các lô được trình bày trong bảng sau.
Bảng 3.36. Ảnh hưởng của NP(H) đối với nồng độ creatinin máu
Nồng độ creatinin (mmoL/L) | p (giữa các lô) | |||
Lô chứng (n = 10) | Lô trị 1 (n = 10) | Lô trị 2 (n = 10) | ||
Xuất phát điểm | 81,14 ± 11,11 | 84,62 ± 13,64 | 85,96 ± 11,21 | > 0,05 |
Ngày thứ 30 | 82,44 ± 12,23 | 81,93 ± 13,12 | 83,89 ± 14,49 | > 0,05 |
Ngày thứ 60 | 87,62 ± 17,02 | 86,69 ± 11,80 | 82,09 ± 16,09 | > 0,05 |
Ngày thứ 90 | 84,11 ± 16,98 | 89,31 ± 12,93 | 86,92 ± 13,75 | > 0,05 |
p (giữa các thời điểm) | > 0,05 | > 0,05 | > 0,05 |
Nhận xét:
Bảng trên cho thấy: không có sự khác biệt có ý nghĩa (p > 0,05) về nồng độ creatinin giữa các lô trong cùng một thời điểm; đồng thời cũng không có sự khác biệt có ý nghĩa (p > 0,05) khi so sánh giữa các thời điểm trong cùng một lô nghiên cứu.
- Ảnh hưởng của cao định lượng NP(H) đối với cấu trúc đại thể và vi thể một số cơ quan
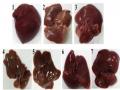
+ Hình ảnh đại thể gan, lách, thận
Hình ảnh đại thể gan, lách và thận của chuột đại diện ở các lô nghiên cứu được trình bày trong hình 3.15.
A
B
C
Hình 3.15. Hình ảnh đại thể gan, lách, thận của chuột ở các lô nghiên cứu
Ghi chú: A: lô chứng (chuột số 28); B: lô trị 1 (chuột số 5); C: lô trị 2 (chuột số 16)
Hình ảnh đại thể gan, lách và thận của các lô nghiên cứu hoàn toàn bình thường; không có sự khác biệt giữa các lô nghiên cứu. Quan sát đại thể bằng mắt thường dưới kính lúp, cho thấy: màu sắc, hình thái của gan, lách và thận ở hai lô dùng cao định lượng NP(H) (hình B và hình C) có màu nâu đỏ thẫm đồng đều, bề mặt nhẵn, không có u cục hoặc xuất huyết, có đàn hồi khi ấn xuống. Không có sự khác biệt khi so với hình ảnh gan, lách, thận của chuột ở lô chứng (hình A).
* Hình ảnh vi thể gan, lách và thận:
Kết quả nghiên cứu về mô bệnh học gan, lách, thận chuột cho thấy:
- Hình ảnh vi thể gan: Ở các lô đều thấy: các bè gan, tiểu thùy gan và tế bào gan bình thường, không có hình ảnh thoái hóa hoặc viêm, tĩnh mạch trung tâm không giãn, các xoang mạch nan hoa và tĩnh mạch khoảng cửa không xung huyết.
a
b
c
123
Hình 3.16. Hình ảnh vi thể gan của chuột ở các lô nghiên cứu
Ghi chú: Nhuộm HE (400X); (a): lô chứng (chuột số 29); (b): lô 2 (chuột số 04); (c): lô 3 (chuột số 16)
a
b
c
-Hình ảnh vi thể lách: Tại tất cả các lô: Lách rõ cấu trúc vùng vỏ và vùng tủy, vùng vỏ có các nang lympho lớn với động mạch bút lông. Không có xuất huyết, hoại tử. Vi thể lách được thể hiện trong hình sau.
![]()
![]()
Hình 3.17. Hình ảnh vi thể lách của chuột ở các lô nghiên cứu
Ghi chú: Nhuộm HE (400X); (a): lô chứng (chuột số 21); (b): lô 2 (chuột số 08); (c): lô 3 (chuột số 12)
b
c
a
- Hình ảnh vi thể thận: Ở tất cả các lô đều thấy: Các tiểu cầu thận với mao cuộn mạch rõ, các tế bào ống thận bình thường. Ảnh vi thể thận được thể hiện trong hình sau.
Hình 3.18. Hình ảnh vi thể thận của chuột ở các lô nghiên cứu
Ghi chú: Nhuộm HE (400 X); (a): lô chứng (chuột số 20); (b): lô 2 (chuột số 09); (c): lô 3 (chuột số 22)
Như vậy, NP(H) dùng đường uống cho chuột cống trắng với liều 200 mg/kg/24h và 900 mg/kg/24h, uống liên tục trong 90 ngày, không gây tổn thương trên gan, thận, lách của chuột.
CHƯƠNG 4 BÀN LUẬN
Tam thất được sử dụng dưới 2 dạng là Tam thất sống (raw) và Tam thất chế biến (processed). Phương pháp chế biến phổ biến là hấp nhiệt (steamed). Nhiều tác giả đã nghiên cứu ảnh hưởng của quá trình chế biến, đặc biệt là phương pháp hấp nhiệt đến thành phần hoá học của Tam thất. Các yếu tố được quan tâm là nhiệt độ (100ºC và 120ºC), dạng nguyên liệu (tươi và khô), phương pháp chế biến (hấp và nướng) và thời gian chế biến [116], [135]. Kết quả nghiên cứu của các tác giả cho thấy, hàm lượng các ginsenosid Rg1, Rb1, Rc, Rd, Re và notoginseng R1 giảm dần trong quá trình hấp, trong khi đó hàm lượng các notoginseng Rg3, Rh1, Rh2, Rk3, Rh4, Rk1 và Rg5 tăng lên [63], [116]. Sự thay đổi này có thể do sự thuỷ phân nhóm glycosid ở vị trí C-20 hoặc sự loại nhóm hydroxyl ở vị trí này. Các saponin được xem là thành phần chính tạo nên các tác dụng dược lý của các thực vật thuộc chi Panax nói chung và của Tam thất nói riêng. Sự thay đổi hàm lượng các ginsenosid do quá trình chế biến vì thế làm thay đổi tác dụng của Tam thất sau khi chế biến. Tam thất chưa chế biến được cho là có tác dụng cầm máu, ngăn ngừa xuất huyết, giảm bầm tím, cải thiện lưu thông máu, giảm sưng và đau. Trong khi đó, dạng đã chế biến được cho là có tác dụng bổ máu, kích thích sản xuất các tế bào máu trong trường hợp thiếu máu, tác dụng tăng cường miễn dịch, chống oxy hóa, ức chế khối u và tế bào ung thư. Các kết quả nghiên cứu của y học hiện đại đã chứng minh tác dụng của Tam thất thay đổi sau khi chế biến. Tam thất hấp và các saponin có trong Tam thất hấp có tác dụng kích thích sự phát triển của tuỷ xương, tăng cường tạo máu, tăng miễn dịch, chống oxy hóa [82], [115]. Tác dụng ức chế kết tập tiểu cầu và chống đông máu của Tam thất dạng hấp mạnh hơn so với dạng chưa hấp, tác dụng tăng lên cùng thời gian hấp [136]. Đặc biệt tác dụng kháng u của Tam thất tăng lên đáng kể sau khi hấp [81], [137], [138]. Ngoài ra, tác dụng kháng u cũng tăng lên sau hấp
đối với các thực vật chi Panax khác như nhân sâm (Panaxginseng), sâm Mỹ (Panax quinquefolius L.), sâm Việt Nam (Vietnamese ginseng) [139], [140], [141], [142].
Nhiều nghiên cứu công bố về hàm lượng các saponin trong Tam thất cũng như các thực vật khác trong chi Panax khi hấp biến đổi theo hướng có lợi cho tác dụng kháng u [138], [140], [142]. Trên cơ sở đó, nghiên cứu này của chúng tôi đã khảo sát ảnh hưởng của phương pháp chế biến hấp nhiệt đến hàm lượng các saponin trong rễ củ Tam thất, xác định điều kiện tối ưu của hấp nhiệt để tạo được sản phẩm cao chiết cho tác dụng kháng u tốt. Đồng thời, chúng tôi cũng đã tiến hành nghiên cứu đánh giá và so sánh tác dụng kháng u của các saponin phân lập từ rễ củ Tam thất và các cao định lượng chiết xuất từ rễ củ Tam thất hấp và không hấp, từ đó đưa ra bằng chứng về tác dụng kháng u của chế phẩm cao chiết. Bên cạnh đó, các tác dụng tăng cường miễn dịch, chống oxy hóa là những tác dụng cũng tăng lên ở Tam thất hấp, và đều là những tác dụng quý, làm tăng cường hiệu quả kháng u, hỗ trợ điều trị ung thư của Tam thất. Vì vậy, nghiên cứu này cũng đã đánh giá tác dụng tăng cường miễn dịch, chống oxy hóa ngay trên chuột mang khối u của cao định lượng chiết từ Tam thất hấp, so sánh với các tác dụng này của cao định lượng chiết từ Tam thất không hấp. Sau khi đã có được kết quả về quy trình hấp nhiệt, khẳng định được tác dụng vượt trội của cao định lượng chiết từ Tam thất hấp, cho thấy tiềm năng ứng dụng sản phẩm cao định lượng chiết từ Tam thất hấp cho hỗ trợ điều trị ung thư. Nghiên cứu của chúng tôi đã tiến hành bước tiếp theo là đánh giá độc tính cấp và bán trường diễn của cao định lượng chiết từ Tam thất hấp. Việc đánh giá độc tính cấp và bán trường diễn là nghiên cứu cần phải tiến hành đối với một dạng bào chế mới trước khi được phép đưa vào sử dụng trên lâm sàng.
4.1. Về ảnh hưởng của phương pháp chế biến hấp nhiệt đến hàm lượng các saponin của rễ củ Tam thất
4.1.1. Hàm lượng saponin của Tam thất chưa hấp
Kết quả định lượng cho thấy dược liệu Tam thất khi chưa chế biến có hàm lượng các saponin Rg1, Re, Rb1, Rh1, Rd lần lượt là 4,52; 0,76; 4,94; 0,03 và 1,29% tính theo dược liệu khô kiệt. Không phát hiện được hợp chất Rg3 trong mẫu dược liệu chưa chế biến. Kết quả định lượng này khá phù hợp với các nghiên cứu đã được công bố của các tác giả trong và ngoài nước.
Năm 2003, nhóm nghiên cứu của Dong T.T và cộng sự đã định lượng một số hoạt chất trong 28 mẫu P.notoginseng thu hái ở các vùng khác nhau ở Trung Quốc, kết quả cho thấy hàm lượng Rg1 dao động từ 2,464% đến 3,817%, Rb1 từ 2,280 đến 3,151%, Rd từ 0,544 đến 1,250% tính theo dược liệu khô kiệt [143]. Trong khi đó hàm lượng các saponin này trong mẫu của chúng tôi lần lượt là 4,52; 4,94 và 1,29%.
Nghiên cứu của J. Guan và cộng sự trên P. notogingseng cho thấy Rg1 có hàm lượng dao động từ 3,122 đến 3,971%; Re có hàm lượng từ 0,342 đến 0,528%; Rb1 từ 1,844 đến 2,534% và Rd từ 0,593 đến 0,877% tính theo dược liệu khô kiệt [144]. Kết quả này khá tương đồng với kết quả định lượng của chúng tôi. Kết quả nghiên cứu của Wang Dong và cộng sự năm 2013 trên 70 mẫu P.notoginseng cho thấy hàm lượng Rg1 dao động từ 0,71 đến 8,05%, Re từ 0,12 đến 1,72%, Rb1 từ 1,18 đến 6,50%, Rd từ 0,17 đến 1,36% tính theo dược liệu khô kiệt [145].
Nghiên cứu của Wan J.B và cộng sự năm 2006 trên 28 mẫu P. notoginseng thu ở các vùng khác nhau cũng cho kết quả tương tự, với hàm lượng Rg1 dao động từ 2,694 đến 3,910%, Re từ 0,338 đến 0,514%, Rb1 từ 2,670 đến 3,805%, Rd từ 0,547 đến 0,910% tính theo dược liệu khô kiệt [146]. Trong đó, nhóm tác giả cũng không phát hiện được Rg3 trong dược liệu chưa chế biến.