1 gà ốm nặng đã chết (ĐC 4) vào ngày thứ tư, 2 gà chết vào ngày thứ năm (ĐC 2 và ĐC 3), 2 gà còn lại đều bỏ ăn.
- Từ ngày thứ sáu sau khi công, gà ốm lô tiêm vacxin đã hồi ph c, ăn uống tr lại bình thường như các gà khác trong cùng lô cho đến ngày cuối cùng của thí nghiệm (ngày thứ mười). Ở lô đối chứng, 1 gà chết vào ngày thứ sáu và 1 gà còn lại chết vào ngày thứ sau khi công.
Như vậy số gà được tiêm vacxin H5N1 Re-1 đều sống sót 100% sau khi công cường độc. Trong khi đó, lô gà đối chứng chết 100%. Thời gian chết trong vòng từ ngày thứ ba đến ngày thứ bảy sau khi công cường độc. Kết quả này cho thấy vacxin H5N1 Re-1 đã bảo hộ cho gà chống lại chủng virus cúm A H N1thuộc clade 7.
Để đánh giá rõ hơn về hiệu lực của vacxin A/H N1 e-1 trong việc kích thích đáp ứng miễn dịch, chúng tôi lấy máu lô gà thí nghiêm (tiêm vacxin) vào ngày thứ 10 sau khi công (trước khi hủy gà) và xét nghiệm b ng phản ứng ngăn tr ngưng kết hồng HI. Kết quả cho thấy tất cả các mẫu đều cho thấy có sự tăng hiệu giá kháng thể so với trước khi công, thậm chí có mẫu tăng cao hơn 4 đơn vị pha loãng (gà VX1). Như vậy kháng thể do vacxin tạo ra không những có thể bảo hộ cho gà chống lại virus mà còn có thể được kích thích b i virus công cường độc mà được tăng cao thêm. Điều này có ý nghĩa trong thực tế là nếu gà được tiêm phòng tốt có thể có sức đề kháng chống bệnh tốt.
Kết quả này cũng có thể là một lý giải tại sao cho đến nay chúng ta chưa phát hiện thấy virus A/H5N1 clade 7 bất kỳ ổ dịch nào. Đó là do, nhiều đàn gà nếu đã được tiêm phòng vacxin H5N1 Re-1 và đã có kháng thể bảo hộ, sẽ có khả năng chống lại sự nhiễm virus A/H5N1 clade 7 nếu có tiếp xúc.
Kết quả đánh giá hiệu lực của vacxin cúm gia cầm H5N1 Re-1 của Trung Quốc sản xuất đối với virus cúm A/H5N1clade cũng phù hợp với kết quả của các thí nghiệm đánh giá hiệu lực của vacxin này với các virus cúm A/H5N1thuộc các clade khác như clade 1 và clade 2.3.4 mà Trung tâm Chẩn đoán Thú y Trung ương đã từng tiến hành, cũng như của một số nhà khoa học Mỹ (Pfeiffer và cs,
2010) đã tiến hành tại Mỹ khi sử d ng các virus cúm gia cầm H N1 phân lập Việt Nam thuộc các clade 2.3.2 và 2.3.4 (Pfeiffer và cs, 2010).
Kết quả này cũng cho thấy sự tương đồng về di truyền và kháng nguyên (thông qua phản ứng HI) giữa virus vacxin và virus công cường độc không phải là yếu tố quyết định duy nhất để dự đoán khả năng bảo hộ của vacxin (sự tương đồng kháng nguyên thông qua phản ứng HI rất thấp, hoặc gần như không có) vì kháng thể bảo hộ là kháng thể có khả năng trung hòa virus chứ không phải chỉ riêng kháng thể kháng HA. Có một điều quan trọng là vacxin đó có khả năng kích thích con vật có đáp ứng sinh kháng thể đủ cao để có thể giúp bảo hộ cho gia cầm chống lại subtype virus cúm A/H5N1không mắc bệnh và chết. Trong thí nghiệm này, gà được tiêm vacxin có đáp ứng kháng thể khá tốt với hiệu giá kháng thể HI G T trung bình là ,6log2 đã chứng tỏ nhận định trên. Tuy nhiên có một gà có hiệu giá kháng thể HI log2 đã có dấu hiệu mắc bệnh nhẹ trong vòng 3 ngày từ ngày thứ ba đến ngày thứ năm sau khi công cường độc, rồi sau đó hồi ph c khỏe lại. Đây có lẽ chỉ là hiện tượng cá thể, vì toàn bộ số gà được tiêm vacxin đều vẫn khỏe mạnh và bản thân cá thể này cũng không chết khi bị công cường độc.
Các loài thủy cầm, dù trên thực tế ít được tiêm phòng hơn so với gà, nhưng với kết quả gây bệnh thí nghiệm đã tiến hành trên cho thấy thủy cầm không bị nhiễm virus (vịt) hoặc có thể bị nhiễm, nhưng không bị nặng và không có triệu chứng (ngan) do vậy không có các ổ dịch trên thủy cầm gây ra b i virus này. Kết quả giám sát virus cúm gia cầm H5N1 Trung Quốc cũng chỉ phát hiện thấy sự có mặt của virus này trên các đàn gà, mà không có trên thủy cầm cũng phù hợp với kết quả thí nghiệm của chúng tôi (Jiang và cs, 2010).
KẾT LUẬN V ĐỀ NGHỊ
Có thể bạn quan tâm!
-
 Kết Quả Đ Nh Gi Đ C Lực Của Virus C A/h5N1C A/h5N1 Cl De 7 T Ên Gi Cầm
Kết Quả Đ Nh Gi Đ C Lực Của Virus C A/h5N1C A/h5N1 Cl De 7 T Ên Gi Cầm -
 Kết Quả Đ Nh Gi Đ Bài Thải Củ I T Ên Đ Ng Vật Thí Nghiệm Gây Nhiễ
Kết Quả Đ Nh Gi Đ Bài Thải Củ I T Ên Đ Ng Vật Thí Nghiệm Gây Nhiễ -
 X C Định Đặc Tính Kh Ng Ng Yên Củ C C Chủng I C A/h5N1 Cl De 7 Phân Lập Ở Việt N
X C Định Đặc Tính Kh Ng Ng Yên Củ C C Chủng I C A/h5N1 Cl De 7 Phân Lập Ở Việt N -
 Nghiên cứu một số đặc tính sinh học của vi rút cúm A/H5N1 Clade 7 phân lập ở Việt Nam - 18
Nghiên cứu một số đặc tính sinh học của vi rút cúm A/H5N1 Clade 7 phân lập ở Việt Nam - 18 -
 Nghiên cứu một số đặc tính sinh học của vi rút cúm A/H5N1 Clade 7 phân lập ở Việt Nam - 19
Nghiên cứu một số đặc tính sinh học của vi rút cúm A/H5N1 Clade 7 phân lập ở Việt Nam - 19 -
 Nghiên cứu một số đặc tính sinh học của vi rút cúm A/H5N1 Clade 7 phân lập ở Việt Nam - 20
Nghiên cứu một số đặc tính sinh học của vi rút cúm A/H5N1 Clade 7 phân lập ở Việt Nam - 20
Xem toàn bộ 162 trang tài liệu này.
Kết luận
1) Đã tiến hành thu thập mẫu swab gà nhập lậu tại 2 huyện Cao Lộc và Lộc Bình tỉnh Lạng Sơn, xét nghiệm b ng phản ứng T-PCR phát hiện được 15 mẫu dương tính cúm A H N1 và phân lập được 0 chủng virus cúm A H N1 thuộc clade lần đầu tiên xuất hiện Việt Nam.

2) Giải trình tự gen H , N1 và cho thấy virus cúm A/H5N1 clade 7 Việt Nam có sự khác biệt rất lớn về di truyền, đặc biệt là gen H5 so với các clade virus khác. Các chủng virus thuộc clade của Việt Nam cũng phân thành 2 nhóm với sự khác biệt về nucleotide và axit amin cấp độ gen HA giữa hai phân nhóm của virus clade được phát hiện tại Việt Nam (nhóm A và B) tương ứng đạt mức độ trung bình 4,1% và , %, với sự thay thế hơn 30 axit amin giữa các virus của hai nhóm này.
3) Chủng virus cúm A/H N1 clade phân lập Việt Nam thích nghi tốt trên các môi trường nuôi cấy: đạt hiệu giá 107,9EID50 trên phôi trứng gà và hiệu giá 107,3TCID50 trên môi trường tế bào xơ phôi gà.
Kết quả xác định độc lực của của virus cúm A H N1 clade trên động vật thí nghiệm cho thấy:
- Virus có độc lực cao, gây chết 100% số gà gây bệnh, với thời gian gây chết trung bình từ ,9-6,2 ngày.
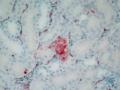
- Virus gây nhiễm đa phủ tạng và phát triển trong các tổ chức như não, t y, phổi, thận, gan, lách, ruột của gà. Ở những cơ quan này có nồng độ virus khác nhau, não là nơi virus có thể phát triển đạt nồng độ cao nhất.
- Virus cúm A/H N1 clade , có khả năng gây nhiễm cho ngan, không gây nhiễm cho vịt và hoàn toàn không có độc lực với 2 loài thuỷ cẩm này.
Kết quả nghiên cứu đã cho thấy virus cúm A/H5N1 clade 7, A/Chicken/Vietnam/NCVD-016 2008, phân lập từ gia cầm nhập lậu là virus có độc lực cao và có khả năng gây bệnh trên gà, nhưng kéo dài thời gian bài thải virus trước khi chết, điều này cũng làm tăng yếu tố nguy cơ cho sức khoẻ của con người.
4) Đặc tính kháng nguyên thông qua phản ứng HI cho thấy virus cúm A H N1 clade cũng có sự khác biệt rất lớn về mặt kháng nguyên (ít tương đồng) với các clade khác đang lưu hành Việt Nam. Sự tương đồng giữa các virus trong cùng clade Việt Nam cũng không cao (<10 ÷ 20).
5) Vacxin cúm A/H5N1 Re-1 do Trung Quốc sản xuất và được sử d ng Việt Nam có tác d ng bảo hộ tốt chống lại virus cúm A/H5N1clade 7, với tỷ lệ sống sót sau công cường độc là 100% (lô đối chứng chết 100%).
Đề nghị
- Tiếp t c tiến hành giám sát virus trên gia cầm và chim hoang dã Việt Nam để giám sát khả năng dòng virus cúm A/H5N1 clade 7 cũng như các clade khác có khả năng lây lan.
- Tiếp t c nghiên cứu về khả năng bảo hộ của các loại vacxin cúm gia cầm khác hiện nay đang được sử d ng tại Việt Nam chống lại virus cúm clade này khi mà virus này đã gây nên dịch tại Trung Quốc và yanmar, đặc biệt là Trung Quốc đã sản xuất riêng một loại vacxin chế b ng virus cúm A H N1clade này.
- Tiếp t c nghiên cứu về di truyền các gen khác của virus cúm A H N1clade , cũng như các clade khác để phát hiện và đánh giá khả năng tái tổ hợp của các chủng virus cúm gia cầm có mặt Việt Nam.
T I LIỆU THAM KHẢO
TIẾNG VIỆT
Bùi Quang Anh (200 ), áo cáo v d ch c gia cầm, Hội nghị kiểm kiểm soát dịch cúm gia cầm khu vực châu Á do FAO, OIE tổ chức, từ 23 – 2 tháng 2 năm 200 , thành phố Hồ Chí inh.
Ban chỉ đạo Quốc gia phòng chống bệnh cúm gia cầm (2005), Báo cáo tổng kết công tác 2 năm phòng chống dịch cúm gia cầm, Hội nghị tổng kết 2 năm phòng chống dịch cúm gà, ngày 18 tháng 4 năm 200 , Hà Nội.
Lê Trần Bình, Lê Thanh Hòa, Đinh Duy Kháng, Phan Văn Chi, Nông Văn Hải, Nguyễn Thị Bích Nga, Trương Nam Hải (2006) Phân tích mối tương đồng kháng nguyên và miễn dịch của virus cúm A, các chủng cường độc đương nhiễm và các chủng vaccine cúm A/H5N1 . Tạp chí Công nghệ Sinh học 4(3): 291-296.
Lê Trần Bình (200 ) Báo cáo tổng kết đề tài độc lập cấp nhà nước: “Nghiên cứu xây dựng qui trình sản xuất vaccine cúm A/H5N1 cho gia cầm” (2006 - 2007). Trung tâm Thông tin và Tư liệu Quốc gia và Bộ Khoa học và Công nghệ, Hà Nội.
Trương Văn Dung, Nguyễn Viết Không (2004). ột số hoạt động nghiên cứu khoa học của Viện Thú y Quốc gia về bệnh Cúm gia cầm và giải pháp khoa học công nghệ trong thời gian tới, Khoa học kỹ thuật thú y, 11(3), tr62-68.
Nguyễn Tiến Dũng, alik Peiris, obert Webster, Đào Thanh Vân, Bùi Ngọc Anh, Nguyễn Thế Vinh, Kent Inui, Bùi Nghĩa Vượng, Nguyễn Viết Không, Ngô Thanh Long (2004) Nguồn gốc virus cúm gia cầm H5N1 tại Việt Nam năm 2003 - 2004. Tạp chí Khoa học Kỹ thuật Thú y 11(3): 6-14.
Lê Thanh Hoà (2004), Họ Orthomyxoviridae và nhóm virus cúm A gây bệnh cúm trên gà và người, Viện khoa học công nghệ.
Lê Thanh Hòa (2006a) Chiến lược nghiên cứu ứng d ng virus vector tái tổ hợp trong sản xuất vaccine thế hệ mới. Tạp chí Công nghệ Sinh học 4(4): 397-416. Tổng quan.
Lê Thanh Hòa (2006b) Y-sinh học phân tử (quyển 1). Nhà xuất bản Y học, Hà Nội.
Lê Thanh Hòa, Nguyễn Thị Bích Nga, Trần Quang Vui, Nguyễn Mạnh Kiên, Nguyễn Xuân Vũ, Đinh Duy Kháng, Lê Trần Bình (2008) Phát hiện biến chủng virus cúm A/H5N1 dòng Phúc Kiến gây bệnh trên gia cầm người tại Việt Nam. Tập san Hội nghị khoa học toàn quốc lần thứ tư: Hóa sinh và Sinh học phân tử ph c v nông, sinh, y học và công nghiệp thực phẩm (Hà Nội, 16-17/10/2008).
Nguyễn Mạnh Kiên, Nguyễn Thị Bích Nga, Lê Thanh Hòa (2008) Đặc điểm gen H5 của virus cúm A/H5N1 thuộc dưới dòng Phúc Kiến (Fujian) gây bệnh trên gia cầm và người tại Việt Nam phân lập năm 200 . Tạp chí Y-Dược học quân sự, 33(8), pp36- 41.
Lê Văn Năm (2004) Bệnh cúm gà. Tạp chí Khoa học Kỹ thuật Thú y 11(1): 81-86. Nguyễn Tiến Minh, Bạch Thị Như Quỳnh, Nguyễn Thị Ngọc Diệp, Bùi Hoàng Anh,
Dương Hồng Quân, Nguyễn Thị Hồng Hạnh, Nguyễn Thị Thu Trang, Nguyễn Thanh Liêm, Nông Văn Hải, Lê Thanh Hoà, Đinh Duy Kháng, Lê Trần Bình
(2004) Tách dòng và phân tích trình tự gen mã hóa hemagglutinin (HA) của virus cúm A (H N1) từ một bệnh nhân. Tạp chí Công nghệ Sinh học 2(3): 279-286.
Nguyễn Thị Lan Phương, Lê Văn Hiệp (2006) Nghiên cứu sản xuất vaccine phòng chống cúm A/H5N1 cho người trên phôi gà từ chủng NIBRG-14 tại Viện vaccine và sinh phẩm y tế, Nha trang. Tạp chí Y học dự phòng (84): -10.
Bạch Thi Như Quỳnh (2006) Nghiên cứu tạo giống từ chủng gốc NIBRG - 14 để ph c v sản xuất vaccine cúm H N1. Luận văn Thạc sĩ sinh học, Viện Sinh thái và tài nguyên sinh vật.
Tô Long Thành (2006), “Thông tin cập nhật về cúm gia cầm và vacxin phòng chống bệnh cúm gia cầm”, Tạp chí khoa học kĩ thuật thú y, tr. 66 - 76.
Tô Long Thành (200 ), Các loại vacxin cúm gia cầm và đánh giá hiệu quả tiêm phòng, Tạp chí khoa học kĩ thuật thú y,14(2), Tr.84 -91.
Nguyễn Thị Kim Tiến (2005) Dịch tễ học, virus học bệnh cúm A(H N1) trên người tại khu vực phía Nam. Tạp chí Y học thực hành 1 (8): 46-49.
http://cucthuy.gov.vn: Trang web của C c Thú y.
TIẾNG ANH
Alexander DJ (2007) An overview of the epidemiology of avian influenza. Vaccine 25(30): 5637-44. Review.
Aiki-Raji, C. O., Aguilar, P. V., Kwon, Y.-K., Goetz, S., Suarez, D. L., Jethra, A. I., Nash, O., et al. (2008). Phylogenetics and Pathogenesis of Early Avian Influenza Viruses (H5N1), Nigeria. Emerging Infectious Diseases, 14(11), 1753-1755. Centers for Disease Control and Prevention. Retrieved from http://www.cdc.gov/eid/content/14/11/1753.htm
Antarasena, C., Sirimujalin, R., Prommuang, P., Blacksell, S.D., Promkuntod, N., Prommuang, P., 2006. Tissue tropism of a Thailand strain of high- pathogenicity avian influenza virus (H5N1) in tissues of naturally infected native chickens (Gallus gallus), Japanese quail (Coturnix coturnix japonica) and ducks (Anas spp.). Avian Pathol. 35, 250–253.
Aoki FY, Boivin G, Roberts N (2007) Influenza virus susceptibility and resistance to oseltamivir. Antivir Ther 12(4B): 603-616. Review.
Arinaminpathy N, McLean AR (2008) Antiviral treatment for the control of pandemic influenza: some logistical constraints. J R Soc Interface 5(22): 545-553.
Baigent SJ, McCauley JW (2001) Glycosylation of haemagglutinin and stalk-length of neuraminidase combine to regulate the growth of avian influenza viruses in tissue culture. Virus Res 79(1-2): 177-185.
Basler CF (2007) Influenza viruses: basic biology and potential drug targets. Infect Disord Drug Targets 7(4): 282-93. Review.
Bauer TT, Ewig S, odloff AC, üller EE (2006) Acute respiratory distress syndrome and pneumonia: a comprehensive review of clinical data. Clin Infect Dis 43(6): 748-756. Review.
Beard C.W. Avian Influenza. In Foreign Animal Diseases. Richmond, VA: United States Animal Health Association, 1998; 71-80.
Bender C, Hall H, Huang J, Klimov A, Cox N, Hay A, Gregory V, Cameron K, Lim W and Subbarao K (1999) Characterization of the surface proteins of influenza A (H5N1) viruses isolated from humans in 1997 - 1998. Virology 254: 115-123.
Bosch FX, Garten W, Klenk HD, Rott R (1981) Proteolytic cleavage of influenza virus hemagglutinins; primary structure of the connecting peptide between HA1 and HA2 determines proteolytic cleavability and pathogenicity of avian influenza viruses. Virology 113: 725-735.
Capua, I., Marangon, S., Selli, L., Alexander, D.J., Swayne, D.E., Pozza, M.D., Parenti, E., Cancellotti, F.M., 1999. Outbreaks of highly pathogenic avian influenza (H5N2) in Italy during October 1997–January 1998.Avian Pathol. 28, 455–460.
Capua, I., Mutinelli,F.,Terregino, C., Cattoli, G.,Manvell, R.J., Burlini,F., 2000. Highly pathogenic avian influenza (H7N1) in ostriches farmed in Italy. Vet. Rec. 146 (12), 356.
Capua I, Alexander DJ (2008) Ecology, epidemiology and human health implications of avian influenza viruses: why do we need to share genetic data? Zoonoses Public Health 55(1): 2-15. Review
Castrucci MR, Kawaoka Y (1993) Biologic importance of neuraminidase stalk length in influenza A virus. J Virol67: 759-764.
Cauthen AN, Swayne DE, Schultz-Cherry S, Perdue ML, Suarez DL (2000) Continued circulation in China of highly pathogenic avian influenza viruses encoding the hemagglutinin gene associated with the 1997 H5N1 outbreak in poultry and humans. J Virol 74: 6592-6599.
Chan KH, Lam SY, Puthavathana P, Nguyen TD, Long HT, Pang CM, Chan KM, Cheung CY, Seto WH, Peiris JS (2007) Comparative analytical sensitivities of six rapid influenza A antigen detection test kits for detection of influenza A subtypes H1N1, H3N2 and H5N1. J Clin Virol 38(2): 169-171.
Chen, H., G. Deng, Z. Li, G. Tian, Y. Li, P. Jiao, L. Zhang, Z. Liu, R. G. Webster, and
K. Yu. 2004. The evolution of H5N1 influenza viruses in ducks in southern China. Proc. Natl. Acad. Sci. USA 101:10452–10457.
Chen, H., Smith, G.J., Li, K.S.,Wang, J., Fan, X.H., Rayner, J.M., Vijaykrishna, D.,
Zhang, J.X., Zhang, L.J., Guo, C.T., Cheung, C.L., Xu, K.M., Duan, L., Huang, K.,
Qin, K., Leung, Y.H., Wu,W.L., Lu, H.R., Chen, Y., Xia, N.S., Naipospos, T.S.,
Yuen, K.Y., Hassan, S.S., Bahri, S., Nguyen, T.D., Webster, R.G., Peiris, J.S., Guan, Y., 2006. Establishment of multiple sublineages of H5N1 influenza virus in Asia: implications for pandemic control. Proc. Natl. Acad. Sci. 103, 2845–2850.
Chen LM, Davis CT, Zhou H, Cox NJ, Donis RO (2008) Genetic compatibility and virulence of reassortants derived from contemporary avian H5N1 and human H3N2 influenza A viruses. PLoS Pathog 4(5): e1000072.
Chen.H., 2009. Avian influenza vaccination : the experience in China Vaccines developed in China Inactivated vaccines. Rev. sci. tech. Off. int. Epiz., 2009, 28 (1), 267-274
Claas EC, Osterhaus AD, van Beek R, De Jong JC, Rimmelzwaan GF, Senne DA, Krauss S, Shortridge KF, Webster RG (1998) Human influenza A H5N1 virus related to a highly pathogenic avian influenza virus. Lancet 351:472-477
Cooley, A. J., H. Van Campen, M. S. Philpott, B. C. Easterday, and V. S. Hinshaw. 1989. Pathological lesions in the lungs of ducks infected with influenza A viruses. Vet. Pathol. 26:1–5.
Conenello GM, Zamarin D, Perrone LA, Tumpey T, Palese P (2007) A single mutation in the PB1-F2 of H5N1 (HK/97) and 1918 influenza A viruses contributes to increased virulence. PLoS Pathog 3(10): 1414-1421.
De Jong MD, Hien TT (2006) Avian influenza A (H5N1). J Clin Virol 35(1): 2-13.
Review.
De Wit E, Fouchier RA (2008) Emerging influenza. J Clin Virol 41(1): 1-6. Review. Dinh PN, Long HT, Tien NT, Hien NT, Mai Le TQ, Phong Le H, Tuan le V, Van Tan
H, Nguyen NB, Van Tu P, Phuong NT; World Health Organization/Global Outbreak Alert and Response Network Avian Influenza Investigation Team in Vietnam (2006) Risk factors for human infection with avian influenza A H5N1, Vietnam, 2004. Emerg Infect Dis 12(12): 1841-1847.
Doherty PC, Turner SJ, Webby RG, Thomas PG (2006) Influenza and the challenge for immunology. Nat Immunol 7(5): 449-55. Review.
Ducatez, M.F., Olinger, C.M., Owoade, A.A., Tarnagda, Z., Tahita, M.C., Sow, A., De Landtsheer, S., Ammerlaan, W., Ouedraogo, J.B., Osterhaus, A.D., Fouchier, R.A., Muller, C.P., 2007. Molecular and antigenic evolution and geographical spread of H5N1 highly pathogenic avian influenza viruses in western Africa. J. Gen. Virol. 88, 2297–2306.
Dung Nguyen T, Vinh Nguyen T, Vijaykrishna D, Webster RG, Guan Y, MalikPeiris JS, Smith GJ (2008)Multiple sublineages of influenza A virus (H5N1), Vietnam, 2005-2007.Emerg Infect Dis 14(4): 632-636.
Easterday, B.C., Hinshaw, V.S., Halvorson, D.A., 199 . Influenza. In: Calnek, B.W. (Ed.), Diseases of Poultry.10th ed. Iowa State University Press, Ames, Iowa, pp. 583–605.
Food and Agricultural Organization, 2008a. New avian influenza flare-ups. FAO, Geneva. http://www.fao.org/newsroom/en/news/2008/1000775/index.html.
Food and Agricultural Organization, 2008b. Viet Nam needs long-term vaccination programme against bird flu. FAO, Geneva.
Gambotto A, Barratt-Boyes SM, de Jong MD, Neumann G, Kawaoka Y (2008)Human infection with highly pathogenic H5N1 influenza virus.Lancet 371(9622): 1464- 1475. Review.
Gao W, Soloff AC, Lu X, Montecalvo A, Nguyen DC, Matsuoka Y, Robbins PD, Swayne DE, Donis RO, Katz JM, Barratt-Boyes SM, Gambotto A (2006) Protection of mice and poultry from lethal H5N1 avian influenza virus through adenovirus-based immunization. J Virol 80(4): 1959-1964.