dimethoxy-4-hydroxybenzandehit isonicotinoyl hydrazon để tạo phức với chì và dùng phương pháp phổ đạo hàm để xác định hàm lượng chì [118]. Tác giả Shiri và cộng sự định lượng chì bằng thuốc thử alizazin [142]. Ngoài ra, chì còn được xác định bằng nhiều thuốc thử khác nhau như dithizon, xylenol da cam, porpyrin…như đã trình bày ở bảng 1.1.
Bảng 1.1. Một số thuốc thử hữu cơ dùng để xác định chì
max | .104 | Ion cản | Tài liệu tham khảo | |
Dithizon | 520 | 2,5 | Không đáng kể | [155] |
Dietyldithiocacbamat | 435 | 1,3 | Cu, Hg, Zn, Fe | [155] |
4-(2-Pyridiazo resorcinol | 520 | 4,3 | Không đáng kể | [155] |
Diphenyl-cacbazon | 525 | 7,2 | Không đáng kể | [155] |
Arsenazo-III | 660 | 3,0 | Al, Cu, Th, Ti, U, Fe | [155] |
2-(2-Thiazoylazo-p-crezol) | 650 | 2,07 | Ni, Co, Zn, Fe,Cd | [155] |
1-(2-Thiazoylazo-2-naphtol) | 575 | 3,6 | Co, Zn, Fe, Mn | [155] |
2-Naphtol arsenazo-TB | 620 | 1,8 | Ti, Th | [155] |
Xylenol da cam | 580 | 2,3 | Hg, Zn, Al, Bi, Ni, Re | [155] |
Porpyrin | 479 | 22 | Cu, Ni, Mn, Cd, Ca, Mg | [155] |
Azocalixaren | 440 | 1,89 | Không đáng kể | [151] |
Có thể bạn quan tâm!
-
 Nghiên cứu khả năng tạo phức của một số dẫn xuất mới của azocalixaren với ion kim loại và ứng dụng trong phân tích - 2
Nghiên cứu khả năng tạo phức của một số dẫn xuất mới của azocalixaren với ion kim loại và ứng dụng trong phân tích - 2 -
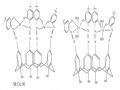
 Phức Hai Nhân Của Azocalixaren (22) Với Ion Kim Loại.
Phức Hai Nhân Của Azocalixaren (22) Với Ion Kim Loại. -
 Vài Nét Về Hóa Học Siêu Phân Tử Và Phức Host-Guest
Vài Nét Về Hóa Học Siêu Phân Tử Và Phức Host-Guest -
 Phân Tích Định Lượng Ion Kim Loại Theo Phương Pháp Đường Chuẩn
Phân Tích Định Lượng Ion Kim Loại Theo Phương Pháp Đường Chuẩn -
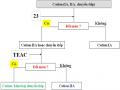
 Khảo Sát Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại
Khảo Sát Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại -
 Khảo Sát Sự Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại
Khảo Sát Sự Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại
Xem toàn bộ 130 trang tài liệu này.
Bên cạnh đó, chì cũng được xác định bằng phương pháp AAS với độ nhạy cao khi dùng vạch phổ 283,3 nm. Sự có mặt của Al, Be, Th, Zr có thể gây ảnh hưởng do việc một phần chì tham gia vào thành phần của các hợp chất bền nhiệt của các nguyên tố nói trên. Ngoài ra, chì còn được xác định bằng phương pháp ICP-MS với đồng vị được lựa chọn là 208Pb [149].
1.5.7. Thori và hợp chất
Thori là nguyên tố phóng xạ tự nhiên, số thứ tự 90 trong bảng tuần hoàn. Hàm lượng của thori trong vỏ trái đất khoảng 4.10-4%. Khoáng vật chứa nhiều thori nhất là monazit- một hỗn hợp đồng hình chứa photphat của đất hiếm và octo silicat của
thori. Thori cũng là một trong những kim loại được dùng làm thanh nhiên liệu trong lĩnh vực hạt nhân. Nguyên tử thori có cấu hình electron ở một trong hai dạng là 6d27s2 hoặc 5f16d17s2. Với cấu hình này, thori có 4 electron hóa trị và trong hợp chất số oxi hóa đặc trưng và bền là +4 [6].
1.5.8. Khả năng tạo phức của thori
Trong dung dịch ion Th4+ thủy phân rất mạnh tạo ra các hợp chất hydroxo hoặc các phức oxo dạng đa nhân. Do đó, có thể kết tủa Th(IV) bằng dung dịch amoniac hoặc hexametylenđiamin. Trong các muối của thori thì muối nitrat có độ tan lớn nhất, tan được trong cả các dung môi hữu cơ như ancol và xeton do có kích thước và điện tích ion lớn. Ngoài ra, ion Th(IV) còn có các obitan trống ở phân lớp 6d và 4f còn trống nên khả năng tạo phức của Th(IV) rất đa dạng. Trong phức chất, ion Th(IV) thông thường có số phối trí là 8. Trong thời gian gần đây, nhiều nhóm nghiên cứu đã tổng hợp được các phức chất của ion này có số phối trí là 9 như nghiên cứu của Harrowfiled [68], hoặc 10 hoặc 12 của Mohamed [116]. Đặc biệt hơn, nghiên cứu của Daly và cộng sự người Mỹ công bố năm 2010 cho biết họ đã tìm ra được phức của Th(IV) với N,N-dimetylaminodiboranat dưới dạng [Th(H3BNMe2BH3)4]. Bằng kĩ thuật chụp X-ray người ta tìm thấy trong phức chất này ion Th(IV) có tới 15 phối trí (hình 1.25) [43].
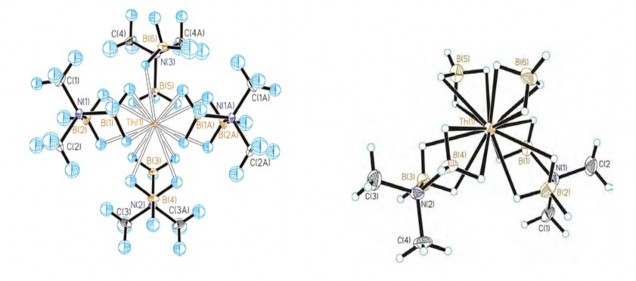
Hình 1.25. Cấu trúc phức 15 phối trí của Th(IV).
1.5.9. Một số phương pháp xác định thori
Hiện nay, các nhà khoa học sử dụng nhiều phương pháp khác nhau để xác định hàm lượng thori như phương pháp phân tích trọng lượng bằng kết tủa oxalat hoặc bằng phương pháp chuẩn độ với EDTA. Phương pháp thường được sử dụng là phương pháp trắc quang với các thuốc thử hữu cơ trình bày ở bảng 1.2.
Một nghiên cứu rất đáng chú ý của Gumrah và cộng sự cho biết, dựa vào phức chất của thori với arsenazo III, thorin và thionin, nhóm tác giả này đã định lượng được thori bằng cách sử dụng hệ thống cảm biến vi chip [64].
Trong thời gian gần đây, các nhà khoa học phân tích đã xây dựng nhiều quy trình xác định đồng thời thori và urani bằng phương pháp trắc quang như phương pháp mạng nơron hoặc phương pháp phổ đạo hàm [2,11,13,25]. Ngoài ra, thori cũng được xác định bằng các phương pháp khác như kích hoạt nơtron (NAA) tại đỉnh năng lượng 314 keV [8,146] hoặc khối phổ cao tần cảm ứng plasma (ICP-MS) với độ chính xác cao [12,130].
Bảng 1.2. Một số thuốc thử hữu cơ dùng để xác định thori
max | pH | .104 | Ion cản | Tài liệu tham khảo | |
Bromocresol orange | 560 | 0,5 | 6,4 | F-, Zr4+, Oxalat | [83] |
Desmethyldesferrithiocin | 350 | 4,7 | - | [127] | |
Ericchrom Cyanin R | 590 | 4,3 | 6,6 | Nhiều ion | [155] |
Pyrocatechol tím | 660 | 7,5 | 6,2 | Fe3+, Al3+, Ga3+ | [155] |
Chrom Azurol S | 630 | 5,2 | 14 | Tách trước Th4+ | [155] |
Arsenazo-III | 660 | 8N HCl | 8,6 | Ti4+, Hf4+, Zr4+ | [11], [155] |
Xylenol da cam | 560 | 2,5-4 | 5,6 | Al3+, Bi3+,Ce4+ | [155] |
Thoron | 410 | 4,3-9,6 | - | [155] |
Kết luận phần tổng quan
(1) Các dẫn xuất calixaren rất phong phú và những ứng dụng của chúng rất đa dạng. Hiện nay trên thế giới có rất nhiều phòng thí nghiệm lớn vẫn tiếp tục tổng hợp các calixaren mới nhằm đem lại những vật liệu có các ứng dụng như trên nhưng hiệu quả được cải thiện hơn. Calixaren là một trong những khung phân tử thuận lợi nhất cho sự phát triển của hoá học siêu phân tử. Calixaren cùng với resorcinaren và cyclodextrin đã tạo nên một bước chuyển tiếp của ngành hoá học siêu phân tử từ thế giới phẳng sang thế giới ba chiều. Dựa trên những nỗ lực trong những thập niên vừa qua về việc tạo ra những hợp chất có tính chọn lọc lập thể, chúng ta có thể dự đoán rằng sự phát triển các phương pháp tổng hợp calixaren sẽ đưa đến những dẫn xuất mới với những tính chất lý thú đóng góp vào sự phát triển của khoa học đặc biệt là công nghệ nano. Các nhà khoa học hiện nay cũng đang theo đuổi một hướng nghiên cứu hấp dẫn, đó là tạo ra những thiết bị làm việc với kích cỡ nano dựa trên calixaren, có khả năng chuyển tính chất bắt giữ đặc biệt thành tín hiệu và có thể chương trình hoá.
(2) Azocalixaren là một trong những chất mang màu có nhiều ưu điểm vượt trội so với các thuốc thử truyền thống. Khả năng tạo phức và ứng dụng những phức chất của chúng cũng rất phong phú. Đây là một trong những hướng phát triển mới của ngành thuốc thử hữu cơ ở Việt Nam nói riêng và thế giới nói chung. Hy vọng trong thời gian tới sẽ còn nhiều thuốc thử mới dựa trên khung calixaren sẽ được tổng hợp nhằm đóng góp thêm về lĩnh vực này trong phân tích.
(3) Một số phức của các azocalixaren với ion kim loại cũng đã được nghiên cứu. Tuy nhiên, các nghiên cứu về phân tích định lượng với các ion như Pb(II), Th(IV), Cr(III)…dựa vào loại thuốc thử này rất ít. Vì vậy, tìm kiếm các tín hiệu phân tích giữa các ion kim loại với loại dẫn xuất azocalixaren và xây dựng quy trình phân tích dựa vào các điều kiện tối ưu là việc rất cần thiết và có ý nghĩa.
CHƯƠNG 2. PHƯƠNG PHÁP NGHIÊN CỨU VÀ KĨ THUẬT THỰC NGHIỆM
2.1 Phương pháp nghiên cứu
Phương pháp phân tích được lựa chọn trong nghiên cứu luận án này là phương pháp trắc quang so màu trong vùng tử ngoại khả kiến (UV-VIS). Đây là một phương pháp được sử dụng nhiều khi nghiên cứu phức chất trong dung dịch. Vì vậy, để thực hiện được đề tài này, chúng tôi tiến hành các nghiên cứu theo các bước sau: Tìm tín hiệu tương tác của các dẫn xuất azocalixaren với ion kim loại bằng cách khảo sát phổ hấp thụ của thuốc thử và phức. Sau đó xác định các điều kiện tối ưu của phức như tỷ lệ tạo phức, hằng số tạo phức, pH tối ưu, các yếu tố ảnh hưởng. Khảo sát tính chất phổ của thuốc thử hữu cơ và phức như phổ hồng ngoại, Raman, cộng hưởng từ hạt nhân, phổ khối lượng. Kết hợp với các số liệu khảo sát bằng phần mềm ArgusLab với các dữ kiện phổ để đề nghị cơ chế tạo phức. Sau cùng là xây dựng quy trình phân tích các ion kim loại tạo phức với thuốc thử.
Tìm tín hiệu phức (dựa vào màu sắc, trạng thái…) bằng phổ UV-VIS
Nghiên cứu tỉ lệ phức, hằng số bền của phức, các yếu tố ảnh hưởng bằng UV-VIS
Nghiên cứu tính chất phổ của phức như FT-IR, Raman, MS, 1H-NMR…
Đề xuất cấu trúc phức
Ứng dụng phức để xây dựng quy trình phân tích định lượng
Hình 2.1. Sơ đồ nghiên cứu của luận án.
2.1.1. Khảo sát tín hiệu tương tác của thuốc thử với các ion kim loại
Chúng tôi khảo sát các tín hiệu tương tác của các thuốc thử MEAC, DEAC và TEAC với một số ion kim loại bằng cách khảo sát phổ hấp thụ của từng hệ trên máy đo UV-VIS Lambda 25 trong khoảng bước sóng từ 300700 nm. Từ phổ hấp thụ, xác định các cực đại hấp thụ của thuốc thử và phức. Khoảng cách giữa các cực đại hấp thụ càng lớn thì khả năng áp dụng phân tích của phức càng thuận lợi.
2.1.2. Nghiên cứu các điều kiện tối ưu của phức
Sau khi đã tìm được các tín hiệu phức, chúng tôi khảo sát các điều kiện tối ưu của phức như khoảng pH, độ bền của phức theo thời gian, khoảng nồng độ tuân theo định luật Beer. Các kết quả này là tiền đề để nghiên cứu thành phần của phức màu bằng phương pháp dãy đồng phân tử gam. Phương pháp này dựa trên cơ sở xác định tỉ lệ nồng độ mol của các chất tác dụng với hiệu suất tạo màu lớn nhất bằng cách chuẩn bị một dãy gồm 9 dung dịch có pH như nhau và tổng nồng độ không thay đổi. Đo mật độ quang của các dung dịch và lập đồ thị biểu diễn sự phụ thuộc của A vào tỉ lệ Me/R để suy ra tỉ lệ tạo phức. Điểm gãy trên đường biểu diễn xác định tỷ lệ giữa các hợp phần, khi phức càng bền thì điểm gãy càng rõ nét [4,7].
Hằng số bền của phức được xác định theo phương pháp Benesi-Hildebrand. Phương pháp này được đề xuất vào năm 1949 bởi hai nhà hóa học Benesi và Hildebrand khi nghiên cứu tương tác cho-nhận giữa iot với các hợp chất thơm như benzotriflo, toluen, o-xilen, p-xylen và mesitilen trong cacbon tetraclorua. Đây là một phương pháp gần đúng, phù hợp cho việc xác định bằng số bền của phức chất Host-Guest. Phương pháp này cho phép tính toán được hằng số cân bằng và hệ số hấp thụ phân tử gam mà không cần quan tâm đến hằng số phân ly của thuốc thử cũng như hằng số tạo phức hydroxo của ion kim loại. Nhiều nhóm nghiên cứu sử dụng để tính toán hằng số cân bằng cho phức chất Host (H)-Guest (G) [18,30,72,158].
Nguyên tắc của phương pháp được xây dựng như sau:
H + G ⇌ HG
Gọi x là nồng độ cân bằng của phức HG, H và G là nồng độ ban đầu của Host và Guest, ta có:
K x
(H x)(G x)
(2.1)
Trong trường hợp H >> x thì H-x H, biểu thức (2.1) trở thành:
Kx
H (G x)
Từ đó suy ra: KHG-KHx = x
Chia hai vế cho KHx, ta thu được:
G 11
(2.2)
x KH
Từ biểu thức của định luật Beer:
A= .x.l
x A
l.
Thay vào biểu thức (2.2), ta có:
.l.G 1 1
A K.H
Hay:
l.G 1 1
(2.3)
Đặt
A
Y= l.G
.K.H
và X= 1
A H
Biểu thức (2.3 ) được viết lại là:
Y = a.X + B (2.4)
Trong đó: B = 1/là hệ số.
a = 1/K.là hệ số góc của đường tuyến tính Y = a.X + B.
Từ phương trình (2.3) ta có:
1 l.G.H K A
(2.5)
Như vậy, muốn xác định hằng số K của phức Host-Guest, ta cần biết nồng độ ban đầu của “chất chủ” (H), nồng độ ban đầu của “chất khách” (G). Dùng kĩ thuật thực nghiệm xác định hệ số của phức, từ đó xác định được hằng số K. Phương trình trên đã giải quyết được bài toán tính toán hằng số K từ những hệ phức tạp; trong đó, đã bỏ qua được các yếu tố tương tác của dung môi. Tuy nhiên, để áp dụng được mô hình Benesi-Hildebrand, các điều kiện như hệ số hoạt độ coi như bằng 1, hằng số cân bằng nồng độ cũng được coi là hằng số cân bằng hoạt độ và phức phải tuân theo định luật Beer.
2.1.3. Nghiên cứu cơ chế tạo phức
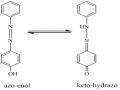
Với các loại thuốc thử hữu cơ có cấu trúc đơn giản, có thể xác định được cơ chế tạo phức bằng phương pháp truyền thống [7,9,10]. Tuy nhiên, đối với các hợp chất hữu cơ có cấu trúc phức tạp như các azocalixaren không phải lúc nào cũng có thể xác định được các hằng số phân li của thuốc thử. Vì vậy, chúng tôi kết hợp các điều kiện tối ưu với phần mềm tối ưu hóa ArgusLab 4.05 và các thông tin từ phổ như MS, IR, Raman, 1H-NMR để đề nghị cơ chế tạo phức.
Cấu trúc của thuốc thử và phức cũng như điện tích cân bằng, độ dài liên kết, vị trí các nhóm nguyên tử, vị trí ion kim loại, năng lượng cực tiểu của hệ được khảo sát bằng phần mềm ArgusLab 4.05. Đây là chương trình tối ưu hóa mới được phát triển năm 2004 bởi Thomson [152]. Điểm nổi bật của phần mềm này là thời gian tối ưu hóa nhanh, thao tác tiến hành đơn giản, cho kết quả chính xác về cấu trúc, năng lượng cực tiểu, góc liên kết, độ dài liên kết và dự đoán khả năng hình thành liên kết giữa các nguyên tử, ion. Tuy mới ra đời trong thời gian gần đây nhưng nó đã thu hút được rất nhiều sự quan tâm của các nhà khoa học trên thế giới. Nhiều nghiên cứu được công bố trên các tạp chí khoa học uy tín như công trình của các nhóm tác giả như Bano [28], Farrington [63], Janairo [74], Naz [119], Nematollahi [120], Poor