Vắc xin RotaTeq được tạo ra trong phòng thí nghiệm nghiên cứu của Merck. Vắc xin phối hợp dựa trên chủng của người và bò (WC3) tạo ra khả năng phòng chống bệnh rất tốt (70%) và phòng bệnh tiêu chảy cấp nặng (95-100%). Nói chung vắc xin này tương đối tốt, nó không gây sốt cao và có tỷ lệ đào thải thấp. Vì không có phản ứng phụ, nên khả năng gây lồng ruột ở trẻ em thấp. Vắc xin này là vắc xin 5 týp phối hợp chủng của người (G1,G2,G3,G4 và P[8]) và chủng của bò (WC3) [21,44]. Địa điểm nghiên cứu lâm sàng đã đánh giá an toàn và hiệu lực của vắc xin này khi cho trẻ sử dụng theo 2 lịch uống sau: 2,4,6 tháng tuổi và 2, 3, 4 tháng tuổi. Hiệu lực của liều
8x106FFU chống lại 100% khả năng viêm nhiễm đường ruột cấp tính và
khoảng 68,7-76,6% phòng được sự viêm nhiễm đường ruột do bất kỳ chủng virut Rota nào [20,34,55,58]. Rota Teq là vắc xin sống uống giảm độc lực sử dụng 3 liều được bắt đầu nghiên cứu từ 1991. Địa điểm nghiên cứu lâm sàng chỉ ra rằng vắc xin này rất an toàn và hiệu lực, nó phòng được >70% sự xâm nhập của bất kỳ týp Rota virut nào và 100% chống lại viêm nhiễm đường tiêu hoá cấp tính do Rota virut sau liều đầu tiên ở nghiên cứu giai đoạn II [31]. Thử nghiệm lâm sàng chỉ ra rằng, Rota Teq không làm tăng nguy cơ lồng ruột so với placebo sau 42 ngày ở bất kỳ liều sử dụng nào [60,63,72].
1.3.3. Hướng phát triển vắc xin khác
Do tính chất gây nhiễm qua đường ruột, và chủ yếu các tổn thương xảy ra tại đường ruột, các vắc xin hiện tại phát triển đều là vắc xin sống, giảm động lực để cho uống nhằm gây miễn dịch bảo vệ ngay tại đường ruột. Tuy nhiên, đã có những nghiên cứu về vắc xin đưa qua các đường khác ví dụ vắc xin bất hoạt dùng để tiêm, vắc xin đưa theo đường mũi [95,96]. Mục đích của các vắc xin thể loại này là nhằm giảm tối đa nguy cơ gây lồng ruột. Đồng thời vắc xin tiêm có khả năng kết hợp với các vắc xin khác trong chương trình tiêm chủng mở rộng. Bản thân vắc xin phòng bại liệt cũng đã được chuyển hướng sang vắc xin bất hoạt dùng để tiêm. Điều bất cập của vắc xin bất hoạt là trong khi khả năng gây miễn dịch toàn thân cao, khả năng
tạo miễn dịch bảo vệ tại đường ruột còn phụ thuộc vào nhiều yếu tố như chất lượng vắc xin, độ tinh khiết, tá dược. Trong khi vắc xin bất hoạt tỏ ra có khả năng bảo vệ cao ở chuột và khỉ thí nghiệm, vắc xin bất hoạt không bảo vệ lợn thí nghiệm khỏi tiêu chảy, mặc dù tạo ra hiệu giá kháng thể cao trong máu. Tuy nhiên, trong hoàn cảnh các vắc xin sống uống có khả năng có hiệu lực kém hơn ở các nước đang phát triển ở Châu Phi, Châu Á, so với các nước phát triển ở Châu Âu, Châu Mỹ, đây là một hướng đi mới cần tiếp tục được mở rộng [38,79,96].
Phương pháp sản xuất vắc xin Rota bao gồm vắc xin sống giảm độc lực, vắc xin tái tổ hợp, vắc xin bất hoạt,... Mỗi loại vắc xin có ưu điểm và nhược điểm riêng [59,125,127]. Tuy nhiên, vắc xin sống theo đường uống có nhiều ưu điểm hơn cả: Thứ nhất dễ sử dụng, thứ hai tạo đáp ứng miễn dịch tại đường tiêu hoá cao, do vậy, hiệu quả cao trong phòng bệnh ngay khi virut hoang dại xâm nhập vào cơ thể theo đường phân miệng, thứ ba quá trình tạo miễn dịch theo đường uống giống như tạo miễn dịch tự nhiên rất hiệu quả. Hạn chế của vắc xin sống này cũng như các vắc xin sống khác là virut quay lại độc lực mặc dù rất hiếm, để khắc phục nhược điểm này cần tuân thủ nghiêm ngặt qui trình cấy truyền chủng cũng như qui trình sản xuất vắc xin sau này.
1.4. Nghiên cứu sản xuất vắc xin Rota ở Việt Nam
POLYVAC là cơ sở đầu tiên, duy nhất tiến hành nghiên cứu và sản xuất VX Rota ở Việt Nam. Đây là VX được sản xuất từ chủng G1P[8] do Polyvac phân lập, tạo chủng gốc và chủng sản xuất vắc xin từ mẫu phân ký hiệu KH0118 của trẻ nữ bị tiêu chảy cấp do virut Rota phải nhập viện Đa khoa Khánh Hòa năm 2003 [11,109].
Dựa vào những đặc tính nổi trội của chủng G1P[8], Trung tâm Nghiên cứu Sản xuất Vắc xin và Sinh phẩm Y tế sử dụng chủng này sản xuất vắc xin Rotavin-M1 để phòng bệnh tiêu chảy do virut Rota tại nước ta.
Tế bào sử dụng cho sản xuất vắc xin Rotavin-M1 là tế bào Vero. Đây là loại tế bào mà virut Rota có thể nhân lên tốt và được WHO cho phép dùng sản xuất vắc xin cho người [22]. Các nguyên liệu, hóa chất và môi trường sử dụng là của các hãng nổi tiếng và có uy tín như Gibco, Merck, Sigma.
Tóm tắt hồ sơ chủng G1P[8]:[11,12]
Hồ sơ tóm tắt chủng virut Rota G1P[8] (KH0118)
Tên hệ thống chủng: Chủng virut Rota gốc týp G1P[8] (KH0118), chủng
giống gốc G1P[8]-MS (KH0118), chủng sản xuất G1P[8]-WS (KH0118).
Xuất xứ:
Chủng G1P[8] (KH0118) có nguồn gốc từ mẫu phân của trẻ nữ 6 tháng tuổi vào khoa Nhi, bệnh viện đa khoa tỉnh Khánh Hòa vì tiêu chảy cấp tháng 12 năm 2003. Mẫu phân được thu thập từ dự án giám sát bệnh tiêu chảy do virut Rota năm 2003-2004 của Tổ chức Y tế Thế giới (WHO) do GS. TSKH. Nguyễn Văn Mẫn làm chủ nhiệm dự án.
Trung tâm Nghiên cứu Sản xuất Vắc xin và Sinh phẩm Y tế đã xét nghiệm mẫu phân bằng phương pháp EIA cho kết quả dương tính với virut Rota, và xác định týp gây bệnh là týp G1P[8] bằng phương pháp RT-PCR. Sau đó mẫu phân được xử lý theo qui trình của phòng thí nghiệm virut đường ruột của Trung tâm Kiểm soát và Phòng ngừa bệnh tật CDC-Atlantta- Hoa Kỳ để sử dụng cho tạo chủng virut Rota gốc týp G1P[8].

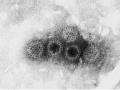
Hình 1.4. Hình ảnh hạt virut Rota G1P [8] dưới kính hiển vi điện tử tại lần cấy truyền thứ 30 trên tế bào thận khỉ tiên phát chụp dưới kính hiển vi điện tử - Viện VSDTTƯ
Qui trình tạo chủng virut Rota gốc G1P[8] (KH0118); qui trình sản xuất
vắc xin rotavin M1 và các thử nghiệm kiểm tra chất lượng [19,67,109].
Các thử nghiệm kiểm tra chất lượng | |
Mẫu phân KH0118 | Định týp bằng phương pháp RT-PCR |
Phân lập trên MA104 (3 lần liên tiếp) | Xác định sự nhân lên của virut (chỉ số OD) bằng bộ sinh phẩm chẩn đoán Rotaclone (EIA) |
Tách dòng, chọn lọc dòng trên hỗn dịch tế bào MA104 (1 lần) | |
Nhân dòng trên hỗn dịch MA104 (3 lần liên tiếp) | |
Thích nghi dòng trên MA104 một lớp (1 lần) | |
Thích nghi dòng trên tế bào thận khỉ tiên phát (3 lần liên tiếp) | Xác định sự nhân lên của virut (chỉ số OD) bằng bộ sinh phẩm chẩn đoán Rotaclone (EIA) |
Cấy truyền dòng trên tế bào thận khỉ tiên phát (6 lần liên tiếp) |
Có thể bạn quan tâm!
-
 Đánh giá tính an toàn và tính sinh miễn dịch của vắc xin Rotavin-M1 do Việt Nam sản xuất - 2
Đánh giá tính an toàn và tính sinh miễn dịch của vắc xin Rotavin-M1 do Việt Nam sản xuất - 2 -
 Sơ Đồ Cấu Trúc Hạt Virut Rota Và Các Vùng Mã Hóa Protein
Sơ Đồ Cấu Trúc Hạt Virut Rota Và Các Vùng Mã Hóa Protein -
 Tình Hình Nghiên Cứu Sản Xuất Vắc Xin Rota Trên Thế Giới
Tình Hình Nghiên Cứu Sản Xuất Vắc Xin Rota Trên Thế Giới -
![Các Vấn Đề Cần Lưu Ý Trong Thử Nghiệm Vắc Xin Trên Người [3,24]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Các Vấn Đề Cần Lưu Ý Trong Thử Nghiệm Vắc Xin Trên Người [3,24]
Các Vấn Đề Cần Lưu Ý Trong Thử Nghiệm Vắc Xin Trên Người [3,24] -
 Các Nghiên Cứu Sau Khi Vắc Xin Được Cấp Giấy Phép
Các Nghiên Cứu Sau Khi Vắc Xin Được Cấp Giấy Phép -
 Các Nguyên Vật Liệu, Dụng Cụ Dùng Cho Uống Văc Xin, Lấy Mẫu Và Xét Nghiệm Trong Phòng Thí Nghiệm
Các Nguyên Vật Liệu, Dụng Cụ Dùng Cho Uống Văc Xin, Lấy Mẫu Và Xét Nghiệm Trong Phòng Thí Nghiệm
Xem toàn bộ 163 trang tài liệu này.
Các thử nghiệm kiểm tra chất lượng | |
Thích nghi dòng trên tế bào vero một lớp (3 lần liên tiếp) | -Xác định sự nhân lên của virut (chỉ số OD) bằng bộ sinh phẩm chẩn đoán Rotaclone (EIA) -Chuẩn độ hiệu giá virut Rota bằng phương pháp miễn dịch huỳnh quang |
Cấy truyền dòng trên tế bào vero 1 lớp (13 lần liên tiếp) | |
Cấy truyền dòng trên tế bào thận khỉ tiên phát (3 lần liên tiếp) | -Xác định sự nhân lên của virut (chỉ số OD) bằng bộ sinh phẩm chẩn đoán Rotaclone (EIA) -Chuẩn độ hiệu giá virut Rota bằng phương pháp miễn dịch huỳnh quang |
Cấy truyền dòng trên tế bào vero một lớp (8 lần liên tiếp) | -Xác định sự nhân lên của virut (chỉ số OD) bằng bộ sinh phẩm chẩn đoán Rotaclone (EIA) -Chuẩn độ hiệu giá virut Rota bằng phương pháp miễn dịch huỳnh quang -Thử nghiệm nhận dạng bằng RT- PCR - Xác định trình tự gen |
Tinh sạch dòng, chọn lọc dòng trên tế bào vero (2 lần liên tiếp) Chủng virut Rota gốc G1P[8](KH0118) | Xác định sự nhân lên của virut (chỉ số OD) bằng bộ sinh phẩm chẩn đoán Rotaclone (EIA) |
Các thử nghiệm kiểm tra chất lượng | |
Tạo chủng giống gốc (Virus Master Seed) G1P[8] MS | Kiểm định chất lượng theo hướng dẫn của Tổ chức Y tế thế giới TRS 941 2007 |
Tạo chủng sản xuất (Virus Working Seed) G1P[8] WS | Kiểm định chất lượng theo hướng dẫn của Tổ chức Y tế thế giới TRS 941 2007 |
Nuôi cấy tế bào Vero | Kiểm tra chất lượng tế bào |
Gây nhiễm virut | Kiểm định chất lượng theo hướng dẫn của Tổ chức y tế thế giới |
Hỗn dịch virut | Kiểm định chất lượng theo hướng dẫn của Tổ chức y tế thế giới |
Lọc vô trùng | Kiểm định chất lượng theo hướng dẫn của Tổ chức y tế thế giới |
Vắc xin bán thành phẩm | Kiểm định chất lượng theo hướng dẫn của Tổ chức y tế thế giới |
Vắc xin thành phẩm | Kiểm định chất lượng theo hướng dẫn của Tổ chức y tế thế giới |
1.5. Các giai đoạn thử nghiệm lâm sàng [3]
Để phát triển một loại thuốc hay một loại vắc xin, bắt buộc phải trải qua các giai đoạn thử nghiệm kéo dài trong nhiều năm trong đó mỗi giai đoạn là một thử nghiệm lâm sàng hoàn toàn độc lập. Nếu loại thuốc/vắc xin được thử nghiệm thành công qua các giai đoạn 1, 2 và 3 thì sẽ được phê duyệt để sử dụng trong cộng đồng. Giai đoạn 4 là những nghiên cứu tiếp theo sau khi vắc xin đã được phê duyệt. Tuy nhiên, để được phép thử nghiệm lâm sàng một loại thuốc hoặc vắc xin qua 4 giai đoạn trên, các sản phẩm này phải được được trải nghiệm qua các nghiên cứu tiền lâm sàng và giai đoạn 0.
Khảo sát một loại thuốc mới | Nghiên cứu lâm sàng trên người Giai đoạn 1 Giai đoạn 2 Giai đoạn 3 | FDA xem xét Hồ sơ thuốc mới | Giám sát hậu mãi qui mô lớn Giai đoạn 4 | |
2 – 5 năm | 5 năm | 2 năm |
Hình 1.5. Tóm tắt qui trình phát triển một loại thuốc mới
1.5.1. Giai đoạn tiền lâm sàng
Các nghiên cứu tiền lâm sàng là những thực nghiệm trong phòng thí nghiệm (in vitro) và trên cơ thể động vật (in vivo) sử dụng các liều khác nhau để thu thập các thông tin ban đầu về hiệu lực, độc tính và các tác động hoá dược đối với cơ thể sống. Khi có một hợp chất được định hướng là ứng cử viên hàng đầu, cần tiến hành các nghiên cứu tiền lâm sàng thu thập đầy đủ các thông tin cần thiết để có thể tiến hành nghiên cứu trên người. Nghiên cứu tiền lâm sàng là phần nghiên cứu bắt buộc trước khi tiến hành các thử nghiệm lâm sàng. Các thành tố của nghiên cứu tiền lâm sàng bao gồm (i) phần nghiên cứu in vitro nuôi cấy tế bào và các mô phân lập để xác định phân tử đích và cơ chế hoạt động, và (ii) phần nghiên cứu in vivo để xác định hiệu lực và độc tính của dược phẩm. Ngoài việc phải đảm bảo tuân thủ Thực hành Phòng thí nghiệm Tốt (GLP) các nghiên cứu tiền lâm sàng cần cân nhắc một số yếu tố như (1) các tác động về sinh học và dược động học, (2) lựa chọn các loài động vật thích hợp, (3) số lượng và giới tính động vật thí nghiệm, (3) chọn liều và đường dùng, (4) tính sinh miễn dịch.
Các tác động về sinh học/ dược động học
Các tác động về sinh học/ dược động học có thể được lượng giá sử dụng các phân tích trong phòng thí nghiệm. Sử dụng các dòng tế bào hoặc nuôi cấy tế bào nguyên thuỷ để khảo sát hiệu lực trực tiếp lên kiểu hình và sự nhân lên của tế bào. Do đặc tính với từng loài của từng loại dược phẩm có nguồn gốc từ công nghệ sinh học, điều quan trọng là phải lựa chọn 4 loài động vật thích hợp để thử nghiệm độc tính. Những dòng tế bào sử dụng trong thử nghiệm in vitro có nguồn gốc từ tế bào của động vật có vú có thể được sử dụng để tiên lượng cơ chế hoạt động trong thử nghiệm in vivo và đánh giá độ nhạy của các loài khác nhau kể cả cơ thể người đối với sinh phẩm. Những nghiên cứu này còn có thể xác định quá trình chiếm hữu cơ quan cảm thụ, ái tính với cơ quan cảm thụ, tác dụng dược lý và hỗ trợ cho quá trình lựa chọn các loài động vật thích hợp cho các thử nghiệm về dược lý học và độc tính trên động vật (in vivo). Kết quả tổng hợp giữa nghiên cứu trong ống nghiệm và trên động vật sẽ giúp cho việc định hướng các kết quả trên



![Các Vấn Đề Cần Lưu Ý Trong Thử Nghiệm Vắc Xin Trên Người [3,24]](https://tailieuthamkhao.com/uploads/2022/11/11/danh-gia-tinh-an-toan-va-tinh-sinh-mien-dich-cua-vac-xin-rotavin-m1-do-viet-nam-6-120x90.jpg)

