Trong luận án này chúng tôi tiến hành khảo sát sự tương tác của các ion kim loại với 3 thuốc thử azocalixaren. Các hợp chất này được tổng hợp, nghiên cứu cấu trúc, thành phần và công bố bởi các nhóm nghiên cứu thuộc Khoa Hóa học, Đại học Quốc gia Seoul- Hàn Quốc [86]. Nhóm nghiên cứu này cũng đã nghiên cứu khả năng tương tác của TEAC với các ion kim loại trong dung môi khan (dung môi MeCN). Kết quả nghiên cứu cho thấy hợp chất này tạo được phức màu với một số ion kim loại chuyển tiếp như Cr(III), Fe(II), Ni(II) và Pb(II). Các phức chất tạo ra có dịch chuyển max khá lớn từ 355nm đến 480-500nm. Nhóm nghiên cứu cũng đã đề xuất cơ chế tạo phức, theo đó ion kim loại sẽ bị bẫy vào vùng không gian trung tâm của phân tử và tạo liên kết với các nhóm azo và nhóm este để hình thành các phức vòng bền.
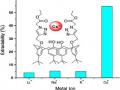
Ở công trình tiếp theo vào năm 2008 [87], nhóm tác giả này đã nghiên cứu khả năng tương tác của dẫn xuất azocalixaren (23) với các ion kim loại. Theo đó, hợp chất này có khả năng tương tác với các ion kim loại nhóm IIA, chuyển tiếp…Dựa vào màu sắc của phức, họ đã đề xuất quy trình phân tích nhóm ion kim loại (hình 1.20).
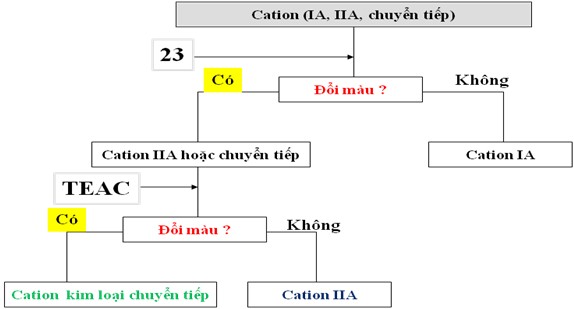
Hình 1.20. Sơ đồ phân tích định tính nhóm ion kim loại.
Như vậy, các nghiên cứu về MEAC, DEAC và TEAC chỉ mới là những tín hiệu ban đầu trong dung môi khan và chỉ dừng lại ở việc phân tích nhóm cation chứ chưa nghiên cứu phân tích định lượng ion đơn lẻ. Do đó, trong luận án này chúng tôi tiếp tục nghiên cứu tín hiệu tương tác của 3 thuốc thử này với các ion kim loại trong một số dung môi khác khi có mặt của nước để thuận lợi trong việc xây dựng quy trình phân tích các mẫu thực (các thông tin về MEAC, DEAC và TEAC được trình bày ở phần phụ lục).
1.4. Vài nét về hóa học siêu phân tử và phức Host-Guest
Có thể bạn quan tâm!
-
 Nghiên cứu khả năng tạo phức của một số dẫn xuất mới của azocalixaren với ion kim loại và ứng dụng trong phân tích - 1
Nghiên cứu khả năng tạo phức của một số dẫn xuất mới của azocalixaren với ion kim loại và ứng dụng trong phân tích - 1 -
 Nghiên cứu khả năng tạo phức của một số dẫn xuất mới của azocalixaren với ion kim loại và ứng dụng trong phân tích - 2
Nghiên cứu khả năng tạo phức của một số dẫn xuất mới của azocalixaren với ion kim loại và ứng dụng trong phân tích - 2 -
 Phức Hai Nhân Của Azocalixaren (22) Với Ion Kim Loại.
Phức Hai Nhân Của Azocalixaren (22) Với Ion Kim Loại. -
 Một Số Thuốc Thử Hữu Cơ Dùng Để Xác Định Chì
Một Số Thuốc Thử Hữu Cơ Dùng Để Xác Định Chì -
 Phân Tích Định Lượng Ion Kim Loại Theo Phương Pháp Đường Chuẩn
Phân Tích Định Lượng Ion Kim Loại Theo Phương Pháp Đường Chuẩn -
 Khảo Sát Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại
Khảo Sát Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại
Xem toàn bộ 130 trang tài liệu này.
1.4.1. Hóa học siêu phân tử
Năm 1894, Emil Fischer đề xuất nguyên lý ổ khóa và chìa khóa “Lock and Key” cho cơ chế ghi nhận và tương tác của enzyme với chất nền. Nguyên lý này đã giúp các nhà khoa học khai sinh ra một ngành hóa học mới là Supramolecular Chemistry (hóa học siêu phân tử). Thuật ngữ Supramolecular Chemistry nghĩa là hóa học ở ngoài mức độ phân tử (chemistry beyond the molecule) dùng để chỉ hai hay nhiều phân tử mà giữa chúng có tương tác bằng những liên kết liên phân tử yếu dẫn đến kết hợp giữa chúng để tạo nên những tổ hợp phân tử thường có kích thước lớn hơn. Trong quá trình phát triển, hợp chất siêu phân tử được chia làm 3 loại chính sau đây: Crown ete, Cyclodextrin và Calixaren. Hóa học siêu phân tử đã được vinh danh vào năm 1987 với giải thưởng Nobel của Pedersen và cộng sự về nghiên cứu phức của ete vòng với các ion kim loại [65].
1.4.2. Phức Host-Guest (H-G)
Khi có sự kết hợp xảy ra giữa hai phân tử khác nhau về độ lớn, thông thường phần tử có kích thước lớn hơn sẽ chứa đựng phân tử nhỏ hơn. Phân tử có kích thước lớn được gọi là chủ thể (host) và phần tử nhỏ hơn được gọi là khách thể (guest). Hợp chất mới có kích thước và khối lượng phân tử lớn hơn được hình thành do sự kết hợp giữa host và guest được gọi phức chất Host-Guest. Hiện nay có rất nhiều loại host khác nhau như crown ete, cyclodextrin, calixaren, cyclophan. Trong khi
đó, guest thường là những phân tử dung môi, ion, fulleren, phân tử hữu cơ như amino axit [29,44].
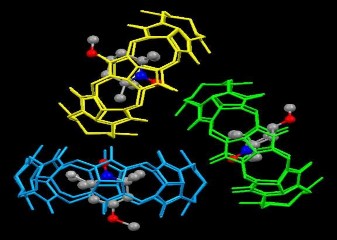
Hình 1.21. Phức chất H-G giữa Cuccurbituril với Trinitroxide supraradical.
1.4.3. Điều kiện để hình thành phức Host-Guest
Để hình thành phức chất H-G, các phân tử chủ (host) phải thỏa mãn các điều kiện như phân tử phải có các khoảng trống bên trong phân tử. Khoảng trống này phải có kích thước đủ lớn để chứa được phân tử khách (guest) hoặc cấu trúc của nó có thể linh động chuyển đổi để có thể bẫy được guest. Ngoài ra, host phải chứa các nhóm cho electron như nhóm –OH, -SH, -NH2…hoặc hệ thống liên kết có mật độ electron đủ lớn để hình thành tương tác với các phân tử khách.
Trong khi đó, kích thước của guest phải phù hợp với khoảng trống của host và có khả năng tạo thành liên kết với host sau khi bị bẫy vào khoảng trống (các liên kết hình thành có thể là ion, cộng hóa trị hoặc tương tác Van der Waals…).
Sự hình thành phức chất Host-Guest gồm các giai đoạn sau đây:
Trong điều kiện thuận lợi, phân tử “host” và tác nhân “guest” tiến lại gần nhau theo hướng có lợi nhất về mặt lập thể và năng lượng.
Giai đoạn tiếp theo phân tử “host” sẽ bẫy tác nhân “guest” vào trong khoảng không gian của nó.
Hình thành liên kết giữa phân tử “host” và “guest” thông qua các dạng liên kết như phối trí, ion hoặc tương tác tĩnh điện.
Độ bền của phức Host-Guest được đánh giá thông qua hằng số tạo phức. Dựa vào tín hiệu từ các phổ như hồng ngoại, tử ngoại, NMR, ESR, hoặc đo điện thế, người ta sử dụng một số phương pháp gần đúng như Benesi-Hildebrand, phương pháp hàm phi tuyến tính để xác định hằng số bền.
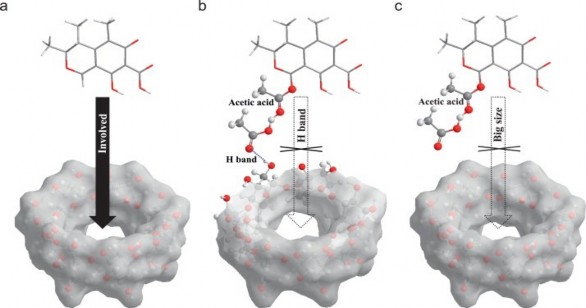
Hình 1.22. Một sơ đồ tạo phức Host-Guest.
Kết luận: Hóa học siêu phân tử và phức chất Host-Guest ngày càng đuợc quan tâm bởi nhiều ngành khác nhau như hóa học, sinh học, vật lý, khoa học vật liệu, nghiên cứu và mô hình hóa bằng máy tính. Những ứng dụng quan trọng của phức Host-Guest như vận chuyển ion qua những màng kị nước, sản xuất thiết bị quang học, xúc tác cho phản ứng, chế tạo đầu dò điện cực, điều chế màng bắt chất thải phóng xạ từ nhà máy điện hạt nhân, tách chiết chọn lọc một hay nhiều chất từ một hỗn hợp thông qua sự tạo phức…Ngoài ra, trong thời gian gần đây những nghiên cứu chính về hóa học siêu phân tử là tổng hợp những hợp chất có cấu trúc
tương tự ADN để áp dụng trong y học (bắt chọn lọc các khối u, đưa thuốc vào trong cơ thể…), tạo ra nhiều dạng vật liệu mới, các thiết bị quang học có khả năng khuếch xạ cao hơn.
1.5. Sơ lược về crom, chì, thori và khả năng tạo phức của chúng
1.5.1. Crom và hợp chất
Crom là một nguyên tố tương đối phổ biến trong thiên nhiên. Trong vỏ quả đất, crom chiếm khoảng 6.10-3% về khối lượng. Khoáng vật chính của crom là cromit (Fe(CrO2)2). Crom lần đầu tiên được điều chế bởi Louis Vauquelin vào năm 1797, tên gọi crom (chrome) nghĩa là màu sắc vì các hợp chất của crom đều có màu. Crom là kim loại có độ cứng, độ dẫn điện, dẫn nhiệt cao. Do đó, trong công nghiệp crom có nhiều ứng dụng, đặc biệt là trong công nghiệp luyện kim. Người ta tạo được nhiều loại thép có độ cứng cao như thép dụng cụ, thép không rỉ. Crom nguồn gốc tự nhiên là sự hợp thành của 3 đồng vị ổn định; Cr52, Cr53 và Cr54 với Cr52 là phổ biến nhất (83,789%). Các nhà khoa học đã xác định được 19 đồng vị phóng xạ của crom trong đó ổn định nhất là Cr50 có chu kỳ bán rã trên 1,8.1017 năm, và Cr51 với chu kỳ bán rã 27,7 ngày. Tất cả các đồng vị phóng xạ còn lại có chu kỳ bán rã nhỏ hơn 1 ngày và phần lớn là ít hơn 1 phút. Crom có điện tích hạt nhân là 24, với cấu hình là 3d54s1 nên crom tạo được nhiều hợp chất có số oxi hóa khác nhau nhưng bền nhất là số oxi hóa +3, số oxi +6 kém bền hơn. Ở điều kiện bình thường, crom rất bền với oxi không khí do có lớp Cr2O3 bền bảo vệ. Vì thế, người ta thường mạ crom lên các vật kim loại. Crom không tác dụng với nước nhưng tác dụng được với axit HCl và H2SO4 loãng. Tương tự như sắt và nhôm, crom bị thụ động trong HNO3 đặc, nguội và H2SO4 đặc nguội. Crom được điều chế bằng phản ứng nhiệt nhôm [6].
Các hợp chất của crom (II) như CrO, Cr(OH)2 có tính khử mạnh. Trong khi đó, hợp chất crom (III) vừa có tính khử, vừa có tính oxi hóa. Oxit và hydroxit của Cr(III) có tính lưỡng tính. Hợp chất có ứng dụng nhiều trong ngành nhuộm vải, thuộc da là K2SO4.Cr2(SO4)3.24H2O. Hợp chất crom (VI) có tính oxi hóa mạnh, chẳng hạn như CrO3 có tính oxi hóa rất mạnh, oxi hóa được một số chất vô cơ và
hữu cơ. Đây là một oxit axit, tác dụng với nước tạo thành hỗn hợp axit cromic H2CrO4 và axit đicromic H2Cr2O7. Hai axit này đều không bền, chỉ tồn tại trong dung dịch. Nếu tách khỏi dung dịch, chúng sẽ bị phân hủy trở lại tạo thành CrO3. Muối của crom (VI) có hai loại là cromat và đicromat. Muối cromat có màu vàng và đicromat có màu da cam là những hợp chất rất bền và độc [58,112].
1.5.2. Khả năng tạo phức của crom
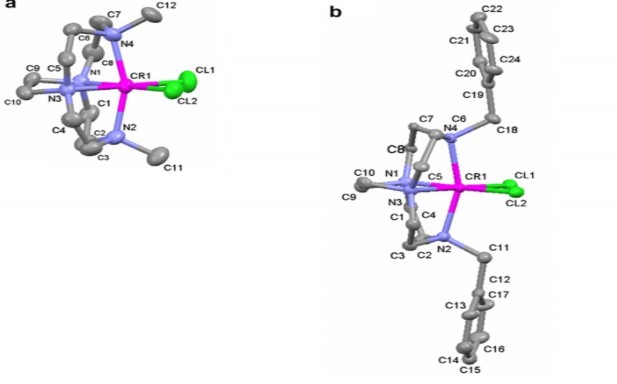
Khả năng tạo phức của crom rất phong phú mà đặc biệt là Cr(III). Ion này có thể tạo phức với các phối tử vô cơ như NH3, OH-, H2O [1]. Một số nghiên cứu về phức của Cr(III) với các thuốc thử hữu cơ như nghiên cứu của Ewais với thuốc thử DL-valin and L-arginin [59], của Maples [108], của Pestovsky [124] hoặc phối tử picolinat có khả năng tạo phức 1 nhân hoặc 2 nhân với ion Cr(III) qua nghiên cứu của Steams [147,148]. Trong phức chất, Cr(III) có số phối trí là 6 và tạo ra phức bát diện.
Hình 1.23. Một số phức bát diện của Cr(III)
1.5.3. Một số phương pháp xác định crom
Hàm lượng crom trong mẫu được xác định bằng nhiều phương pháp khác nhau, như phân tích trắc quang, ET-AAS, ICP-MS, NAA [124,147,148].
1.5.4. Chì và hợp chất
Chì là kim loại tương đối phổ biến, có màu xám tro với sắc lam, nặng (d = 11,3 g/cm3), rất mềm, dễ rèn, dẻo. Trữ lượng của chì trong vỏ quả đất cỡ khoảng
10-4%. Chì thường gặp ở dạng hợp chất với lưu huỳnh, tạo thành sunfua PbS1+x (0 < x < 0,5) gọi là galen, có trong thành phần của các quặng sulfua đa kim loại. Chì được dùng bọc dây cáp, chống tia phóng xạ và tia rơnghen, chế tạo anốt khi điện phân muối sunfat. Hàm lượng chì trong nước thiên nhiên rất nhỏ, nằm trong khoảng 0,001 – 0,023 mg/L. Trong nước thải của các nhà máy hóa chất và các khu luyện kim có chứa lượng chì đáng kể. Nước thải có thể chứa chì ở dạng ion tan (ion đơn hoặc ion phức) hoặc dưới dạng muối khó tan như: sunfat, cacbonat và sunfua [6].
Trong đất và đá tự nhiên, chì là một nguyên tố vi lượng (< 0,1% khối lượng vỏ trái đất). Hàm lượng trung bình của chì trong đá vỏ cứng khoảng 16 µg/g, trong anđêsít là 8,3 µg/g, và trong granit là 22,7 µg/g. Như vậy, hàm lượng chì tăng cùng hàm lượng silicat trong đá. Trong đá trầm tích (diệp thạch và đá sét kết ), hàm lượng trung bình của chì là 23µg/g; trong sa thạch (chiếm 15% đá trầm tích) là 10 µg/g; Trong dolomit và đá vôi (chiếm 5% đá trầm tích) là 7 µg/g. Hàm lượng chì trong đất khoảng 1040 µg/g.
Quá trình sản xuất, tái chế và sử dụng các dạng sản phẩm chứa chì là một trong những yếu tố đưa chì vào môi trường. Những hợp chất của chì có khuynh hướng tích lũy trong đất và trầm tích, từ đó xâm nhập vào thực vật làm ô nhiễm chuỗi thức ăn cho động vật và con người. Việc tiếp xúc đối với chì ở con người có thể là kết quả trong một phạm vi rộng lớn của các ảnh hưởng sinh học dựa trên mức độ và giai đoạn tiếp xúc. Các ảnh hưởng khác nhau xuất hiện trong một phạm vi rộng lớn của các liều lượng, với việc phát triển của bào thai và trẻ sơ sinh thì chì nhạy cảm hơn đối với người trưởng thành. Tiếp xúc ở mức độ cao với chì có thể
dẫn đến những ảnh hưởng sinh học độc hại đối với cơ thể con người như gây ra các vấn đề trong tổng hợp hemoglobin, ảnh hưởng tới thận, đường tiêu hóa, hệ sinh dục và ảnh hưởng cấp tính hay mãn tính tới hệ thống thần kinh. Ở mức độ trung bình, chì có những tác động ảnh hưởng thể hiện qua những biểu hiện lâm sàng, như phát triển tâm lý, trí tuệ của trẻ em [39,69].
1.5.5. Khả năng tạo phức của chì
Khả năng tạo phức của chì cũng được rất nhiều nhà khoa học nghiên cứu. Trong dung dịch, ion Pb2+ có khả năng tạo phức với các thuốc thử như 1,2- Diamincyclohexan-N,N,N’,N’-tetra acetic acid [89]; dithizon, dietyldithiocarbamat, 4-(2-pyridilazo) resorcinol, diphenyl-carbazon, arsenazo-III; 2-(2-thiazolylazo)-p- cresol, 1-(2-thiazoylazo-)2-naphthol, arsenazo-TB, xylenol da cam, porphyrin [155]. Trong phức chất, chì thường có các số phối trí 4, 5,6,7,8.
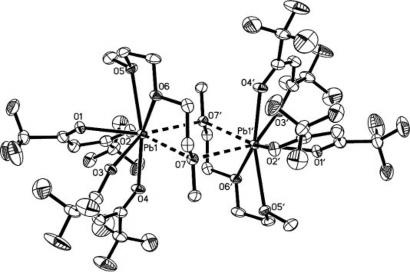
Hình 1.24. Cấu trúc một dạng phức của chì.
1.5.6. Một số phương pháp xác định hàm lượng chì
Trong dung dịch, ion Pb2+ tạo phức với một số thuốc thử hữu cơ tạo nên tổ hợp mang màu. Vì thế, người ta thường xác định hàm lượng chì bằng phương pháp trắc quang. Chẳng hạn, Fang cho biết hàm lượng chì được xác định bằng thuốc thử dibromo-p-metylcarboxysunfuazo [62]. Nagalakshmi và cộng sự dùng thuốc thử 3,5-