trưởng. Tuy nhiên, ở nồng độ 300 ppm, chỉ có ba chủng DQ41, FO2 và DD4 có khả năng sinh trưởng tốt.
(iv) Khả năng sinh trưởng của 10 chủng VKTQH trên naphthalene
Naphthalene là hợp chất PAH có độ tan khá cao trong nước nên sự có mặt của naphthalene trong nước gây độc rất lớn cho quần thể sinh vật. Cũng như các PAH khác, naphthalene khó bị phân hủy trong tự nhiên. Để đánh giá khả năng sinh trưởng và phát triển của các chủng VKTQH với nguồn carbon là naphthalene, 10 chủng VKTQH đã được nuôi cấy trong môi trường khoáng có bổ sung naphthalene làm nguồn carbon và năng lượng duy nhất với nồng độ cơ chất ban đầu là 100, 150, 200 và 250 ppm. Sau 7 ngày nuôi, kết quả được thể hiện trong Hình 3.11 và 3.12.
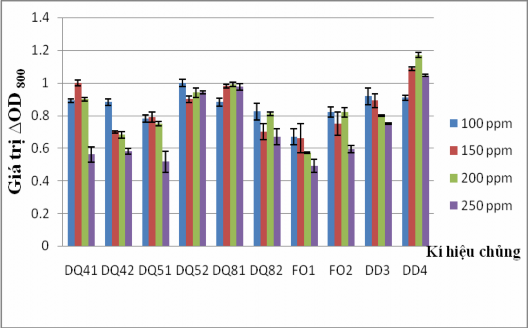
Hình 3.11. Khả năng sinh trưởng của 10 chủng VKTQH ở các nồng độ naphthalene khác nhau sau 7 ngày nuôi cấy

Hình 3.12. Dịch nuôi cấy của 10 chủng VKTQH ở 200 ppm naphthalene sau 7 ngày Dựa vào màu sắc dịch huyền phù (Hình 3.11) và độ hấp phụ quang học ở
bước sóng 800 nm (Hình 3.12), chúng tôi nhận thấy các chủng đều có khả năng sinh
trưởng tốt ở nồng độ naphthalene từ 100 ppm đến 200 ppm. Tuy nhiên, với nồng độ 250 ppm, chỉ có 3 chủng DQ52, DQ81 và DD4 là có khả năng sinh trưởng tốt trong đó chủng DD4 có khả năng sinh trưởng và phát triển mạnh nhất mật độ tế bào trung bình > 1 chủng DQ52 và DQ81 sinh trưởng tốt, chủng FO1 sinh trưởng kém nhất.
(v) Khả năng sinh trưởng của 10 chủng VKTQH trên pyrene
Pyrene có cấu tạo 4 vòng thơm, ít tan trong nước, tan tốt trong dung môi hữu cơ. Pyrene là hợp chất khó phân hủy nhất trong số 4 loại hydrocarbon thơm mà chúng tôi đã lựa chọn sử dụng trong nghiên cứu. Do đó, 10 chủng VKTQH đã được đánh giá khả năng sinh trưởng và phát triển trên nguồn carbon là pyrene với nồng độ ban đầu là 100, 150, 200 và 250 ppm. Kết quả sau 7 ngày nuôi cấy được thể hiện ở Hình 3.13 và 3.14.
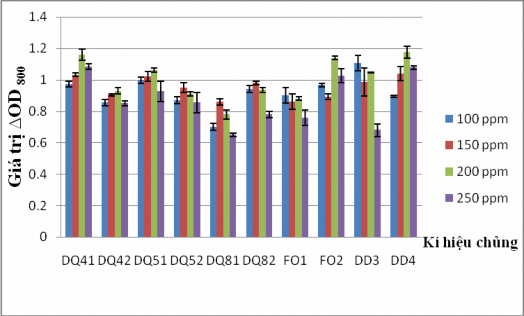
Hình 3.13. Khả năng sinh trưởng của 10 chủng VKTQH sau 7 ngày nuôi cấy ở các nồng độ pyrene khác nhau

Hình 3.14. Dịch nuôi cấy của 10 chủng VKTQH ở 200 ppm pyrene sau 7 ngày
Dựa vào độ hấp phụ quang học ở bước sóng 800 nm (Hình 3.13) và màu sắc dịch huyền phù (Hình 3.14), chúng tôi nhận thấy trong 10 chủng vi khuẩn thì có 9 chủng phát triển tốt, trong đó có 3 chủng DQ41, FO2 và DD4 có khả năng sinh trưởng và phát triển mạnh nhất mật, ∆OD800 > 1.
Như vậy, các thí nghiệm đánh giá khả năng sử dụng dầu diesel, naphthalene, phenol, pyrene và toluene của 10 chủng VKTQH được tổng hợp ở Bảng 3.3.
Bảng 3.3. Khả năng sinh trưởng trên các nguồn cơ chất hydrocarbon của các
chủng VKTQH
Nồng độ | Chủng VKTQH có khả năng sinh trưởng tốt | |
Toluene | 200 ppm | DQ41, DD4, DQ52 và FO2 |
250 ppm | DQ41, DD4 và FO2 | |
Phenol | 150 ppm | DQ41, FO1, FO2, DD3 và DD4 |
300 ppm | DQ41, FO2 và DD4 | |
Naphthalene | 200 ppm | DQ41, DQ52, DQ81 và DD4 |
250 ppm | DQ52, DQ81 và DD4 | |
Pyrene | 200 ppm | DQ41, DQ51, FO2, DD3 và DD4 |
250 ppm | DQ41, FO2 và DD4 | |
Dầu diesel | 4-8% | DQ41, DD4, FO2 |
Có thể bạn quan tâm!
-
 Sơ Đồ Các Bước Thí Nghiệm Thực Hiện Trong Luận Án
Sơ Đồ Các Bước Thí Nghiệm Thực Hiện Trong Luận Án -
 Phương Pháp Nghiên Cứu Hệ Sắc Tố Của Vi Khuẩn Tía Quang Hợp
Phương Pháp Nghiên Cứu Hệ Sắc Tố Của Vi Khuẩn Tía Quang Hợp -
 Kết Quả Phân Lập Các Khuẩn Lạc Vktqh Từ Nguồn Mẫu Nước Bị Ô Nhiễm Dầu Mỏ Ở Các Vùng Biển Việt Nam
Kết Quả Phân Lập Các Khuẩn Lạc Vktqh Từ Nguồn Mẫu Nước Bị Ô Nhiễm Dầu Mỏ Ở Các Vùng Biển Việt Nam -
 Ảnh Hưởng Của Một Số Điều Kiện Môi Trường Đến Sự Hình Thành Màng Sinh Học Của 3 Chủng Vktqh
Ảnh Hưởng Của Một Số Điều Kiện Môi Trường Đến Sự Hình Thành Màng Sinh Học Của 3 Chủng Vktqh -
 Thí Nghiệm Đánh Giá Sự Đối Kháng Lẫn Nhau Của Các Chủng Vktqh Lựa Chọn. (1)- Dq41; (2)- Dd4; (3),- Fo2
Thí Nghiệm Đánh Giá Sự Đối Kháng Lẫn Nhau Của Các Chủng Vktqh Lựa Chọn. (1)- Dq41; (2)- Dd4; (3),- Fo2 -
 Hiệu Suất Phân Huỷ Pah Bởi Các Loại Màng Sinh Học Khác Nhau
Hiệu Suất Phân Huỷ Pah Bởi Các Loại Màng Sinh Học Khác Nhau
Xem toàn bộ 144 trang tài liệu này.
Chú thích: sinh trưởng tốt ∆OD800>1, các tên in đậm là các chủng được lựa chọn.
Ba chủng DQ41, DD4, FO2 được lựa chọn là các chủng VKTQH đồng thời sở hữu hai đặc tính quý là tạo màng sinh học và khả năng sử dụng các hydrocarbon dầu mỏ.
3.2. Các đặc điểm sinh học và định danh ba chủng DQ41, DD4 và FO2
3.2.1. Các đặc điểm hình thái
Để xác định đặc điểm hình thái, ba chủng DQ41, DD4, FO2 được nuôi cấy trong môi trường DSMZ 27 bổ sung 2% thạch, ở điều kiện kỵ khí – sáng, cường độ chiếu sáng khoảng 5.000 lux, nhiệt độ 30±2 oC. Quan sát hình thái tế bào dưới kính hiển vi điện tử được tiến hành khi chúng đang ở giữa pha sinh trưởng (pha log). Sau
5 ngày nuôi cấy, chúng tôi tiến hành quan sát hình dạng, kích thước của khuẩn lạc trên kính hiển vi quang học, nhuộm Gram và quan sát hình thái tế bào dưới kính hiển vi điện tử quét (Hình 3.15).
Kết quả nhuộm Gram cho thấy cả ba chủng VKTQH đều là VK Gram (-).
B | |
C | D |
E | F |
Hình 3.15. Hình dạng khuẩn lạc và hình dạng tế bào dưới kính hiển vi điện tử của chủng DD4, DQ41, FO2
Hình thái chủng DD4: Các khuẩn lạc của chủng DD4 có hình tròn, nhỏ li ti, có màu đỏ nhạt (Hình 3.15A). Tế bào của chúng có dạng hình que, xoắn, bề mặt nhăn, đơn bào, kích thước khoảng 700 x 2210 nm (Hình 3.15B).
Hình thái chủng DQ41: Các khuẩn lạc của chủng DQ41 cũng có hình tròn, lồi, bóng, không nhân, có rìa trong, màu đỏ đậm, đường kính 1 - 1.5 mm (Hình 3.15C). Tế bào của chúng có dạng hình que, bề mặt nhăn, đơn bào, kích thước khoảng 540 x 1320 nm (Hình 3.15D).
Hình thái chủng FO2: Các khuẩn lạc của chủng FO2 có hình tròn, nhẵn, nhỏ và màu đỏ nhạt và được bao phủ bởi một viền mờ đục, đường kính nhỏ hơn 0.5 mm (Hình 3.15E). Tế bào của chúng có dạng hình que, bề mặt hơi nhăn, đơn bào, kích thước khoảng 515 x 1160 nm (Hình 3.15F).
Quan sát dưới kính hiển vi điện tử cho thấy tất cả các chủng này đều có dạng hình gậy, với kích thước 500 ×1100 ÷ 700 ×2200 nm. Đáng chú ý, chủng FO2 có phương thức sinh sản là nảy chồi (Hình 3.15F).
3.2.2. Trình tự 16S rRNA và định danh ba chủng DQ41, DD4 và FO2
Để định danh các chủng VKTQH phân lập được, trình tự vùng gen mã hóa 16S rRNA được đọc và so sánh với ngân hàng dữ liệu [125].
Trình tự gần đủ của các đoạn gen 16S rRNA của 3 chủng FO2, DQ41, DD4 ῀1500 bp đã được xác định và so sánh với trình tự 16S rDNA trên cơ sở dữ liệu trên GenBank và xây dựng cây phát sinh chủng loại (Hình 3.16).
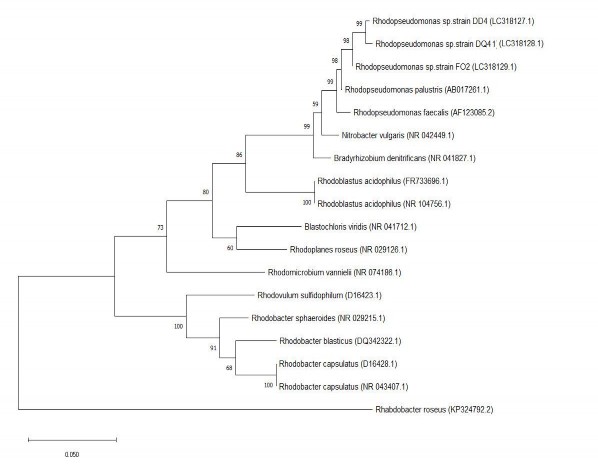
Hình 3.16. Cây phát sinh chủng loại của 3 chủng DD4, DQ41, FO2
Cả ba chủng VKTQH DD4, DQ41và FO2 đều có trình tự gen mã hóa 16S rRNA có mức độ tương đồng cao nhất đối với R. palustris (> 99%) và mức độ tương đồng này thấp hơn so với R. faecalis (> 98%).
Dựa trên các đặc điểm hình thái và trình tự của gen mã hóa 16S rRNA, ba chủng được chọn được đặt tên là Rhodopseudomonas sp. DD4, Rhodopseudomonas sp. DQ41 và Rhodopseudomonas sp. FO2. Trình tự gen 16S rRNA của 3 chủng FO2, DQ41, DD4 đã được đăng ký trong GenBank với mã số tương ứng là LC318127, LC318128 và LC318129.
Liên quan đến phân hủy hydrocarbon trong điều kiện kỵ khí, một loài thuộc chi Rhodopseudomonas đã được phân lập từ vùng bị ô nhiễm. Chủng R. palustris RP2 đã được phân lập từ lớp màng sinh học tạo ra từ các VSV phân hủy hydrocarbon, có khả năng khử được các oxit kim loại, khử nitrate trong điều kiện kỵ khí, đặc biệt có khả năng phân hủy được thành phần n-alkane của hydrocarbon dầu mỏ trong điều kiện kỵ khí [137]. Trước đó, ba chủng VKTQH thuộc chi Rhodopseudomonas có độ tương đồng về trình tự 16S rDNA với loài R. palustris từ 97 đến 99% được phân lập được từ mẫu nước và bùn thải công nghiệp thể hiện khả năng sử dụng benzoate và 4-hydroxybenzoate là nguồn carbon duy nhất cho sinh trưởng trong điều kiện quang dưỡng [79].
3.2.3. Các đặc điểm sinh học
3.2.3.1. Đặc điểm sắc tố quang hợp
Sự khác biệt giữa các loại bacteriochlorophyll (Bchl) dẫn đến sự khác nhau về cực đại của quang phổ hấp thụ trong vùng ánh sáng đỏ là đặc trưng cơ bản để phân biệt VKTQH với các vi sinh vật quang dưỡng khác [2].
Ba chủng VKTQH DQ41, DD4, FO2 được nuôi cấy kỵ khí, có ánh sáng trong môi trường DSMZ 27 lỏng. Sau 4 ngày nuôi cấy, cả 3 chủng đều đạt tới giữa pha sinh trưởng (pha log). Dịch huyền phù tế bào được lấy ra để đo phổ hấp thụ trên máy quang phổ. Kết quả được trình bày ở Hình 3.17.
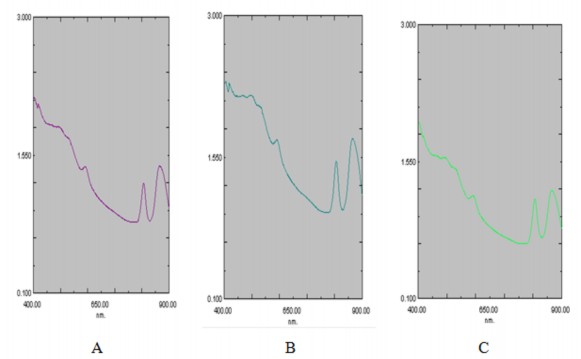
Hình 3.17. Phổ hấp phụ dịch huyền phù tế bào của 3 chủng DD4 (A), DQ41 (B), FO2 (C)
Trong vùng phổ 700 - 900 nm, chủng DD4 có cực đại tại bước sóng 806 và 866 nm, chủng DQ41 có cực đại tại bước sóng 804 và 865 nm và chủng FO2 có cực đại tại bước sóng 805 và 863 nm. Như vậy, chúng đều có các điểm cực đại ở vùng 800 - 890 nm đặc trưng cho bacteriochlorophyll a như mô tả trong nghiên cứu trước [16]. Kết quả này cho thấy cả 3 chủng nghiên cứu đều chứa Bchl a.
Ngoài Bchl, VKTQH còn chứa nhóm sắc tố khác là carotenoid. Carotenoid ở VKTQH cũng rất đa dạng, đặc trưng cho từng loài và cũng khác hẳn với nhóm sắc tố này ở tảo và thực vật bậc cao về cấu trúc. Chủng DD4 có các cực đại tại 591nm, chủng DQ41 có các cực đại tại 406, 445, 464, 492, 591nm, chủng FO2 có các cực đại tại 460, 491, 591 nm. Các cực đại hấp thụ này phù hợp với phổ hấp thụ của họ spirilloxanthin.
Với những đặc điểm cơ bản này, theo khóa phân loại của Bergey, ba chủng VKTQH DQ41, DD4 và FO2 khác với hai loài thuộc chi Rhodopseudomonas là R. viridis và R. sulfoviridis có chứa bacteriochlorophyll b và carotenoid chủ yếu là 1,2- dihydroneurosporene và 1,2-dihydrolycopene.
Theo nghiên cứu của Plennig và Trueper (1992), khả năng tổng hợp sắc tố ở tế bào VKTQH phụ thuộc rất nhiều vào điều kiện sinh trưởng. Các loài trong chi
Rhodopseudomonas có khả năng tổng hợp sắc tố khi sinh trưởng ở điều kiện hiếu khí, tối [16]. Để xác định khả năng tổng hợp sắc tố của 3 chủng lựa chọn, chúng tôi nuôi cấy chúng trên đĩa petri chứa môi trường DSMZ 27 có bổ sung 2% thạch và nuôi ở điều kiện kỵ khí, sáng và hiếu khí, tối. Kết quả xác định ảnh hưởng của oxy và ánh sáng đến khả năng tổng hợp sắc tố của các chủng lựa chọn cho thấy chúng đều sinh trưởng được trong điều kiện hiếu khí, tối nhưng khả năng tổng hợp sắc tố bị ức chế một phần, màu sắc khuẩn lạc trở nên hồng nhạt hoặc mất màu (Hình 3.18).

Hình 3.18. Khả năng tạo sắc tố quang hợp của VKTQH ở hai điều kiện
(A) kỵ khí, sáng và (B) hiếu khí, tối
Kết quả thu được khẳng định rằng ba chủng lựa chọn tổng hợp sắc tố quang hợp khi được chiếu sáng. Mặc dù chúng có thể sinh trưởng được trong điều kiện hiếu khí, tối nhưng khả năng tổng hợp sắc tố của chúng đều bị ức chế. Đây cũng là một trong những đặc điểm đặc trưng của chi Rhodopseudomonas.
3.2.3.2. Khả năng sử dụng một số nguồn carbon hữu cơ của ba chủng DQ41, DD4 và FO2
Để xác định khả năng sử dụng một số nguồn carbon cho sinh trưởng của ba chủng DQ41, DD4 và FO2, chúng đã được nuôi trong môi trường DSMZ 27 dịch thể, trong đó acetate lần lượt được thay thế bởi các nguồn carbon bao gồm formate, methanol, succinate, citrate, tartate, benzoate, glycerol và malate. Dịch sinh khối thu được sau 7 ngày nuôi cấy được đo bằng máy quang phổ kế với bước sóng 800 nm để theo dõi mật độ tế bào. Các kết quả thu được so sánh với một số loài Rhodopseudomonas (Bảng 3.4).






