hợp nhỏ lên bề mặt môi trường DSMZ 27 thạch và cấy gạt bằng que gạt vô trùng. Đặt các đĩa thạch trong điều kiện khí quyển nitơ (trong túi nilon, hút hết không khí và thay bằng khí nitơ), dưới ánh sáng đèn sợi đốt 60w, tiến hành đếm số khuẩn lạc sau 5 -7 ngày.
Số lượng khuẩn lạc (CFU) xuất hiện trên đĩa được đếm và tính theo công thức: CFU/ml = a ×(1/v)×n
Trong đó, n: là độ pha loãng mẫu;
A: là số khuẩn lạc đếm được trên bề mặt đĩa thạch;
V: là thể tích mẫu được cấy, 1/v thể tích mẫu qui về 1 ml.
Xác định mật độ tế bào VKTQH trên màng sinh học
Được tiến hành theo phương pháp của Allessandrello và cộng sự (2017) [133]. Màng sinh học trên sỏi nhẹ, xơ dừa và mút xốp (các giá thể được cắt thành các miếng nhỏ có kích thước nhất định (1 x 1 x 0,5 cm), đồng thời, các khối mút xốp có kích thước 5 mm) được rửa 2 lần với 5 ml NaCl 0,9% để loại bỏ tế bào phù du. Để tách tế bào, giá thể xơ dừa, sỏi nhẹ, mút xốp cho vào 5 ml dung dịch NaCl 0,9%, vortex trong 10 phút, sau đó pha loãng 10 lần. Hút 1 ml dịch pha loãng chang trên môi trường DSMS 27 thạch. Nuôi dưới ánh sáng 5000 lux, nhiệt độ 30±2oC, khí quyển nitơ. Sau 5 ngày khuẩn lạc của các chủng vi khuẩn tách riêng và được đếm tương tự như xác định mật độ tế bào VKTQH ở dạng tự do ở trên sẽ thu được mật độ tế bào trên màng sinh học. Logarit CFU/ml là giá trị mật độ tế bào mỗi chủng trên màng sinh học đa chủng, màng sinh học đơn chủng trên giá thể hoặc không gắn giá thể. Thí nghiệm này được lặp lại 3 lần.
2.2.1.9. Phương pháp nghiên cứu hệ sắc tố của vi khuẩn tía quang hợp
Phổ hấp thụ Bacteriochlorophyll ở trong tế bào nguyên được xác định theo phương pháp quang phổ ở vùng 400 – 900 nm trên máy quang phổ Novaspec II hoặc máy quang phổ UV – 1650PC.
2.2.1.10. Kiểm tra tính đối kháng của các chủng vi khuẩn tía quang hợp được lựa chọn
Tính đối kháng của các chủng VKTQH được thực hiện theo mô tả của Khan và cộng sự, 2019. Cấy vạch các chủng VKTQH lên môi trường thạch đĩa DSMZ 27
cho các vạch cấy cắt nhau từng cặp một. Sự đối kháng của 2 chủng VKTQH thể hiện qua dấu hiệu gián đoạn tại các vị trí giao nhau của 2 vạch cấy [134].
2.2.1.11. Đánh giá khả năng phân hủy hydrocarbon dầu mỏ bởi màng sinh học của VKTQH
Tiến hành nuôi tạo màng sinh học với thể tích 10 ml môi trường DSMZ 27 trong bình trụ. Sau 7 ngày nuôi cấy (trong điều kiện kị khí, sáng) màng sinh học được tạo thành. Tiếp theo đánh giá khả năng phân hủy hydrocarbon dầu mỏ như sau:
⁻ Dùng pipeman hút dịch nuôi cấy nhẹ nhàng để tránh làm vỡ màng.
⁻ Rửa màng 2 lần bằng nước cất vô trùng với lượng thể tích tương ứng.
⁻ Bổ sung vào các bình trụ tương ứng gồm: 10 ml môi trường DSMZ 27 bổ sung 1ml/l vitamin [127] và các nguồn hydrocarbon các hydrocarbon dầu mỏ như phenol/naphthalene/toluene/pyrene tại các nồng độ khác nhau.
⁻ Nuôi tĩnh trong điều kiện kị khí, sáng.
⁻ Ngày thứ 14, tiến hành xác định hàm lượng hydrocarbon dầu mỏ trong mẫu thí nghiệm tại nồng độ mà VKTQH sinh trưởng tốt nhất (so với mẫu đối chứng không có VKTQH) bằng phương pháp sắc ký lỏng cao áp (HPLC) theo phương pháp 2.2.3.
2.2.1.12. Xây dựng mô hình và đánh giá hiệu quả xử lý hydrocarbon dầu mỏ của màng sinh học đơn chủng và màng sinh học do hỗn hợp các chủng tạo thành
Xây dựng mô hình
- Chuẩn vật liệu sử dụng làm giá thể với các tiêu chí về kinh tế, tính sẵn có, thân thiện với môi trường (mút xốp, xơ dừa và sỏi nhẹ), dụng cụ phục vụ cho việc chế tạo mô hình bao gồm: 4 bể nhựa có kích thước (Dài x rộng x cao: 35x26x15 cm), máy khuấy trộn, giống đơn chủng/đa chủng VKTQH, hóa chất pha môi trường.
- Xử lý sơ bộ các loại giá thể được lựa chọn (Hình 2.3).
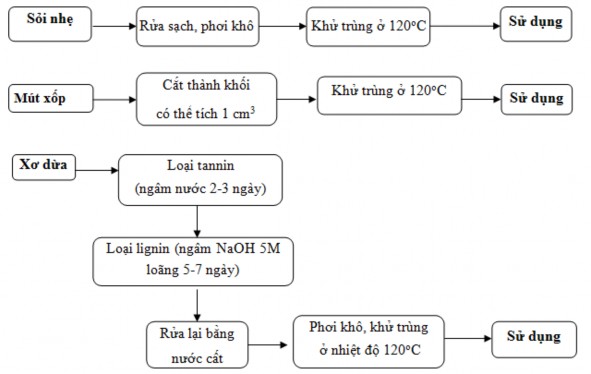
Hình 2.3. Sơ đồ xử lý sơ bộ các loại giá thể
- Cố định giá thể thành từng khối có diện tích bề mặt phù hợp với diện tích bề mặt bể sao cho tạo điều kiện thuận lợi nhất cho VKTQH có thể dễ dàng bám dính vào giá thể và tạo màng vi sinh.
- Bổ sung 90% môi trường DSMZ 27 và 10% đơn chủng/đa chủng VKTQH vào mô hình có sẵn giá thể và mô hình đối chứng không có giá thể đến khi thể tích đạt 5 lít. Đặt mô hình trong bể kính có đậy kín nắp hạn chế tiếp xúc với không khí (Hình 2.4).
BỂ CHỨA GIÁ THỂ SỎI NHẸ
BỂ CHỨA GIÁ THỂ MÚT XỐP
Máy khuấy trộn
BỂ CHỨA GIÁ THỂ XƠ DỪA
Hình 2.4. Chi tiết mô hình xử lý hydrocarbon dầu mỏ
- Đơn chủng/ đa chủng VKTQH bổ sung vào mô hình có giá thể: Lấy một lượng sinh khối giống nhau của các chủng DD4, DQ41 và FO2 cho vào trong 100ml môi trường DSMZ 27, hút 5 ml dịch huyền phù tế bào đo OD600, tiếp tục nuôi trong 72 giờ (ở nhiệt độ 30oC) để đạt được số tế bào VKTQH khoảng 2 × 109 CFU. Thực hiện theo cách tương tự đối với màng sinh học đơn chủng và đa chủng không gắn giá thể với số lượng tế bào ban đầu là khoảng 8 × 102 CFU mỗi chủng.
- Sau 7 ngày, tiến hành hút dịch lỏng trong bể mô hình, tránh tác động tới màng sinh học.
- Bổ sung môi trường DSMZ 27 không có acetate vào các bể vừa hút dịch lỏng đến thể tích 5 lít sau đó tiến hành bổ sung 500 ppm các loại hydrocarbon thơm (như toluene, phenol, naphthalene và pyrene), 17,2 g/l dầu diesel, 20 g/l dầu thô.
- Khởi động hệ thống khuấy đảo dịch môi trường (nhẹ nhàng) với mục đích làm cho các hydrocarbon thơm, dầu diesel, dầu thô được phân bố đều khắp giá thể làm tăng hiệu quả xử lý (giai đoạn 2 - Hình 2.5).
- Lượng cơ chất bao gồm các hydrocarbon thơm, dầu diesel, dầu thô đã bị hấp thụ bởi hỗn hợp chủng VKTQH, chỉ còn 1 lượng cơ chất rất nhỏ bám dính trên bề mặt giá thể (giai đoạn 3 - Hình 2.5).
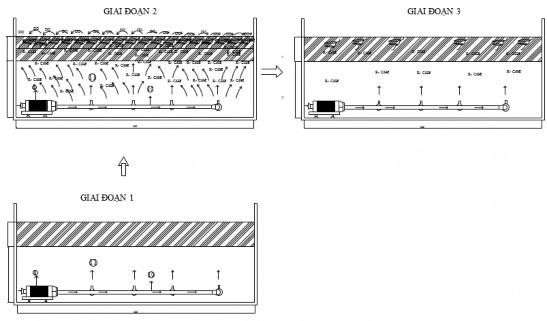
Hình 2.5. Các giai đoạn trong mô hình xử lý hydrocarbon dầu mỏ
2.2.2. Các phương pháp sinh học phân tử
2.2.2.1. Phương pháp tách chiết DNA tổng số của vi khuẩn tía quang hợp
Các bước tách chiết DNA tổng số được tiến hành theo mô tả trong nghiên cứu trước đây [125]. Cụ thể, 1 mL dịch nuôi cấy được ly tâm trong ống eppendorf để thu lấy phần sinh khối, sau đó rửa tế bào 2 lần bằng đệm natriphosphate (pH 8): bổ sung 300 μl NaPP, votex cho tan sinh khối và ly tâm ở 6500 v/ph trong 10 phút. Bỏ phần dịch nổi. Bổ sung 540 μl đệm tách (Tris-C1 1 M; EDTA 0,5 M; NaPP 1 M; NaCl; CTAB 1%), votex kỹ. Bổ sung 20 μl protease K (20 mg/ml), lắc ở 37oC trong 1 giờ đến 1 giờ 30 phút. Bổ sung 60 μl SDS 20%, ủ ở 65oC trong 2 giờ. Protein được loại bỏ bằng một thể tích CI (Chloroform:Isopropanol) 24:1 (v/v), đảo nhẹ và ly tâm 12000 v/ph trong 15 phút. DNA được tủa bằng một lần thể tích isopropanol ở nhiệt độ phòng trong 1 giờ. Ly tâm 12000 v/ph trong 15 phút ở 4oC, phần tủa là DNA genome được thu lại. Rửa tủa bằng 500 μl ethanol 70% (lạnh). Ly tâm 12.000 v/ph trong 10 phút ở 4oC, bỏ dịch. Tủa được làm khô bằng máy hút chân không. Tủa được hòa bằng nước deion khử trùng đã loại DNase với thể tích khoảng 25-30 μl.
2.2.2.2. Phương pháp PCR
Phương pháp PCR với cặp mồi đặc hiệu cho đoạn 16S rRNA [125]. Cụ thể, các thành phần tham gia phản ứng PCR (25 μl) bao gồm 12,5 μl MasterMix 2X, 1,0 μl mồi 27f 10 mM, 1,0 μl mồi 1527r 10 mM, 2,0 μl DNA khuôn và 8,5 μl nước deion đã loại DNase. Chu trình nhiệt để tiến hành phản ứng PCR nhân gen 16S rRNA: 95oC - 5 phút, 30 chu kỳ của (95oC - 50 giây, 58oC - 45 giây, 72oC - 1 phút 30 giây), 72oC - 8 phút, 4oC - ∞.
Trình tự nucleotide của sản phẩm PCR được xác định bằng hệ thống đọc trình tự DNA tự động ABI (Mỹ) và được phân tích bằng phần mềm tin sinh Bioedit, Clustal X và Mega4.
2.2.2.3. Phương pháp điện di DNA trên gel agarose
Điện di DNA trên gel agarose được tiến hành theo phương pháp của Sambrook và Russel (2001). Gel agarose 1% được chuẩn bị, mẫu DNA được trộn với 2 µl loading dye và tra vào các giếng nhỏ và tra chỉ thị phân tử DNA chuẩn để xác định kích thước phân tử của mẫu DNA trên bản gel. Chạy diện di với điện thế
100V trong 35 phút. Sau khi kết thúc quá trình điện di, đưa bản gel vào nhuộm trong Ethidium Bromide trong 5 phút, bản gel được rửa lại bằng nước và mang đi quan sát dưới ánh sáng tử ngoại 254 nm trên máy soi DNA và chụp ảnh [135].
2.2.3. Nhóm phương pháp phân tích hóa học
Các thành phần hydrocarbon thơm có trong dịch nuôi cấy vi khuẩn được đem đi phân tích hóa học bằng sắc ký lỏng cao áp (HPLC) Agilent 1100 (Mỹ) được trang bị detectơ chuỗi (DAD). Điều kiện đo: cột sắc ký Hypersil C 18 (200 × 4 mm), tỷ lệ pha động axetonitril/nước = 67/33 (theo thể tích); tốc độ dòng: 0,6ml/phút; áp suất: 280 bar; tín hiệu đo phenol: 271 nm; toluene: 261 nm; naphthalene: 280 nm; pyrene: 336 nm. Hàm lượng phenol, toluene, naphthalene, pyrene được xác định theo phương pháp ngoại chuẩn.
Các mẫu phân tích được gửi phân tích tại viện Công nghệ mới – Viện Khoa học và Công nghệ quân sự.
Hàm lượng dầu diesel được xác định bằng phương pháp phân tích khối lượng theo tiêu chuẩn TCVN 4582-88:100 ml được hòa tan trong 15 ml dung môi chloroform, lắc nhẹ (khoảng 10 phút) cho dầu tan hoàn toàn (quá trình chiết được tiến hành 3 lần). Khi đó dầu và dung môi sẽ tách làm 2 lớp, dùng phễu chiết bỏ phần dung môi ở dưới đi. Phần dịch hòa tan còn lại được cô bay hơi bằng bếp cách cát cho tới cạn và cân khối lượng ta sẽ được khối lượng của lượng dầu. Quá trình thực hiện phân tích lượng dầu diesel còn lại trong dịch lỏng được tiến hành tại Viện Hóa Công Nghiệp.
2.2.4. Xử lý thống kê
Các kết quả, số liệu nghiên cứu được xử lý bằng phương pháp thống kê sinh học. Dựa vào phần mềm Excel để tính giá trị trung bình, độ lệch chuẩn và vẽ đồ thị. Mỗi thí nghiệm được lặp lại 3 lần để tính trung bình mẫu. Mức khác biệt có ý nghĩa thống kê được đề nghị là p<0,05.
Địa điểm nghiên cứu: Phòng CNSH môi trường, Viện Công nghệ sinh học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam.
CHƯƠNG 3
KẾT QUẢ VÀ THẢO LUẬN
3.1. Kết quả phân lập và tuyển chọn các chủng VKTQH có khả năng tạo màng sinh học và phân hủy hydrocarbon dầu mỏ
3.1.1. Kết quả phân lập VKTQH từ các mẫu nước và bùn ô nhiễm dầu
Để phân lập các chủng VKTQH tiềm năng có khả năng phân huỷ hydrocarbon dầu mỏ, các mẫu nước và bùn đã được thu thập tại các vùng biển Việt Nam. Các mẫu được làm giàu trong môi trường DSMZ 27 có bổ sung dầu diesel hoặc naphthalene, pyrene và anthracene. Sau đó, các bình nuôi VK được giữ trong điều kiện kỵ khí, ánh sáng tương đương 5000 Lux, nhiệt độ 30±2oC (Hình 3.1).
Theo dõi sau 5 - 7 ngày, màu sắc của môi trường làm giàu chuyển đổi rõ rệt sang màu đỏ tía, trên thành bình cũng quan sát có xuất hiện của các vệt màu. Kết quả này cho thấy có sự biểu hiện của VKTQH, thể hiện ở sắc tố quang hợp đặc trưng. Như vậy, dịch huyền phù trên các bình làm giàu được thu lại để tiến hành thí nghiệm phân lập các chủng VKTQH.
Sau |
Có thể bạn quan tâm!
-
 Ứng Dụng Của Vi Khuẩn Tía Quang Hợp Để Phân Hủy Hydrocarbon Dầu Mỏ
Ứng Dụng Của Vi Khuẩn Tía Quang Hợp Để Phân Hủy Hydrocarbon Dầu Mỏ -
 Ứng Dụng Vi Khuẩn Tía Quang Hợp Để Phân Hủy Hydrocarbon Dầu Mỏ
Ứng Dụng Vi Khuẩn Tía Quang Hợp Để Phân Hủy Hydrocarbon Dầu Mỏ -
 Sơ Đồ Các Bước Thí Nghiệm Thực Hiện Trong Luận Án
Sơ Đồ Các Bước Thí Nghiệm Thực Hiện Trong Luận Án -
 Kết Quả Phân Lập Các Khuẩn Lạc Vktqh Từ Nguồn Mẫu Nước Bị Ô Nhiễm Dầu Mỏ Ở Các Vùng Biển Việt Nam
Kết Quả Phân Lập Các Khuẩn Lạc Vktqh Từ Nguồn Mẫu Nước Bị Ô Nhiễm Dầu Mỏ Ở Các Vùng Biển Việt Nam -
 Khả Năng Sinh Trưởng Của 10 Chủng Vktqh Ở Các Nồng Độ Naphthalene Khác Nhau Sau 7 Ngày Nuôi Cấy
Khả Năng Sinh Trưởng Của 10 Chủng Vktqh Ở Các Nồng Độ Naphthalene Khác Nhau Sau 7 Ngày Nuôi Cấy -
 Ảnh Hưởng Của Một Số Điều Kiện Môi Trường Đến Sự Hình Thành Màng Sinh Học Của 3 Chủng Vktqh
Ảnh Hưởng Của Một Số Điều Kiện Môi Trường Đến Sự Hình Thành Màng Sinh Học Của 3 Chủng Vktqh
Xem toàn bộ 144 trang tài liệu này.
Hình 3.1. Mẫu bùn ô nhiễm dầu trước và sau làm giàu
Tiếp theo, các dịch làm giàu đã pha loãng được cấy trên môi trường thạch DSMZ 27 có bổ sung hydrocarbon dầu mỏ (toluene/pyrene/naphthalene/dầu diesel/ phenol/anthracene), tổng số 15 khuẩn lạc VKTQH đã bước đầu được tách riêng, làm thuần trên các môi trường thạch (Hình 3.2, Bảng 3.1). Trong đó, Hình 3.2 minh họa sự phát triển khuẩn lạc của chủng VKTQH được làm giàu từ mẫu nước bị ô nhiễm dầu mỏ, trong khi Bảng 3.1 mô tả hình thái các khuẩn lạc VKTQH đã phân lập trong luận án này.
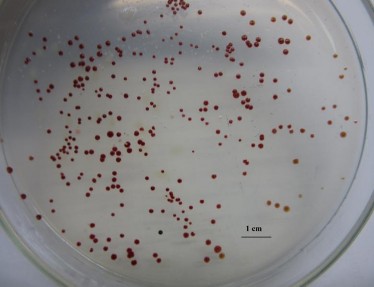
Hình 3.2. Một số khuẩn lạc VKTQH được phân lập từ mẫu làm giàu
Kết quả từ Bảng 3.1 cho thấy tại 15 khuẩn lạc VKTQH phân lập được tại vị trí ô nhiễm khác nhau có màu sắc, kích thước và hình dáng khuẩn lạc khác nhau và rất đa dạng. Màu sắc khuẩn lạc của chúng chủ yếu là từ đỏ nhạt đỏ tía đến đỏ đậm, từ nâu nhạt đến nâu đậm, vàng nhạt đến vàng đậm. Tại vùng biển Quảng Ngãi phân lập được nhiều chủng vi khuẩn nhất (8 chủng), vùng biển Vũng Tàu phân lập được ít chủng vi khuẩn nhất (2 chủng), Nha Trang - Khánh Hòa lập được 5 chủng (Cảng cầu đá 3 chủng và Làng chài 2 chủng). Trên nguồn cơ chất toluene phân lập được nhiều chủng nhất (4 chủng); tiếp theo trên pyrene phân lập được 3 chủng; trên napthalene, dầu diesel, phenol, anthracene mỗi nguồn cơ chất phân lập được 2 chủng. Toàn bộ 15 chủng VKTQH đã phân lập được tiếp tục được lưu giữ trong glycerol 20% ở điều kiện -20oC để phục vụ cho các thí nghiệm tiếp theo.






