không độc hại với môi trường. Tuy nhiên, sự tiêu thụ ion sắt và sự hình thành các sản phẩm trung gian trong quá trình điện phân khiến cho sự phân hủy chậm hơn ở giai đoạn thứ hai [19].
Kết quả xử lý 3 loại thuốc nhuộm azo: azobenzen, metyl da cam và metyl đỏ bằng hiệu ứng Fenton điện hóa của Elodie Guivarch và các cộng sự
[83] cho thấy rằng các hợp chất azo bị khoáng hóa bởi hiệu ứng Fenton điện hóa với sự suy giảm chỉ số COD trên 80%. Cơ chế của sự khoáng hóa được các tác giả dự đoán và trình bày điển hình với thuốc nhuộm azobenzen (Hình 1.5).
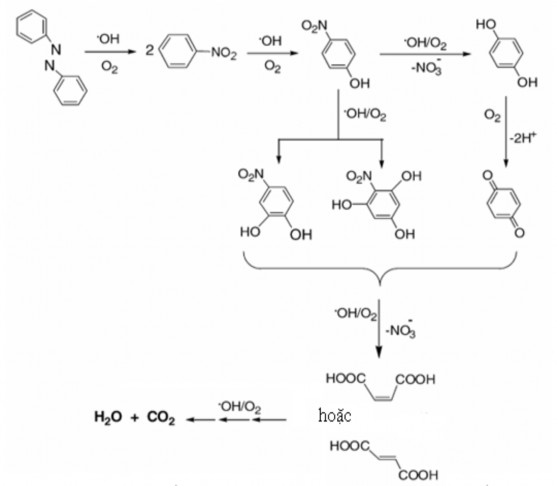
Hình 1.5. Dự đoán cơ chế của phản ứng khoáng hóa azobenzen bằng hiệu ứng Fenton điện hóa [83]
Phản ứng khoáng hóa các phẩm màu azo bằng hiệu ứng Fenton điện hóa được biểu diễn bởi phản ứng (1.47):
CnHmOpNqSr + O2 CO2 + HNO3 + H2SO4 + H2O (1.47)
Một số sản phẩm phân hủy các thuốc nhuộm azo được xác định là: hydroquinon, 1,4-benzo-quinon, 1,3,5-trihydroxynitrobenzen, p-nitrophenol...
Có thể bạn quan tâm!
-
 Các Phương Pháp Xử Lý Hợp Chất Azo Trong Nước Thải Dệt Nhuộm
Các Phương Pháp Xử Lý Hợp Chất Azo Trong Nước Thải Dệt Nhuộm -
![Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40]
Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40] -
 Sự Chuyển Động Của Các Sóng Âm Liên Quan Đến Sự Phát Triển Và Nổ Của Các Bọt Khí.
Sự Chuyển Động Của Các Sóng Âm Liên Quan Đến Sự Phát Triển Và Nổ Của Các Bọt Khí. -
 Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo
Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo -
 Hiện Tượng Các Tia X Nhiễu Xạ Trên Các Mặt Tinh Thể Chất Rắn Phương Pháp Nhiễu Xạ Tia X Là Phương Pháp Phân Tích Không Phá Hủy
Hiện Tượng Các Tia X Nhiễu Xạ Trên Các Mặt Tinh Thể Chất Rắn Phương Pháp Nhiễu Xạ Tia X Là Phương Pháp Phân Tích Không Phá Hủy -
 Bảng So Sánh Chỉ Số Mặt Phẳng Mạng Tinh Thể (Hkl) Của Oxit Phức Hợp Của Cu Và Mn, Oxit Spinel Và Cuo
Bảng So Sánh Chỉ Số Mặt Phẳng Mạng Tinh Thể (Hkl) Của Oxit Phức Hợp Của Cu Và Mn, Oxit Spinel Và Cuo
Xem toàn bộ 165 trang tài liệu này.
Năm 2012, Souada Bouafia-Chergui và các cộng sự đã nghiên cứu 3 loại thuốc nhuộm BB41, BR46 và BY28 bằng hiệu ứng Fenton điện hóa và quang Fenton (UV/Fe3+/H2O2). Kết quả cho thấy tỷ lệ khoáng hóa bằng hiệu ứng Fenton điện hóa phụ thuộc vào các yếu tố như mật độ dòng áp đặt, nồng độ chất xúc tác, pH của dung dịch... Sự phân hủy thuốc nhuộm bởi gốc HOtuân theo phương trình động học bậc một. Với điều kiện tối ưu [Fe3+] = 0,2 mM, mật độ dòng 3 mA/cm2 và pH3, sự suy giảm TOC đạt tới 93, 86 và 77 % lần lượt đối với 3 loại thuốc nhuộm BB41, BR46 và BY28. Sự khoáng hóa cả 3 loại thuốc nhuộm cũng được khảo sát ở giai đoạn thứ hai. Kết quả chỉ ra rằng cả 2 hiệu ứng Fenton điện hóa và quang Fenton đều có thể khoáng hóa hoàn toàn các loại thuốc nhuộm azo, tuy nhiên, hiệu ứng Fenton điện hóa được đánh giá là có hiệu quả hơn do công nghệ Fenton điện hóa không gây ô nhiễm môi trường, tiêu thụ năng lượng ít và không sử dụng các thuốc thử hóa học độc hại [58].
Kết quả nghiên cứu của Shumaila Kiran và các cộng sự (2012) về sự khoáng hóa thuốc nhuộm xanh hoạt tính 222 cũng khẳng định rằng hiệu ứng Fenton điện hóa có thể oxy hóa không chọn lọc các hợp chất azo tạo thành các sản phẩm không độc hại với môi trường [92].
Mohammad Malakootian và các cộng sự (2013) đã đánh giá sự suy giảm nồng độ và COD của xanh hoạt tính 19 (RB19) bằng hiệu ứng Fenton điện hóa trong điều kiện điện thế 20 V và 30 V tương ứng với nồng độ thuốc nhuộm 100 mg/l và 200 mg/l, nồng độ ion Fe2+ 0,5 mg/l, pH = 4, sử dụng điện cực anôt sắt, catôt cacbon. Kết quả là sự suy giảm nồng độ của RB19 đạt 100 %, sự suy giảm COD đạt 95 % sau 60 phút xử lý [93].
Kết quả xử lý nước thải dệt nhuộm bằng hiệu ứng Fenton và Fenton điện hóa của tác giả Rutvij D.Patel và cộng sự [94] cho thấy hiệu suất suy giảm COD chịu ảnh hưởng mạnh bởi các yếu tố như nồng độ H2O2, Fe2+, độ pH, mật độ dòng điện và tỉ lệ các chất hữu cơ trong nước thải. Hiệu suất suy
giảm COD đạt 86 % sau 20 phút xử lý bằng Fenton trong điều kiện nước thải ban đầu có chỉ số COD là 21.000 mg/l, có 20 ml H2O2 30 %, 10 ml Fe2+ 2 %. Bằng hiệu ứng Fenton điện hóa trong điều kiện pH3, 20 ml H2O2 30 %, mật độ dòng 60 mA/cm2, hiệu suất suy giảm COD đạt 76 % sau 10 phút xử lý.
Güçlü và các cộng sự đã nghiên cứu xử lý nước thải công nghiệp than bằng hiệu ứng Fenton điện hóa với mục tiêu chính là hiệu suất suy giảm COD và nồng độ của phenol trong nước thải. Kết quả xử lý khá hiệu quả trong điều kiện tối ưu: pH3, I = 10 A, nồng độ H2O2 2000 mg/l, trong thời gian 10 phút đạt 67,8 % và 98 % [95].
Xiuping Zhu và cộng sự đã sử dụng các vi khuẩn đơn bào làm nhiên liệu như là nguồn năng lượng tái tạo trong các phản ứng Fenton điện hóa để xử lý các chất hữu cơ gây ô nhiễm. Kết quả khảo sát với phenol cho hiệu suất suy giảm TOC đạt 75 % trong 22 giờ. Những kết quả đạt được chứng tỏ phương pháp này tiết kiệm năng lượng và đạt hiệu quả nhất định trong xử lý các chất hữu cơ gây ô nhiễm [96].
Các kết quả khảo sát của Eloy Isarain-Chávez và các cộng sự về sự phân hủy metyl da cam (MO) bằng hiệu ứng Fenton điện hóa cho thấy, điều kiện tối ưu đối với sự phân hủy MO 200 mg/l là 31 mA/cm2, có mặt Fe2+ 0,3mM, sử dụng điện cực catôt Bo pha tạp kim cương (BDD). Kết quả đo HPLC cho thấy các sản phẩm phân hủy sau 60 phút có thể là các axit cacboxylic như: ascorbic, benzoic, citric, maleic và oxalic [97].
* Ở trong nước
Trong những năm gần đây, nhiều nhà khoa học nước ta đã nghiên cứu, ứng dụng các phương pháp oxy hóa tiên tiến trong xử lý các hợp chất azo và nước thải dệt nhuộm. Tuy nhiên, các nghiên cứu chủ yếu là ứng dụng quá trình ozôn hóa, peroxon, Fenton... Một số nghiên cứu điển hình như:
Các nghiên cứu xử lý nước thải dệt nhuộm bằng hiệu ứng Fenton của một số nhóm tác giả Trần Kim Hoa và cộng sự (2003) [98], Đỗ Quốc Chân (2003) [99], Nguyễn Thị Hường (2009) [100] đều cho thấy, hiệu quả xử lý
nước thải dệt nhuộm bằng hiệu ứng Fenton phụ thuộc vào nhiều yếu tố như: bản chất và nồng độ của thuốc nhuộm có trong nước thải, nồng độ của tác nhân oxy hóa H2O2, nồng độ của xúc tác Fe2+...
Kết quả nghiên cứu xử lý nước thải giấy nhà máy giấy Bãi Bằng bằng
Fenton sau xử lý sinh học, loại bỏ 92 % độ màu ở nồng độ Fe2+ 0,1 - 0,15 g/l, nồng độ H2O2 0,13 g/l ở pH3 sau 30 phút [101].
Năm 2004, Nguyễn Hương và các cộng sự đã nghiên cứu và đánh giá
khả năng khử màu và COD của tác nhân Fenton đối với nước thải chứa thuốc nhuộm hoàn nguyên ở Công ty Dệt Minh Khai. Kết quả cho thấy, khoảng hàm lượng H2O2 và FeSO4 để tiến hành phản ứng oxy hóa có hiệu quả tương ứng là 0,7 - 0,8g/l và 0,3 - 0,4 g/l. Nước thải sau xử lý đã trở nên trong và hàm lượng COD giảm từ 352 mg/l xuống dưới 87 mg/l. Kết hợp quá trình oxy hóa sử dụng tác nhân Fenton với quá trình xử lý bằng keo tụ có thể loại bỏ được 94 % màu và 92% lượng COD [102].
Ngoài ra các nghiên cứu của GS.TSKH. Đỗ Ngọc Khuê và các cộng sự [103-106] cũng tập trung nghiên cứu ứng dụng phương pháp Fenton và Fenton điện hóa trong xử lý các hợp chất hữu cơ gây ô nhiễm môi trường trong công nghệ sản xuất vật liệu nổ ở nước ta. Tuy nhiên các nghiên cứu trong nước về ứng dụng phương pháp Fenton điện hóa trong xử lý các hợp chất hữu cơ và nước thải công nghiệp gây ô nhiễm môi trường ở nước ta vẫn còn rất hạn chế, chưa có tính hệ thống.
1.3. Polypyrol và composit Polypyrol(Cu1,5Mn1,5O4)
1.3.1. Oxit phức hợp của kim loại chuyển tiếp
1.3.1.1. Oxit phức hợp cấu trúc spinel
Ban đầu, spinel là tên một loại khoáng vật có công thức hóa học MgAl2O4. Tuy nhiên, hiện nay spinel là tên chung của một kiểu cấu trúc mạng tinh thể gồm khoảng 60 hợp chất (cả khoáng vật và hợp chất tổng hợp) có công
3 2 32 3
thức dạng
Fe[ Fe Fe ]O4 (hoặc AO B2 O3 ). Kim loại A có thể là Mg, Zn, Mn, Fe,
kim loại B có thể là Al, Mn, Cr, Fe. Trong mạng tinh thể cấu trúc spinel, các nguyên tử O sắp xếp chặt khít theo kiểu lập phương. Các nguyên tử A chiếm hốc tứ diện, các nguyên tử B chiếm hốc bát diện. Trong mạng lưới, các cation có kích thước gần giống nhau và cùng mang điện tích nên có thể dễ dàng thay đổi cho nhau. Nhiều oxit chứa cùng một loại ion nhưng với hóa trị khác nhau
2 3 22 4 2
( Fe Fe2 O4 ; Pb2 Pb O4 , Co3O4 ) cũng kết tinh theo kiểu mạng lưới spinel.
Một biến thể quan trọng của cấu trúc spinel được gọi là cấu trúc đảo spinel B[AB]O4. Trong cấu trúc này, nửa số hốc tứ diện được chiếm bởi các ion B, trong khi đó, các ion A cùng nửa số ion B còn lại chiếm các hốc bát
3 2 3 3 2 3
diện. Các hợp chất như Zn[ZnTi]O4; kết tinh theo kiểu cấu trúc này.
Fe[ Co Fe ]O4 ; Fe[ Fe Fe ]O4 và Fe[NiFe]O4
1.3.1.2. Khả năng xúc tác của oxit phức hợp Cu1,5Mn1,5O4 cấu trúc spinel
Với cấu trúc electron đặc biệt nên oxit phức hợp của Cu và Mn thường xảy ra quá trình hấp phụ hoá học trong các hệ phản ứng và đóng vai trò xúc tác cho các phản ứng đó. Thời gian gần đây, oxit phức hợp của Cu và Mn cấu trúc spinel kích thước nano hoặc micro rất được quan tâm nghiên cứu về khả năng xúc tác nói chung và xúc tác điện hoá nói riêng. Năm 1996, Michio Sugawara và các cộng sự đã nghiên cứu quá trình khử oxy hoà tan tạo H2O2 trên điện cực graphit với xúc tác là oxit spinel của Mn và Co [107]. H. Nguyen Cong và các cộng sự đã công bố kết quả nghiên cứu quá trình oxy hoá gián tiếp một số hợp chất hữu cơ bằng H2O2 sinh ra trên điện cực phủ màng Ppy có chứa một số oxit phức hợp cấu trúc spinel. Các quá trình này có sử dụng hiệu ứng Fenton điện hoá [108,109].
1.3.1.3. Các phương pháp tổng hợp oxit phức hợp Cu1,5Mn1,5O4 [110,111]
Hiện nay oxit phức hợp có thể được tổng hợp bằng nhiều phương pháp khác nhau như: Phương pháp gốm; phương pháp đồng kết tủa; phương pháp phun nung; phương pháp vi nhũ; phương pháp sol-gel; phương pháp thủy nhiệt. Mỗi
phương pháp đều có ưu điểm và các hạn chế nhất định, tùy thuộc vào điều kiện và hoàn cảnh cụ thể để lựa chọn phương pháp tổng hợp phù hợp trong nghiên cứu và sản xuất. Phương pháp đồng kết tủa được lựa chọn trong nghiên cứu này do quá trình chế tạo đơn giản, không yêu cầu thiết bị đặc thù và chi phí thấp.
Trong phương pháp đồng kết tủa, oxit phức hợp được điều chế bằng cách kết tủa từ dung dịch muối chứa các cation kim loại dưới dạng hydroxit, cacbonat, oxalat, xitrat,... sau đó rửa kết tủa, sấy khô, nung và nghiền.
Phản ứng tạo kết tủa phụ thuộc vào tích số tan, khả năng tạo phức giữa ion kim loại và ion tạo kết tủa, lực ion, độ pH của dung dịch. Tính đồng nhất hoá học của oxit phức hợp tuỳ thuộc vào tính đồng nhất của kết tủa từ dung dịch. Tổng hợp bằng phương pháp đồng kết tủa, nếu chọn được điều kiện tốt thì quãng đường khuếch tán khi xảy ra phản ứng ở pha rắn chỉ khoảng 10 đến 50 lần kích thước ô mạng cơ sở, nghĩa là nhỏ hơn rất nhiều so với một số phương pháp khác. Sản phẩm thu được trong phương pháp đồng kết tủa có tính đồng nhất cao, bề mặt riêng lớn, độ tinh khiết hoá học cao, tiết kiệm được nhiều năng lượng và không yêu cầu các trang thiết bị đắt tiền. Tuy nhiên, hiệu suất của phương pháp đồng kết tủa điều chế các oxit phức hợp thường không cao.
1.3.2. Polypyrol (Ppy)
1.3.2.1. Cấu trúc phân tử [112]
Pyrol (C4H5N) có cấu tạo và mật độ electron như hình 1.6
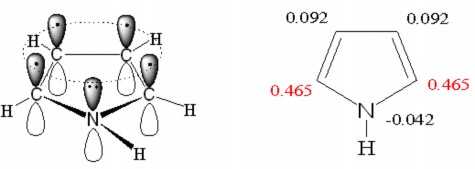
Hình 1.6. Cấu tạo phân tử và mật độ electron của pyrol
Cấu tạo của Ppy có thể biểu diễn bằng hai dạng cấu trúc: dạng vòng thơm và dạng quinoit (hình 1.7).
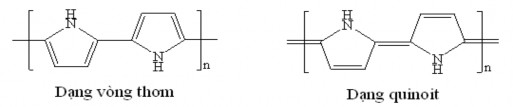
Hình 1.7. Các dạng cấu trúc của Ppy
Cấu trúc kỳ vọng của mạch Ppy là các mắt xích pyrol liên kết với nhau ở vị trí - quay 1800. Với cấu trúc này, mạch Ppy có độ liên hợp cao nhất nên khả năng dẫn điện tốt nhất. Trong trường hợp này, mạch polyme có cấu trúc thẳng và phẳng. Tuy nhiên, trong thực tế luôn có sự sai lệch trong cấu trúc. Bên cạnh sự ghép đôi - quay 1800 của các mắt xích còn có sự ghép đôi - và sự ghép đôi - không quay 1800. Những cấu trúc này sẽ làm sai lệch tính chất thẳng và phẳng của mạch polyme. Sự sai lệch cũng như sự rút ngắn mạch liên hợp sẽ dẫn đến sự giảm hoặc mất đi tính dẫn điện của mạch polyme.
1.3.2.2. Phương pháp tổng hợp [112,113] a/ Phương pháp hóa học
Ppy được tổng hợp lần đầu tiên vào năm 1916, bởi sự oxy hóa pyrol bằng H2O2, sản phẩm được tạo thành có dạng bột vô định hình, có màu đen gọi là “pyrol đen”, sản phẩm này không tan trong nước và các dung môi hữu cơ. Pyrol đen có thể được điều chế với sự có mặt của nhiều tác nhân oxy hóa khác nhau, bao gồm: hidropeoxit trong dung môi axit axetic, chì đioxit, sắt(III)clorua, axit nitrơ, quinolin hay ozon... Các phương pháp điều chế hóa học nếu sử dụng chất đầu là axit hay peoxit thường cho ra sản phẩm chủ yếu là các vật liệu cách điện ở nhiệt độ phòng (có độ dẫn điện đặc trưng khoảng 10-10
- 10-11 S/cm). Các Ppy cách điện này có thể được pha tạp với các chất nhận
electron họ halogen như brom hay iot nhằm thu được vật liệu dẫn điện bền, với độ dẫn điện vào khoảng 10-5 S/cm.
Một trong những tác nhân oxy hóa hay được sử dụng nhiều nhất cho quá trình polyme hóa Ppy là các ion kim loại chuyển tiếp có tính oxy hóa như ion Fe3+, Cu2+. Một số muối của các kim loại đó được sử dụng trong quá trình
polyme hóa pyrol là: FeCl3, Fe(NO3)3, Fe(ClO4)3, Fe2(SO4)3, CuCl2. Ppy thu được trong các trường hợp này có độ dẫn điện từ 10-5 - 200 S/cm. Các muối sắt(III) là tác nhân oxy hóa thường được sử dụng phổ biến trong tổng hợp các
polyme vì vật liệu tạo thành có độ dẫn điện cao.
n + 2n FeCl3 N
H
+ 2nFeCl2 + 2nHCl n
(1.48)
N
H
Ưu điểm của phương pháp hóa học là đơn giản, cho hiệu suất cao. Tuy nhiên, còn hạn chế là có rất ít chất oxy hóa vừa có khả năng oxy hóa monome lại vừa có khả năng đóng vai trò là chất pha tạp thích hợp. Polyme thu được bằng phương pháp tổng hợp này thường dưới dạng bột và có độ dẫn điện không cao. b/ Phương pháp điện hóa
Phương pháp tổng hợp điện hóa là phương pháp hữu hiệu nhất do tạo được Ppy trực tiếp trên bề mặt vật liệu làm điện cực với độ dẫn điện cao, sạch và có khả năng điều khiển các tính chất cũng như độ dày của màng bằng các thông số điện hóa. Quá trình polyme hóa pyrol là dạng điển hình nhất cho các polyme dị vòng. Cơ chế tổng hợp Ppy bằng phương pháp điện hóa gồm bốn giai đoạn:
- Giai đoạn 1: Sự oxy hóa monome, hình thành một cation gốc.
- Giai đoạn 2: Cation gốc cặp đôi với một gốc khác tạo ra một đication.
- Giai đoạn 3: Đication này trải qua phản ứng đề proton hóa tạo ra một đime trung hòa.
- Giai đoạn 4: Đime trung hòa này bị oxy hóa tạo thành một cation gốc. Sau đó, đime này cặp đôi với các cation gốc khác dẫn đến sự phát triển mạch. Khi đạt đến một độ dài nhất định, mạch polyme này trở nên không tan và lắng đọng trên bề mặt điện cực tạo thành lớp phủ.
1.3.3. Composit polypyrol(oxit)
Các kim loại chuyển tiếp và các oxit của chúng có phân lớp d và f chưa bão hoà điện tích, có số oxy hoá thay đổi cũng được xem như các chất xúc tác sử dụng tương đối rộng rãi trong công nghiệp. Trong quá trình xúc tác, thông

![Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40]](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-dac-diem-cua-qua-trinh-khoang-hoa-mot-so-hop-chat-huu-co-ho-4-1-120x90.jpg)