tác quang TiO2 pha tạp có dải phổ hấp thụ rộng và hiệu suất lượng tử cao đã và đang được các nhà khoa học đặc biệt quan tâm. Chất xúc tác quang TiO2 cũng có thể sử dụng ánh sáng mặt trời như nguồn năng lượng kích thích [59]. Ngoài ra, xúc tác quang điện hóa sử dụng điện cực TiO2 đã được nghiên cứu bởi Vinodgopal và cộng sự [61]. Gần đây, sử dụng chất hấp thụ xúc tác hỗ trợ (cacbon hoạt tính) cho TiO2 nhằm tăng tốc độ khoáng hóa một số vi chất hữu cơ ô nhiễm [62]. Tuy hiệu quả cao, nhưng phương pháp này có tốc độ khoáng hóa tương đối chậm nên đòi hỏi thời gian xử lý tương đối dài.
e. Phương pháp siêu m Chiếu xạ bằng siêu m
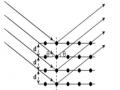
Một số sóng siêu âm được sử dụng cho phép sản sinh các vi bọt rỗng trong dung dịch lỏng. Các bọt rỗng này được tạo thành trong chu kỳ khan hiếm không khí của sóng truyền âm (hình 1.4).

Hình 1.4. Sự chuyển động của các sóng âm liên quan đến sự phát triển và nổ của các bọt khí.
Mặt khác, sự phân tách liên kết O-H của phân tử nước nhờ siêu âm tạo ra các gốc (OH, HO2…).
H2O + siêu âm → OH + H(1.39)
Các gốc tự do sau khi hình thành có thể tham gia vào các phản ứng phụ để sản xuất hydro peoxit hoặc nước:
OH + H→ H2O (1.40)
Có thể bạn quan tâm!
-
 Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 2
Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 2 -
 Các Phương Pháp Xử Lý Hợp Chất Azo Trong Nước Thải Dệt Nhuộm
Các Phương Pháp Xử Lý Hợp Chất Azo Trong Nước Thải Dệt Nhuộm -
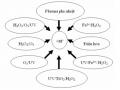
![Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40]
Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40] -
![Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]
Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83] -
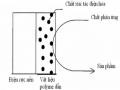
 Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo
Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo -
 Hiện Tượng Các Tia X Nhiễu Xạ Trên Các Mặt Tinh Thể Chất Rắn Phương Pháp Nhiễu Xạ Tia X Là Phương Pháp Phân Tích Không Phá Hủy
Hiện Tượng Các Tia X Nhiễu Xạ Trên Các Mặt Tinh Thể Chất Rắn Phương Pháp Nhiễu Xạ Tia X Là Phương Pháp Phân Tích Không Phá Hủy
Xem toàn bộ 165 trang tài liệu này.
OH + OH → H2O2 (1.41)
2OH → H2O + O(1.42)
Tần số siêu âm được sử dụng trong khoảng từ 20 MHz đến 500 MHz. Sự phân hủy chất ô nhiễm hữu cơ một mặt xảy ra theo cơ chế gốc tự do, mặt khác xảy ra do sự đốt trong các bọt rỗng (≈ 3000°C). Hiệu quả xử lý phụ thuộc vào các tính chất vật lý và hóa học của các chất ô nhiễm hữu cơ [63].
Một trong những khó khăn của siêu âm là hiệu quả phân hủy thấp. Tuy nhiên, các nghiên cứu đã cho thấy bức xạ siêu âm cho phép tăng hiệu quả quá trình quang xúc tác [63]. So sánh quá trình quang xúc tác, siêu âm và quang xúc tác kết hợp với siêu âm thực hiện bởi Maezawa và cộng sự [64] đối với phân hủy axit da cam đã chỉ ra rằng quá trình kết hợp cho kết quả tốt hơn cả.
f. Plasma nguội
Gần đây, phương pháp mới phóng tia lửa điện hồ quang “Glidarc” đã chứng minh được hiệu quả phân hủy các chất ô nhiễm trong dung dịch cũng như trong pha khí [65-68]. Thực tế, tia lửa hồ quang là quá trình phóng điện sinh ra trong trường điện tích có mật độ cao được hình thành giữa 2 hoặc 3 điện cực khác nhau và trượt dưới phương pháp khí plasma. Quá trình phóng điện này được gọi là hồ quang nguội, kéo theo hình thành các ion dương, ion âm, điện tử và chất hoạt hóa khác. Các chất trong plasma phụ thuộc vào trạng thái tự nhiên của khí plasma. Trong trường hợp khí ẩm, các chất này được sinh ra từ N2, O2 và H2O. Các nghiên cứu đã chỉ ra rằng có sự có mặt của nitơ,
oxit nitơ và các gốc NO, HO, HO2trong khí plasma ẩm [69-70].
1.2.3. Phương pháp điện hóa
Quá trình điện hóa cho phép loại bỏ hoặc giảm thiểu các hợp chất ô nhiễm bằng cách oxy hóa trực tiếp các chất ô nhiễm trên điện cực nhờ dòng điện hoặc tạo ra các tác nhân oxy hoá trong môi trường có khả năng oxy hóa các hợp chất hữu cơ độc hại.
Có hai phương pháp tạo ra gốc hydroxyl: oxy hóa trực tiếp tại anôt hoặc oxy hóa gián tiếp trên catôt bằng hiệu ứng Fenton điện hoá (ghép giữa phương pháp điện hóa và hệ phản ứng Fenton).
1.2.3.1. Oxy hóa điện hóa trực tiếp tại anôt tạo gốc hydroxyl
Phương pháp này cho phép oxy hóa nước tạo gốc hydroxyl hấp thụ trên bề mặt anôt có quá thế oxy cao:
H2O → OH ads + H+ + e- (1.43)
Gốc hydroxyl tạo ra có khả năng oxy hóa nhiều hợp chất hữu cơ trong dung dịch. Việc lựa chọn vật liệu điện cực anôt vô cùng quan trọng, quyết định khả năng ứng dụng của phương pháp này. Khoảng 20 năm trở lại đây, rất nhiều công trình khoa học tập trung nghiên cứu xử lý nước thải công nghiệp ô nhiễm bởi các hợp chất hữu cơ, các vật liệu điện cực hiệu quả nhất đều có quá thế oxy cao. Trong số các vật liệu nghiên cứu này, các oxit kim loại như oxit thiếc, oxit chì, dioxit chì pha tạp và platin [71-73] là các vật liệu điện cực có nhiều triển vọng. Một vật liệu mới, kim cương pha tạp Bo (BDD - Boron doped diamond) cho quá thế oxy cao nhất từ trước đến nay đã được nghiên cứu áp dụng [73].
Hiện nay, điện cực anôt BDD được cho là vật liệu tối ưu cho phép hình thành gốc hydroxyl, mở ra hướng ứng dụng điện cực anôt tạo chất oxy hóa mạnh cho phép khoáng hóa hoàn toàn các hợp chất hữu cơ.
1.2.3.2. Phương pháp Fenton điện hóa
Phương pháp Fenton điện hóa tạo ra tại chỗ các tác nhân oxy hóa như hydro peoxit hoặc gốc hydroxyl [40,74,75] đã được phát triển trong các năm gần đây để xử lý nước thải chứa các hợp chất hữu cơ.
Hiệu ứng Fenton điện hóa khác so với các phương pháp oxy hóa tiên tiến khác là hình thành gốc hydroxyl do phản ứng Fenton (phản ứng 1.6) xảy ra dưới sự hỗ trợ của dòng điện. Ưu điểm chính của quá trình này là dưới tác dụng của dòng điện, cùng một lúc hydro peoxit có thể được tạo ra nhờ phản ứng khử oxy hòa tan trên điện cực catôt (phản ứng 1.44) và chất xúc tác ion
sắt Fe2+ được tái tạo nhờ phản ứng khử điện hóa (phản ứng 1.45) và cho phép tăng hiệu quả quá trình Fenton.
O2 + 2H+ + 2e → H2O2 (1.44)
Fe3+ + e → Fe2+ (1.45)
Quá trình khử oxy hoà tan diễn ra theo cơ chế nhận 2 electron tạo H2O2 hoặc nhận 4 electron tạo -OH phụ thuộc vào bản chất vật liệu làm catôt. Do đó vật liệu điện cực có khả năng xúc tác điện hóa cho phản ứng khử oxy tạo H2O2 là một trong các yếu tố quan trọng nhất, quyết định hiệu suất của quá trình xử
lý nước thải bằng phương pháp Fenton điện hóa. Bên cạnh đó, các tiêu chí cơ bản cho sự lựa chọn vật liệu điện cực phải có quá thế hydro lớn đối với điện cực catôt và quá thế oxy lớn đối với quá trình anôt.
- Điện cực anôt: Thường sử dụng nhiều nhất là Pt, ngoài ra còn có thể sử dụng các loại vật liệu khác như PbO2, kim cương pha tạp nguyên tố Bo (BDD). Khi sử dụng điện cực anôt platin, phản ứng oxy hóa nước giải phóng oxy có thể xảy ra theo phản ứng 1.46, lượng oxy này được khuếch tán sang catôt làm tăng hiệu suất phản ứng tạo hydro peoxit ở catôt. Các phản ứng này hoàn toàn được điều khiển bởi dòng điện.
2H2O O2 + 4H+ + 4e (1.46)
- Điện cực catôt: Phản ứng tạo H2O2 trong dung dịch lỏng chỉ được đảm bảo bởi phản ứng khử hai điện tử của phân tử oxy trên điện cực catôt thích hợp như điện cực thủy ngân, graphit, phớt cacbon hoặc catôt khuếch tán oxy [76-77].
Khi sử dụng phớt cacbon làm điện cực catôt, do diện tích bề mặt lớn, oxy dễ dàng khử trên điện cực catôt tạo hydro peoxit với lượng gấp 10 lần so với cacbon kính. Tuy nhiên Grimm và cộng sự [78] cho rằng độ xốp của vật liệu điện cực lại làm giảm hiệu quả của quá trình chuyển khối các chất ô nhiễm đến bên trong các lỗ xốp của điện cực thực hiện quá trình xử lý. Brillas và cộng sự [79] đã chỉ ra rằng điện cực catôt khuếch tán oxy cũng có thể được sử dụng để khử O2 tạo H2O2 trong môi trường axit.
Ngoài vật liệu điện cực và các thông số pH của môi trường, nồng độ xúc tác, nhiệt độ, bản chất chất xúc tác và mật độ dòng điện cũng là các thông số chính ảnh hưởng đến cơ chế và hiệu suất của hiệu ứng Fenton điện hóa:
+ Bản chất xúc tác: Các loại xúc tác khác nhau như: ion Fe2+, Fe3+,
Cu2+, Co2+, Ag+, có thể được sử dụng một mình hoặc kết hợp với nhau để tạo ra gốc hydroxyl. Chen và cộng sự [80] đã nghiên cứu hiệu quả của hệ Fe/H2O2, Co/H2O2 và Cu/H2O2 đến quá trình khoáng hóa brompyogalol và quá trình xử lý nước thải công nghiệp dệt nhuộm. Nghiên cứu này đã chỉ ra rằng, sắt sử dụng một mình là chất xúc tác hiệu quả hơn cả. Ngoài ra, Gallard và cộng sự [81] đã chỉ ra rằng, tốc độ phân hủy H2O2 và oxy hóa atrazin chậm
hơn khi có mặt ion Cu2+ so với sự có mặt một mình Fe3+ và sự bổ sung thêm
ion Cu2+ làm tăng hiệu quả của hệ Fe3+/H2O2. Các nghiên cứu của Guivarch
[37] cho thấy, sự phân hủy xanh malachit nhanh và hiệu quả hơn trong khi sử dụng xúc tác sắt so với đồng hoặc bạc. Theo Bandara và cộng sự [82], khả năng xúc tác phụ thuộc chủ yếu vào năng lượng hydrat hóa, kích thước ion solvat hóa và dạng đồng phân của các chất xúc tác.
+ Mật độ dòng điện: Sự tăng mật độ dòng điện cho phép tăng khả năng phân hủy các hợp chất hữu cơ. Sự tăng tốc quá trình phân hủy tương ứng với sự tăng dòng điện được giải thích do sự hình thành lượng H2O2 và tái tạo ion
Fe2+ nhiều hơn, dẫn đến tạo hydroxyl nhiều hơn.
Tuy nhiên, sự tăng này có thể có ảnh hưởng tích cực trong một giá trị giới hạn. Khi cường độ dòng điện vượt quá giá trị giới hạn này, nó có thể ức chế sự phân hủy các chất ô nhiễm trong dung dịch. Boye và cộng sự [70] đã thực hiện quá trình khoáng hóa 2,4,5-T bằng quá trình Fenton điện hóa sử dụng dòng điện nhỏ, trong thời gian ngắn. Dòng điện cao cho phép tăng tốc động học của quá trình khoáng hóa nhưng cũng tăng lượng điện tích tiêu thụ. Nó cũng tạo điều kiện thuận lợi cho quá trình giải phóng hydro ở catôt và mất mát năng lượng do tỏa nhiệt. Hiện tượng này đã được ghi nhận trong một số nghiên cứu khác [37,72,83].
Một số ưu điểm của hiệu ứng Fenton điện hóa:
- Sản phẩm H2O2 được tạo ra tức thời và liên tục, cho phép điều khiển tốt nhất sự hình thành gốc hydroxyl. Nồng độ xúc tác Fe2+ sử dụng chỉ cần đủ để làm hoạt động hệ Fenton nhờ chu kỳ tái tạo Fe2+ bằng dòng điện, việc này một mặt cho phép loại bỏ sự kết tủa tạo bùn sắt(III) so với quá trình Fenton;
- Vận hành tối ưu ở nhiệt độ thường và áp suất khí quyển;
- Quá trình này dễ dàng kết hợp với các phương pháp oxy hóa tiên tiến khác như UV, siêu âm và xử lý vi sinh;
- Lượng chất xúc tác (cation kim loại) đưa vào trong dung dịch có nồng độ thường rất nhỏ, tồn tại dưới dạng ion tự do hoặc dưới dạng phức với các chất hữu cơ tự nhiên. Sử dụng phương pháp này có ưu điểm kép: không cần bổ sung chất xúc tác trong quá trình xử lý nước thải ô nhiễm và có thể thải trực tiếp nước sau khi xử lý ra môi trường không cần thông qua khâu xử lý nhằm loại bỏ các ion kim loại xúc tác được bổ sung ban đầu.
Một trong các nhược điểm của quá trình Fenton điện hóa là giống như quá trình Fenton, kỹ thuật này yêu cầu giá trị pH của dung dịch phải được khống chế xung quanh 3 do quá trình phụ thuộc vào pH của dung dịch.
1.2.4. Ứng dụng hiệu ứng Fenton điện hoá để khoáng hóa hợp chất azo trong nước thải dệt nhuộm
1.2.4.1. Khái niệm về quá trình khoáng hoá hợp chất azo
* Khái niệm về khoáng hoá
Khoáng hoá là quá trình phân huỷ các hợp chất hữu cơ tạo thành các hợp chất khoáng đơn giản, sản phẩm cuối cùng là muối vô cơ tan và chất khí.
* Ðặc điểm của quá trình khoáng hoá hợp chất màu azo [19]
Quá trình khoáng hoá hợp chất màu azo thường xảy ra theo 2 giai đoạn:
+ Giai đoạn 1: Dưới tác dụng của các tác nhân oxy hoá mạnh, liên kết azo bị phá hủy thành các dẫn xuất hydrocacbon như: hydroquinon, axit cacboxylic, nitrophenol...
+ Giai đoạn 2 (giai đoạn khoáng hoá hoàn toàn): Các dẫn xuất hydrocacbon bị phân hủy hoàn toàn bởi các tác nhân oxi hoá mạnh, tạo thành CO2, H2O và các hợp chất vô cơ tan.
* Các yếu tố ảnh hưởng đến quá trình khoáng hoá hợp chất màu azo
[19,83]
+ Thành phần và cấu trúc của các hợp chất màu azo: hợp chất màu azo có thành phần và cấu trúc hoá học khác nhau thì tốc độ khoáng hoá khác nhau.
+ Quá trình khoáng hoá hợp chất màu azo bằng phương pháp Fenton điện hóa chịu ảnh hưởng bởi các yếu tố khác như: Mật độ dòng áp đặt, Vật liệu điện cực catôt, nồng độ chất xúc tác Fe2+... Ở các điều kiện khác nhau sẽ cho tốc độ hình thành tác nhân oxy hóa là gốc hydroxyl khác nhau, dẫn tới tốc độ khoáng hoá các hợp chất azo khác nhau.
Trong đề tài luận án này, khoáng hoá hợp chất màu azo trong nước thải dệt nhuộm bằng hiệu ứng Fenton điện hóa, sử dụng vật liệu catôt là màng Ppy(Cu1,5Mn1,5O4)/Ppy, kết quả bước đầu tương đối khả quan, mở ra ứng dụng phương pháp này trong xử lý nước thải chứa các hợp chất hữu cơ độc hại, giảm thiểu ô nhiễm môi trường.
1.2.4.2. Tình hình nghiên cứu, ứng dụng hiệu ứng Fenton điện hóa trong khoáng hóa hợp chất azo và nước thải dệt nhuộm
* Ở nước ngoài
Chỉ tính từ năm 1999 trở lại đây đã có hàng nghìn công trình nghiên cứu về ứng dụng hiệu ứng Fenton điện hóa trong xử lý hợp chất hữu cơ độc hại và nước thải chứa hợp chất hữu cơ độc hại.
Với bản chất tạo ra gốc hydroxyl có tính oxy hóa rất mạnh, có khả năng oxy hóa không chọn lọc hầu hết các hợp chất hữu cơ hòa tan trong dung dịch nước. Vì vậy trong những năm gần đây, Hiệu ứng Fenton điện hóa đã và đang được nhiều nhà khoa học trên thế giới quan tâm nghiên cứu, ứng dụng trong lĩnh vực xử lý nước thải chứa các hợp chất hữu cơ gây ô nhiễm môi trường [83-89].
Các kết quả nghiên cứu sử dụng hiệu ứng Fenton điện hóa nhằm xử lý các nguồn nước ô nhiễm bởi các hợp chất hữu cơ độc hại cho hiệu quả cao hơn nhiều so với các phương pháp thông thường khác.
Jun-jie và cộng sự đã khảo sát quá trình khoáng hóa thuốc nhuộm azo
C.I. axit đỏ 14 sử dụng quặng sắt khi có và không có tác dụng của siêu âm ở tần số thấp [90]. Tác giả đã chỉ ra rằng dưới tác động của siêu âm, nước có thể bị phân hủy và tạo H2O2, cho phép hình thành hệ phản ứng Fenton trong dung dịch. Trong cả 2 trường hợp có và không có siêu âm, phản ứng phân hủy azo
C.I. axit đỏ 14 tuân theo quy luật động học bậc nhất với hằng số tốc độ phản ứng tương ứng là 7,5.10-2phút-1 và 2,58.10-1 s-1. Shaobin Wang đã so sánh động học của phản ứng Fenton (Fe2+/H2O2) và phản ứng giống Fenton (Fe3+/H2O2) trong khi nghiên cứu xử lý hợp chất màu azo C.I. axit đen 1. Phản ứng Fenton cho hiệu suất oxy hóa phân hủy thuốc nhuộm cao hơn so với phản ứng giống Fenton ở 100 phút đầu tiên và sau đó hiệu suất của 2 phản ứng gần như tương đương. Tỷ lệ [Fe2+]:[H2O2] là 3:0,75 trong cả hai trường hợp và sự
phân hủy các chất màu phụ thuộc vào nồng độ ban đầu của Fe2+, H2O2 và pH
trong khoảng nhiệt độ khảo sát từ 15-45oC [91].
Năm 2007, Minghua Zhou và các cộng sự đã nghiên cứu khảo sát ảnh hưởng của các yếu tố (pH, nồng độ Fe2+, thế điện cực catôt, nồng độ muối Na2SO4, nồng độ metyl đỏ) tới sự phân hủy metyl đỏ bằng hiệu ứng Fenton điện hóa sử dụng điện cực graphit-polytetrafloetylen (PTFE). Kết quả cho thấy sự suy giảm màu sắc xảy ra nhanh và đạt 80% trong 20 phút điện phân trong các điều kiện tốt nhất là: pH = 3, thế catôt = -0,55 V/SCE, nồng độ Fe2+ 0,2 mM, nồng độ metyl đỏ 100 mg/l, nồng độ muối Na2SO4 0,1 M, tốc độ sục oxy 0,4 l/phút. Sự phân hủy metyl đỏ bằng hiệu ứng Fenton điện hóa trong cùng điều kiện được đánh giá là có ưu thế đối với trường hợp nồng độ thuốc nhuộm cao và được thực hiện ở hai giai đoạn khác nhau. Giai đoạn một là giai đoạn phá vỡ liên kết azo tạo ra các sản phẩm trung gian có chứa vòng benzen, giai đoạn hai là giai đoạn phá hủy các vòng benzen thành các hợp chất vô cơ ít hoặc

![Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40]](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-dac-diem-cua-qua-trinh-khoang-hoa-mot-so-hop-chat-huu-co-ho-4-1-120x90.jpg)
![Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-dac-diem-cua-qua-trinh-khoang-hoa-mot-so-hop-chat-huu-co-ho-6-1-120x90.jpg)