CuxMn3-xO4. Kết hợp với kết quả phân tích EDX, có thể đưa ra công thức phân tử của oxit đã tổng hợp được là Cu1,5Mn1,5O4.
Bảng 3.2. Bảng so sánh chỉ số mặt phẳng mạng tinh thể (hkl) của oxit phức hợp của Cu và Mn, oxit spinel và CuO
hkl của oxit spinel | hkl của CuO monoclinic | |||
2 độ | Cường độ nhiễu xạ | hkl của oxit phức hợp | ||
14.25 16.25 17.00 18.00 19.5 21.95 24.15 25.25 28.00 27.75 28.85 29.75 32.00 | 864 2091 500 750 523 272 386 755 317 777 340 317 532 | 220 311 222 -111 400 -202 422 511 -113 440 022 113 533 | 220 311 222 - 400 - 422 511 - 440 - - 533 | 110 002 - -111 - -202 020 - -113 - - 022 004 |
Có thể bạn quan tâm!
-
![Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]
Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83] -
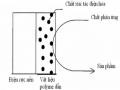
 Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo
Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo -
 Hiện Tượng Các Tia X Nhiễu Xạ Trên Các Mặt Tinh Thể Chất Rắn Phương Pháp Nhiễu Xạ Tia X Là Phương Pháp Phân Tích Không Phá Hủy
Hiện Tượng Các Tia X Nhiễu Xạ Trên Các Mặt Tinh Thể Chất Rắn Phương Pháp Nhiễu Xạ Tia X Là Phương Pháp Phân Tích Không Phá Hủy -
 Kết Luận Về Tổng Hợp Và Đặc Tính Của Màng Ppy Và Ppy(Oxit)/ppy:
Kết Luận Về Tổng Hợp Và Đặc Tính Của Màng Ppy Và Ppy(Oxit)/ppy: -
 Các Đường Cong Phân Cực Catôt Trên Điện Cực Cacbon.
Các Đường Cong Phân Cực Catôt Trên Điện Cực Cacbon. -
 Ảnh Hưởng Của Vật Liệu Catôt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Theo Thời Gian Khoáng Hóa Metyl Đỏ 0,35 Mm
Ảnh Hưởng Của Vật Liệu Catôt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Theo Thời Gian Khoáng Hóa Metyl Đỏ 0,35 Mm
Xem toàn bộ 165 trang tài liệu này.
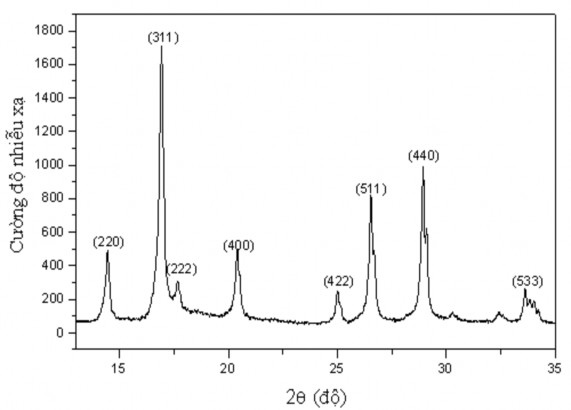
Hình 3.5. Phổ nhiễu xạ tia X của oxit spinel chuẩn
3.1.4. Kết luận về tổng hợp và đặc tính của oxit phức hợp của Cu và Mn:
+ Oxit phức hợp của Cu và Mn được tổng hợp thành công bằng phương pháp đồng kết tủa.
+ Các kết quả đo SEM, TEM, EDX và X-Ray cho thấy oxit phức hợp của Cu và Mn tổng hợp được có kích thước hạt nhỏ mịn, cấu trúc spinel và có công thức phân tử là Cu1,5Mn1,5O4.
3.2. Tổng hợp và khả năng xúc tác điện hoá của màng Ppy và Ppy(Cu1,5Mn1,5O4)/Ppy
3.2.1. Tổng hợp màng Ppy và Ppy(Cu1,5Mn1,5O4)/Ppy trên điện cực nền C
Quá trình tổng hợp màng Ppy bằng phương pháp điện hoá là quá trình oxy hoá monome (pyrol) xảy ra trên điện cực anôt theo phương trình sau:
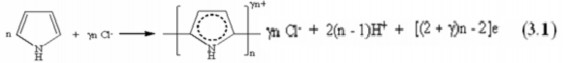
Trong trường hợp Ppy chứa oxit phức hợp Cu1,5Mn1,5O4, quá trình tổng hợp điện hoá gồm hai giai đoạn: Màng Ppy(Cu1,5Mn1,5O4) được tổng hợp bằng phương pháp dòng áp đặt tại mật độ dòng 2 mA/cm2 với thời gian 500
giây trong dung dịch KOH 0,5 M chứa oxit tồn tại dưới dạng huyền phù nhờ khuấy từ và bên ngoài phủ màng Ppy được tổng hợp trong cùng điều kiện nhưng không có oxit. Màng Ppy phủ bên ngoài có tác dụng tăng cường độ bền, độ ổn định và bảo vệ màng Ppy(Cu1,5Mn1,5O4) bên trong mà vẫn đảm bảo được quá trình khuếch tán của oxy qua màng đến lớp phủ Ppy(Cu1,5Mn1,5O4) để xảy ra phản ứng khử.
Hình 3.6 biểu diễn sự biến thiên điện thế trong quá trình tổng hợp màng Ppy có và không có oxit phức hợp Cu1,5Mn1,5O4.
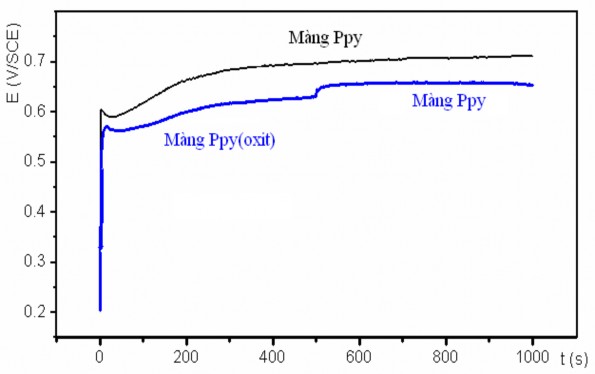
Hình 3.6. Sự biến đổi điện thế theo thời gian trong quá trình tổng hợp màng Ppy và Ppy(Cu1,5Mn1,5O4)/Ppy
Tại thời điểm bắt đầu quá trình tổng hợp, điện thế tăng vọt tới một giá trị ổn định, tương đương với quá trình polyme hoá pyrol thành polypyrol lắng đọng trên bề mặt điện cực anôt.
Trong quá trình tổng hợp, điện thế của điện cực anôt có xu hướng tăng dần từ giá trị +0,55 đến +0,65 V/SCE. Sự không ổn định này có thể được giải thích do bề mặt của điện cực cacbon có nhiều lỗ xốp, ở thời điểm đầu khi màng Ppy chưa hình thành, diện tích hoạt hoá của điện cực tương đối lớn, theo thời gian màng Ppy hình thành lấp kín các lỗ xốp sẽ làm giảm diện tích bề mặt, dẫn đến tăng mật độ dòng điện tổng hợp (cường độ dòng điện không đổi) kéo theo điện thế tăng lên. Mặt khác, trong quá trình polyme hoá pyrol, nồng độ pyrol giảm dần cũng dẫn đến sự tăng nhẹ của điện thế oxy hoá pyrol. So sánh điện thế quá trình tổng hợp màng Ppy khi có và không có oxit cho thấy sự có mặt của các oxit làm cho điện thế tổng hợp giảm đáng kể. Điều này được giải thích là khi có mặt oxit sẽ làm tăng diện tích bề mặt điện cực làm giảm mật độ dòng điện tổng hợp dẫn đến điện thế giảm.
Quan sát ảnh SEM (hình 3.7) cho thấy, sau khi tổng hợp, màng Ppy và Ppy(Cu1,5Mn1,5O4)/Ppy thu được khá mịn, đồng nhất, có màu xám đen, che phủ toàn bộ bề mặt điện cực.

b |
Hình 3.7. Ảnh SEM của màng Ppy (a) và Ppy(oxit)/Ppy (b) sau khi tổng hợp
3.2.2. Đặc tính của màng Ppy và Ppy(Cu1,5Mn1,5O4)/Ppy
3.2.2.1. Thành phần của màng Ppy(Cu1,5Mn1,5O4)/Ppy
Thành phần của màng Ppy(Cu1,5Mn1,5O4)/Ppy sau khi tổng hợp được phân tích nhờ phổ tán xạ tia X (EDX), kết quả được biểu diễn trên hình 3.8.
Quan sát phổ EDX của màng Ppy(Cu1,5Mn1,5O4)/Ppy (hình 3.8) cho thấy, ngoài thành phần của polypyrol và cacbon nền, còn có thành phần của kim loại Cu và Mn, điều này khẳng định sự có mặt của oxit phức hợp của Cu và Mn trong thành phần của màng composit thu được. Ngoài ra trên phổ EDX còn xuất hiện các pic của Si và S với cường độ rất nhỏ. Nguyên nhân có thể do S còn lưu lại trong quá trình tổng hợp oxit bằng phương pháp đồng kết tủa đi từ CuSO4 và MnSO4, Si là tạp chất, có mặt trong cacbon nền.
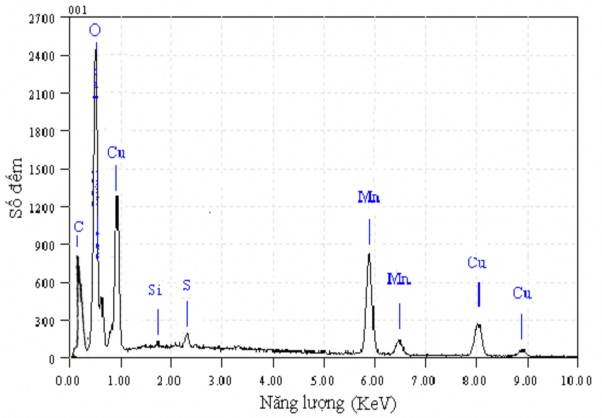
Hình 3.8. Phổ tán xạ năng lượng tia X của màng Ppy(Cu1,5Mn1,5O4)/Ppy
Bảng 3.3. Thành phần các nguyên tố trong màng Ppy(Cu1,5Mn1,5O4)/Ppy
% về khối lượng | % về nguyên tử | |
Cu | 24,07 | 14,5 |
Mn | 23,09 | 15,05 |
S | 1,07 | 1,72 |
O | 10,91 | 19,52 |
C | 39,63 | 46,01 |
Các tạp chất khác | 1,22 | 3,2 |
Total | 100 | 100 |
Cu1,5Mn1,5O4)/Ppy
Oxy có thể khử theo 2 trường hợp khác nhau phụ thuộc vào bản chất tự nhiên của vật liệu điện cực [110,115-117].
- Trường hợp 1: Khử trực tiếp 4 electron
+ Trong môi trường trung tính hoặc kiềm:
O2 + 2H2O + 4e 4OH- (3.2)
+ Trong môi trường axit:
O2 + 4H+ + 4e 2H2O (3.3)
- Trường hợp 2: Khử trực tiếp 2 electron
+ Trong môi trường trung tính hoặc kiềm:
O2 + H2O + 2e HO2- + OH- (3.4)
tiếp theo: HO2- + H2O + 2e 3OH- (3.5)
+ Trong môi trường axit:
O2 + 2H+ + 2e H2O2 (1.51)
tiếp theo: H2O2 + 2e + 2H+ 2H2O (3.6) Mặt khác, H2O2 và HO2- có khả năng tự chuyển hoá:
2HO2- 2OH- + O2 (3.7)
2H2O2 2H2O + O2 (3.8)
Giữa HO2- và H2O2 thiết lập một cân bằng axit - bazơ theo phương trình: HO2- + H2O 2H2O2 + OH- pKa = 2,35 (3.9)
Trong quá trình khử như được mô tả ở trên, có sự hấp phụ của các ion (O2-)hp, (HO2)hp và peoxit (HO2-)hp, (H2O2)hp. Cũng giống như các phản ứng điện hoá khác, phản ứng khử oxy hòa tan tạo H2O2 trên catôt được chia thành nhiều giai đoạn nối tiếp nhau, giai đoạn có tốc độ phản ứng chậm nhất sẽ quyết định tốc độ của toàn bộ quá trình phản ứng:
- Giai đoạn 1: Khuếch tán oxy đến bề mặt điện cực.
- Giai đoạn 2: Oxy được hấp phụ lên bề mặt điện cực.
- Giai đoạn 3: Oxy trao đổi electron trên điện cực tạo ra sản phẩm.
- Giai đoạn 4: Nhả hấp phụ sản phẩm và khuếch tán sản phẩm vào dung dịch.
Thực nghiệm đã chứng minh rằng phản ứng khử oxy hoà tan bằng 2 electron tạo H2O2 sẽ thuận lợi hơn khi sự nhả hấp phụ sản phẩm xảy ra nhanh. Một trong các yếu tố quan trọng quyết định điều đó là bản chất của vật liệu được sử dụng làm điện cực. Ngoài ra, để tăng cường quá trình khuếch tán nói chung, trong đó có quá trình nhả hấp phụ nói riêng, dung dịch được khuấy đều liên tục trong quá trình diễn ra phản ứng khử oxy.
Ngoài bản chất vật liệu điện cực, pH của dung dịch cũng là yếu tố quan trọng quyết định cơ chế và tốc độ của quá trình khử oxy hoà tan tạo H2O2.
Trong luận án này, quá trình khử oxy hoà tan trên các loại điện cực phủ màng polyme dẫn Ppy khác nhau trong dung dịch Na2SO4 0,05 M tại các giá trị pH khác nhau, không và có sục oxy đã được khảo sát.
a/ Khảo sát khả năng xúc tác điện hoá tại các pH khác nhau
Hình 3.9 biểu diễn quan hệ dòng điện phản hồi theo thời gian khi sử dụng phương pháp điện thế dừng (Steady state) với điện thế áp đặt tại điện cực catôt trên cơ sở Ppy, bắt đầu từ giá trị điện thế mạch hở từ +0,4 V/SCE đến
-0,5 V/SCE (tương ứng với khoảng điện thế khử oxy tạo H2O2), bước nhảy thế có giá trị 0,1 V. Thời gian của mỗi bước nhảy điện thế được duy trì khoảng 500 giây nhằm đảm bảo cho dòng điện phản hồi tương ứng đạt giá trị ổn định.
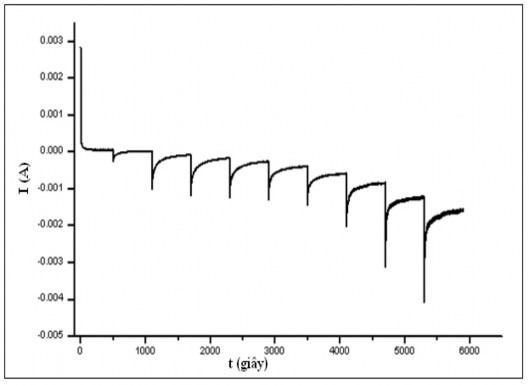
Hình 3.9. Mối quan hệ i-t tại các điện thế áp đặt En
Tại giá trị điện thế catôt En áp đặt đủ lớn, có thể cùng xảy ra 2 quá trình đồng thời: quá trình Ppy bị khử và quá trình khử các chất oxy hoá trên điện cực Ppy, dẫn đến sự tăng lên của dòng catôt. Sau một thời gian ngắn, Ppy đạt đến trạng thái cân bằng tại điện thế áp đặt, lúc này dòng điện ổn định, tương ứng với quá trình khử các chất oxy hoá. Quan hệ giữa điện thế áp đặt và dòng

![Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-dac-diem-cua-qua-trinh-khoang-hoa-mot-so-hop-chat-huu-co-ho-6-1-120x90.jpg)