Các phản ứng phụ này chiếm ưu thế ít hay nhiều phụ thuộc vào điều kiện môi trường. Tổng kết cơ chế chính của hệ thống Fenton cùng các phản ứng liên quan được liệt kê tại bảng 1.4.
Bảng 1.4. Các phản ứng chính ảnh hưởng đến hệ phản ứng Fenton và các hằng số nhiệt động tương ứng [40]
k (mol-1.l.s-1) | Phương trình | |
Khơi mào H2O2 + Fe2+ → Fe3+ + OH- + OH Xúc tác: Hình thành Fe(II) Fe3+ + H2O2 → Fe2+ + HO2+ H+ Fe3+ + HO2→ Fe2+ + O2 + H+ Fe3+ + O2- → Fe2+ + O2 Phát triển mạch OH + H2O2 → H2O + HO2HO2→ H+ + O2- RH + OH → R+ H2O ArH + OH→ ArHOH Ức chế Fe2+ + OH → Fe3+ + OH- Fe2+ + HO2+ H+ → Fe3+ + H2O2 Fe2+ + O2- + 2H+ → Fe3+ + H2O2 O2- + HO2+ H+ → H2O2 + O2 HO2+ HO2→ H2O2 + O2 O2- + HO→ OH- + O2 O2- + HO+ H2O → H2O2 + O2 + OH- HO+ HO→ H2O2 2OH → H2O2 | 55 3,1.10-3 2.104 5.107 3,3.107 1,6.105 107 - 109 108 - 1010 4,3.108 1,2.106 1,0.107 9,7.107 8,3.105 7,1.109 1,0.1010 9,7.107 5,3.109 | (1.6) (1.7) (1.11) (1.12) (1.8) (1.13) (1.14) (1.15) (1.16) (1.17) (1.18) (1.19) (1.20) (1.21) (1.22) (1.23) (1.24) |
Có thể bạn quan tâm!
-
 Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 1
Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 1 -
 Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 2
Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 2 -
 Các Phương Pháp Xử Lý Hợp Chất Azo Trong Nước Thải Dệt Nhuộm
Các Phương Pháp Xử Lý Hợp Chất Azo Trong Nước Thải Dệt Nhuộm -
 Sự Chuyển Động Của Các Sóng Âm Liên Quan Đến Sự Phát Triển Và Nổ Của Các Bọt Khí.
Sự Chuyển Động Của Các Sóng Âm Liên Quan Đến Sự Phát Triển Và Nổ Của Các Bọt Khí. -
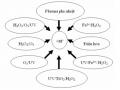
![Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]
Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83] -
 Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo
Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo
Xem toàn bộ 165 trang tài liệu này.
Tuy nhiên, hoạt tính của các gốc hydroxyl đối với các hợp chất hữu cơ chỉ bắt đầu được công nhận từ năm 1930, sau khi cơ chế phản ứng của nó được làm sáng tỏ. Hiện nay, chất hoạt động của hệ Fenton (Fe2+, H2O2) được sử dụng để xử lý nước thải chứa các hợp chất hữu cơ độc hại, bền và không phân hủy sinh học (nước thải nông nghiệp và công nghiệp, các hợp chất phenol, hợp chất màu, nước rác...).
Hiệu quả của hệ phản ứng Fenton phụ thuộc vào nhiều yếu tố như: pH [41], nồng độ Fe2+ [42], nồng độ H2O2 [43], nồng độ các chất ô nhiễm ban đầu
[44] và nhiệt độ phản ứng [43]. Tuy nhiên, pH và nồng độ của các chất hoạt hóa hệ phản ứng Fenton (Fe2+ và H2O2) là các yếu tố quan trọng nhất.
* Ảnh hưởng của pH:
Hiệu ứng Fenton và các phương pháp liên quan (Fenton quang hóa, Fenton điện hóa) làm việc tối ưu trong khoảng pH bằng 3 [41]. Khi giá trị pH lớn hơn 4, các ion sắt có xu hướng kết tủa hydroxit. Khi pH dưới 2,5, hiệu quả của phản ứng giảm vì ba cơ chế [45]:
+ Hình thành các hợp chất của sắt (hình 1.2)
+ Tăng tốc phản ứng tiêu thụ HObằng H2O2 (phản ứng 1.8)
+ Ức chế phản ứng tái sinh tạo Fe2+ (phản ứng 1.7)
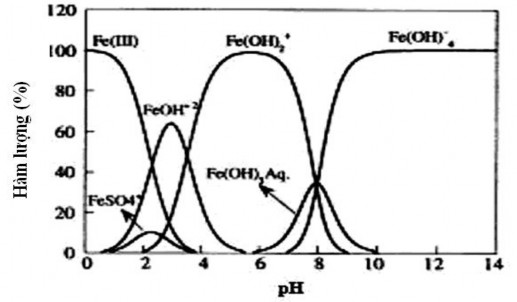
Hình 1.2. Các hợp chất Fe(III) phụ thuộc vào pH tại 20oC [46]
* Ảnh hưởng của nồng độ chất xúc tác:
Ảnh hưởng của nồng độ xúc tác đã được chỉ ra trong nhiều nghiên cứu cho thấy với nồng độ cao, đặc biệt là ion Fe3+, làm giảm hiệu quả của quá trình khoáng hóa do phản ứng phụ giữa •OH và H2O2 (phản ứng 1.8) [47]. Các nghiên cứu của Guivarch [37] đã chỉ ra rằng nồng độ sắt thấp thúc đẩy sự phân hủy azobenzen, axit salicylic và xanh malachit, bằng quá trình khoáng hóa nhờ phương pháp Fenton điện hóa.
* Ảnh hưởng của tỷ lệ [H2O2]/[Fe2+]:
Tỷ lệ [H2O2]/[Fe2+] là yếu tố quan trọng quyết định hiệu quả của quá trình khoáng hóa các hợp chất hữu cơ trong phản ứng Fenton. Edelahi [48] đã chỉ ra rằng hiệu quả xử lý diuron bằng phương pháp Fenton tăng khi tỷ lệ [H2O2]/[Fe2+] và nồng độ chất xúc tác tăng. Tuy nhiên, khi nồng độ H2O2 và Fe2+ quá cao dẫn đến việc tiêu thụ gốc OH, kéo theo giảm sự phân hủy các hợp chất hữu cơ nhờ phương pháp Fenton.
H2O2
Phương pháp Fenton có nhược điểm lớn là các cacboxylic trung gian không thể phân hủy do các axit cacboxylic và dicacboxylic (L) có thể tạo phức bền với sắt và ngăn cản phản ứng với hydro peoxit, dẫn đến quá trình tái sinh xúc tác bị ngừng lại trước khi quá trình khoáng hóa hoàn toàn được diễn ra.
Fe2+ + nL → [FeLn]x+ Kết thúc chu kỳ tái sinh xúc tác (1.25)
c. Phương pháp quang hóa đồng thể
Tia tử ngoại được sử dụng thường xuyên trong xử lý nước bằng cách trực tiếp hoặc kết hợp với các hệ chất oxy hóa, chủ yếu là hydro peoxit, ozôn hoặc hệ phản ứng Fenton.
* Phân hủy quang trực tiếp bằng tử ngoại (UV)
Phân hủy quang đơn giản là chiếu xạ bởi ánh sáng có bước sóng được lựa chọn kỹ để năng lượng của các photon có thể được hấp thụ trong môi
trường, đặc biệt hấp thụ bởi các chất gây ô nhiễm và dẫn đến phản ứng phân hủy chúng. Thực tế, rất nhiều các hợp chất sau khi hấp thụ tử ngoại, bị kích thích bởi các photon hoặc trực tiếp bị phá hủy bởi phản ứng quang phân.
Hợp chất hữu cơ hấp thụ photon chuyển sang trạng thái kích thích (phương trình 1.26) dễ dàng phản ứng với oxy hoà tan trong nước và biến đổi thành sản phẩm (phản ứng 1.27). Tuy nhiên, một số sản phẩm tạo thành của quá trình oxy hóa đôi khi còn độc hại hơn cả các hợp chất cần xử lý ban đầu [49].
R + h → R(1.26)
R+ O2 → R+ + O2- (1.27)
R+ → Sản phẩm (1.28)
Việc xử lý các hợp chất hữu cơ bằng phân hủy quang trực tiếp ít được áp dụng thực tế là do chi phí vận hành lớn, thiết bị thường có độ tin cậy thấp và gặp nhiều khó khăn để duy trì hệ thống. Ngoài ra, sự xuất hiện của quá trình clo hóa được đánh giá là hiệu quả và có lợi hơn.
* Kết hợp tử ngoại với H2O2 (UV/H2O2)
Hiệu quả quá trình oxy hóa xử lý các chất ô nhiễm bằng phân hủy quang trực tiếp có thể được cải thiện bằng cách bổ xung hydro peoxit vào môi trường. Thực tế, khi chiếu bức xạ tử ngoại có bước sóng từ 200 - 280 nm, cứ 1 phân tử hydro peoxit hấp thụ 1 photon bị phân hủy tạo 2 gốc hydroxyl HO[50]:
H2O2 + h → 2OH (1.29)
OH + H2O2 → H2O + HO2 | k = (2 – 3,8).107 mol-1.l.s-1 | (1.30) |
2HO2→ H2O2 + O2 | k = 8,3. 105 mol-1.l.s-1 | (1.21) |
2OH → H2O2 | k = 5,3.109 mol-1.l.s-1 | (1.24) |
HO2+ OH → H2O2 + O2 | k = 0,71.1010 mol-1.l.s-1 | (1.31) |
Gốc HOtạo thành cho phép khơi mào phản ứng xử lý các hợp chất hữu cơ một cách nhanh và hiệu quả theo cơ chế gốc. Các phản ứng chính diễn ra như sau:
Tuy nhiên, hệ số hấp thụ nguyên tử của H2O2 là tương đối thấp trong vùng tử ngoại (18,6 mol-1.l.cm-1), do đó cần sử dụng hydro peoxit với nồng độ cao để
quá trình oxy hóa các hợp chất hữu cơ hiệu quả. Vì vậy, việc tăng nồng độ H2O2 ban đầu và cường độ của ánh sáng UV dẫn đến tăng tốc độ của phản ứng oxy hóa. Tuy nhiên khi nồng độ H2O2 quá cao dẫn đến tiêu thụ gốc hydroxyl như phản ứng 1.8. Behnajady và cộng sự [51] đã chỉ rõ việc kết hợp chiếu xạ UV với H2O2 cải thiện sự phân hủy axit da cam 7. Ngoài ra, pH của môi trường phải được điều khiển nhằm tránh sự kết tủa, có thể làm giảm hiệu quả bức xạ tia cực tím. Nếu nước thải bao gồm các hạt lơ lửng hoặc các hợp chất màu, nước thải cần phải được tiền xử lý nhằm loại bỏ chúng trước khi chiếu UV, nếu không, hiệu quả xử lý sẽ bị suy giảm đáng kể. Vì vậy, trên góc độ kinh tế, phương pháp này hiệu quả trong một số trường hợp sử dụng chúng như một bước tiền xử lý nhằm tăng hiệu quả của quá trình phân hủy vi sinh tiếp theo.
* Kết hợp tử ngoại với O3 (UV/O3)
Ozôn kết hợp với chiếu tử ngoại (quá trình peroxon hóa) là quá trình được sử dụng từ năm 1970. Quá trình gồm hai giai đoạn: Đầu tiên, ozôn bị quang phân bởi ánh sáng (λ ≤ 315 nm):
O3 + H2O + h → H2O2 + O2 (1.32)
Sau đó, các gốc hydroxyl có thể tiếp tục được tạo ra do phản ứng phân hủy O3 khi có mặt H2O2 hoặc do phản ứng phân hủy quang H2O2.
3O3 + H2O2 + h → 2OH+ 3O2 (1.33)
H2O2 + h → 2OH(1.34)
Hệ số hấp thụ phân tử tại bước sóng 254 nm của ozon (εO3 = 3600) lớn hơn nhiều so với hệ số hấp thụ phân tử của H2O2 (εH2O2 = 18,6). Do đó, quá trình phân hủy quang ozôn không hạn chế như quá trình quang phân H2O2 khi sử dụng đèn UV thủy ngân thấp áp với bước sóng 254 nm. Hiệu quả của quá trình này phụ thuộc vào lượng ozôn được sử dụng và độ dài bước sóng bức xạ áp dụng [52]. Hơn nữa, ứng dụng của biện pháp này đối với nước thải chứa các hạt lơ lửng hoặc các chất màu là rất hạn chế do hiệu quả bức xạ UV thấp.
* Kết hợp tử ngoại với peroxon hóa (O3/UV/H2O2)
Ozôn hóa kết hợp đồng thời với bức xạ tia cực tím và hydro peoxit đảm bảo quá trình phân hủy tốt hơn hai quá trình sử dụng ozôn hoặc kết hợp tử ngoại với ozôn, do hiệu quả tạo gốc tự do, đặc biệt là gốc hydroxyl tốt hơn cả. Thực tế, phương pháp này cho phép hình thành gốc hydroxyl đồng thời từ nhiều con đường khác nhau. Nó được sử dụng để xử lý nước thải có pH biến động, có màu hoặc đục. Trapido và cộng sự [53] đã chỉ ra rằng hiệu quả phân hủy nitrophenol bằng cách kết hợp giữa ozôn với hệ UV/H2O2 cao hơn so với quá trình ozôn hóa hoặc UV/H2O2 riêng rẽ. Tuy nhiên, giống như các quá trình sử dụng ozôn trong dung dịch lỏng, hiệu quả xử lý các hợp chất hữu cơ độc hại liên quan chặt chẽ đến độ hòa tan của ozôn trong dung dịch. Ngoài ra, chi phí của quá trình này rất cao, do đó ứng dụng của nó vẫn còn hạn chế trong nhiều trường hợp cụ thể.
* Fenton quang hóa (Fe2+/H2O2/UV) - Xúc tác quang đồng thể
Chiếu xạ UV kết hợp với hệ Fenton cho phép thúc đẩy sự hình thành ion Fe2+ từ Fe3+ dưới tác dụng của bức xạ UV. Chính vì vậy, trong một số trường hợp, hệ Fenton cổ điển (Fe2+/H2O2) thường được thực hiện với sự có mặt của bức xạ UV. Thông thường, Fe2+ ban đầu được thay thế bằng Fe3+. Trong điều kiện tối ưu (pH xung quanh 3), sắt(III) thủy phân tạo Fe(OH)2+. Chiếu xạ UV (λ> 300 nm) cho phép tạo ion Fe2+ tại chỗ và ngay sau đó phản ứng với H2O2 hình thành đồng thời gốc hydroxyl và Fe3+, chu kỳ tạo Fe2+ lại tiếp tục lặp lại.
Fe3+ + H2O → Fe(OH)2+ + H+ (1.35)
Fe(OH)2+ + h → Fe2+ + OH (1.36)
Fe2+ + H2O2 → Fe(OH)2+ + OH (1.37)
H2O2 + h → 2OH (1.38)
Tốc độ phản ứng khử Fe3+ dưới tác dụng bức xạ UV cũng như tốc độ hình thành gốc hydroxyl phụ thuộc vào bước sóng bức xạ và pH. Hiệu suất
lượng tử tạo gốc hydroxyl dưới tác dụng của bức xạ tử ngoại với sự có mặt của ion sắt(III) được giới thiệu trong bảng 1.5.
Bảng 1.5. Hiệu suất lượng tử tạo gốc hydroxyl dưới tác dụng của bức xạ tử ngoại/nhìn thấy với sự có mặt của của ion Fe3+ [54].
Hợp chất Fe3+ | ε (l-1 mol-1 cm-1) | Hiệu suất lượng tử hình thành OH | |
254 313 360 | Fe3+ Fe(OH)2+ Fe(OH)2+ | 1500 2000 400 | 0,065 0,140 0,017 |
Các chất Fe(OH)2+ có hiệu suất lượng tử hình thành OH cao nhất (0,14) tại bước sóng bức xạ 313 nm, lớn hơn hai lần so với hiệu suất lượng tử của ion Fe3+ nhưng tại bước sóng 254 nm. Kết quả này cho thấy ưu thế của phương pháp này là cho phép sử dụng với nồng độ sắt tương đối cao và trong môi trường axit yếu.
Sự hình thành gốc hydroxyl do đồng thời hai quá trình quang hóa Fe3+
và Fenton cho phép tăng đáng kể hiệu quả của quá trình. Ngoài ra, sự đóng góp gốc hydroxyl của phản ứng quang hóa H2O2 theo phản ứng 1.32 là không đáng kể do hydro peoxit hấp thụ yếu bức xạ trong vùng UV và vùng nhìn thấy. Hợp chất Fe(OH)2+ là chất hoạt hóa nhất cho phản ứng tạo các gốc hydroxyl [55]. Sự phân hủy các hợp chất hữu cơ xảy ra nhờ các gốc hydroxyl tạo ra tại chỗ bằng phản ứng quang hóa Fe3+ và phản ứng Fenton. Phản ứng quang hóa là giai đoạn chiếm ưu thế trong hệ với sự hình thành hydroferic và các gốc tự do bổ xung cho phép khoáng hóa các hợp chất hữu cơ. Hiệu quả của hiệu ứng Fenton quang hóa phụ thuộc mạnh vào tỷ lệ nồng độ [H2O2]/[Fe2+] cũng như pH của dung dịch [48]. Theo Huaili và cộng sự [56], nồng độ H2O2 tăng làm tăng tốc độ hình thành các gốc hydroxyl, dẫn đến tăng tốc quá trình phân hủy thuốc nhuộm axit Eosin Y. Sự tăng này đạt đến giới hạn khi hydro peoxit bị phân hủy và kết hợp với các gốc hydroxyl. Hơn nữa, các
tác giả này cũng chỉ ra rằng nồng độ của các ion Fe2+ bị giới hạn bởi một giá trị tối ưu 600 mg/l nếu vượt ra ngoài giá trị này thì hiệu suất khoáng hóa chất màu sẽ giảm xuống.
Hiệu ứng Fenton quang hóa đã được chứng minh là biện pháp hiệu quả cho phép phân hủy các chất hữu cơ gây ô nhiễm mà không xử lý được bằng phương pháp hóa lý và vi sinh như hợp chất phenol, thuốc nhuộm và thuốc trừ sâu [41,44,56-58].
d. Xúc tác quang dị thể sử dụng TiO2
h+
Xúc tác quang dị thể dựa trên trạng thái kích thích của chất bán dẫn đóng vai trò như chất xúc tác. Cấu trúc điện tử của chất bán dẫn được đặc trưng bởi vùng hóa trị điền đầy hoàn toàn và vùng dẫn hoàn toàn trống. Dưới tác động của tia UV với năng lượng photon lớn hơn hoặc bằng sự chênh lệch năng lượng giữa vùng hóa trị và vùng dẫn, điện tử từ vùng hóa trị sẽ chuyển lên vùng dẫn (ký hiệu e-CB) và để lại một lỗ trống tại vùng hóa trị (ký hiệu
VB) [59,60] (hình 1.3).
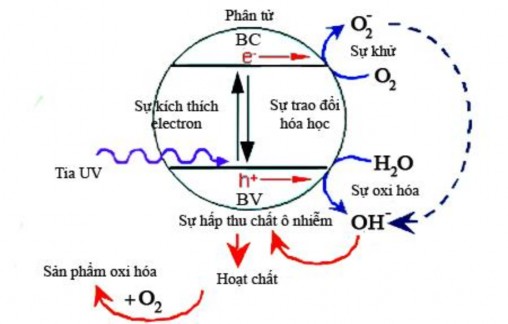
Hình 1.3. Sơ đồ lược hóa cơ chế phân hủy nhờ xúc tác quang
Trong thực tế, một phần lớn cặp điện tử - lỗ trống có thể tái kết hợp làm giảm hiệu suất lượng tử. Tuy nhiên, việc nghiên cứu nhằm tạo ra các chất xúc



![Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-dac-diem-cua-qua-trinh-khoang-hoa-mot-so-hop-chat-huu-co-ho-6-1-120x90.jpg)