- Khoảng pH chuyển từ xanh tím sang đỏ: 3,0 - 5,2.
- Trong dung dịch kiềm công gô đỏ có màu đỏ, trong dung dịch axit vô cơ có màu xanh da trời.
- Công gô đỏ thường được dùng để nhuộm các loại sợi xenlulozơ, cơ chế nhuộm màu như sau:
NH2[R]SO3Na NH2[R]SO3- + Na+
[VLN]-OH [VLN]-O- + H+
Trong dung dịch nước, ion mang màu của thuốc nhuộm và xenlulozơ đều tích điện âm nên khi nhuộm cần phải đưa thêm chất điện ly vào hồ nhuộm để tăng nồng độ ion Na, làm giảm điện tích ion của cả thuốc nhuộm và xơ sợi làm cho lực đẩy giữa xơ sợi và thuốc nhuộm giảm, dẫn đến lượng thuốc nhuộm được hấp thụ trên xơ sợi tăng.
1.2. Các phương pháp xử lý hợp chất azo trong nước thải dệt nhuộm
1.2.1. Hiện trạng ô nhiễm nước thải dệt nhuộm ở nước ta
Trong những năm gần đây, mặc dù lĩnh vực bảo vệ môi trường đã và đang được nhà nước đặc biệt quan tâm, song một số công ty, nhà máy và hầu hết các làng nghề sản xuất dệt nhuộm thủ công vẫn xả thải trực tiếp nguồn nước thải sau sản xuất chưa qua xử lý ra các con sông, hồ, kênh, rạch… gây ảnh hưởng nghiêm trọng đến đời sống và sức khỏe của người dân. Tại một số làng nghề như Vạn Phúc, Dương Nội (Hà Đông), nhu cầu oxy hoá học COD trong các công đoạn tẩy, nhuộm đo được từ 380 - 890 mg/l, cao hơn tiêu chuẩn cho phép từ 3 - 8 lần; độ màu đo được là 750 Pt-Co, cao hơn tiêu chuẩn cho phép nhiều lần [21]. Nước thải sau sản xuất dệt nhuộm chứa nhiều loại hoá chất độc hại gây ô nhiễm cho các con sông, ao hồ, tiêu diệt các loài thuỷ sinh, gây tác động xấu tới sản xuất, sinh hoạt của con người [21].
Các vấn đề về sự ô nhiễm môi trường dưới sự tác động của ngành công nghiệp tẩy nhuộm đã gia tăng trong nhiều năm qua. Các quá trình tẩy nhuộm có tỷ lệ mất mát chất tẩy nhuộm lên đến 50 %. Nguyên nhân của việc mất mát chất tẩy, nhuộm là do các chất này không bám dính hết vào sợi vải, số phẩm
nhuộm này sẽ đi theo đường nước thải ra ngoài. Việc thu hồi các chất thất thoát chỉ đạt khoảng 75 % [10,11]. Vì vậy việc xử lý nước thải dệt nhuộm là vấn đề cần được quan tâm nghiên cứu.
Bên cạnh những lợi ích của chất tạo màu họ azo trong công nghiệp nhuộm, thì tác hại của nó không nhỏ khi mà các chất này được thải ra môi trường. Gần đây, các nhà nghiên cứu đã phát hiện ra tính độc hại và nguy hiểm của hợp chất họ azo đối với môi trường và con người, đặc biệt là loại thuốc nhuộm này có thể gây ung thư cho người sử dụng sản phẩm. Ngoài ra, nước thải có màu sắc đậm làm mất thẩm mỹ và gây cản trở việc tiếp nhận ánh sáng của các sinh vật thủy sinh [1,2,22,23].
1.2.2. Hiện trạng công nghệ xử lý nước thải nhuộm nhiễm các hợp chất azo
1.2.2.1. Các phương pháp xử lý truyền thống
* Phương pháp hấp phụ [1,13]
Phương pháp hấp phụ được dùng để phân hủy các chất hữu cơ không hoặc khó phân hủy sinh học. Trong công nghệ xử lý nước thải dệt nhuộm, thường dùng chúng để khử màu nước thải dệt nhuộm hòa tan và thuốc nhuộm hoạt tính.
Cơ sở của quá trình là sự hấp phụ chất tan lên bề mặt chất rắn (chất hấp phụ), sau đó giải hấp để tái sinh chất hấp phụ.
Các chất hấp phụ thường được sử dụng là than hoạt tính, than nâu, đất sét, magie cacbonat. Trong số đó, than hoạt tính hấp phụ hiệu quả nhất là do có bề mặt riêng lớn 400 - 1500 m2/g. Nhu cầu lượng than hoạt tính để xử lý chất thải màu là khác nhau, trong đó có sự tổn thất do quá trình hoạt hóa nhiệt cho than.
Phương pháp này có nhiều ưu điểm nhưng không kinh tế nên không được sử dụng rộng rãi.
* Phương pháp oxy hóa [1,13]
Cơ sở của phương pháp này là dùng các chất oxy hóa mạnh để phá vỡ một phần hay toàn bộ phân tử thuốc nhuộm chuyển thành dạng đơn giản khác. Các chất oxy hóa thường dùng gồm O3, H2O2, Cl2...
Ozôn là chất oxy hóa mạnh, được dùng để phá hủy các hợp chất hữu cơ đặc biệt là các hợp chất màu azo có mặt trong nước thải dệt nhuộm. Ưu điểm của nó là dễ tan trong nước, tốc độ phản ứng nhanh, xử lý triệt để, không tạo bùn cặn, cải thiện phân giải vi sinh, giảm chỉ số COD của nước. Ozôn có thể sử dụng đơn lẻ hay kết hợp với hydroperoxit, tia tử ngoại, siêu âm, hấp phụ than hoạt tính để phá huỷ nhiều thuốc nhuộm azo như: N-rot-green, N- orange và indigo rabinol.
Hydroperoxit cũng là một chất oxy hóa mạnh, có khả năng oxy hóa nhiều hợp chất hữu cơ và vô cơ. Tuy nhiên nếu phản ứng oxy hóa chỉ bằng hydroperoxit không đủ hiệu quả để oxy hóa các chất màu có nồng độ lớn. Sự kết hợp giữa H2O2 và FeSO4 tạo nên hiệu ứng Fenton, cho phép khoáng hóa rất nhiều hợp chất hữu cơ và nhiều loại thuốc nhuộm khác nhau (hoạt tính, trực tiếp, bazơ, axit và phân tán), làm giảm chỉ số COD của nước.
Các chất chứa clo hoạt tính (NaClO, Cl2, …) có thể xử lý nhiều thuốc nhuộm khác nhau tương đối hiệu quả, tuy nhiên nó cũng có các hạn chế nhất định. Các nghiên cứu của Hamada và cộng sự đã chỉ ra rằng việc xử lý các chất màu họ azo có thể được oxy hóa nhờ natri hypoclorơ (NaClO), nhưng sau khi phá hủy các hợp chất hữu cơ, các halogen dễ dàng hình thành các trihalogenmetan và gây ô nhiễm môi trường thứ cấp [13].
1.2.2.2. Các phương pháp oxy hoá tiên tiến
Quá trình oxy hóa tiên tiến là một trong các phương pháp hiệu quả nhằm xử lý các chất hữu cơ gây ô nhiễm, đặc biệt là các chất độc hại có nồng độ cao, khó phân hủy bằng các phương pháp hóa, lý và vi sinh truyền thống.
uá trình oxy hóa tiên tiến là nh ng quá trình phân hủy dựa vào gốc tự do hoạt động hydroxyl OH được tạo ra trong môi trường lỏng ngay trong
quá trình xử lý. Các gốc hydroxyl rất hoạt hóa và là tác nhân oxy hóa gần như mạnh nhất từ trước đến nay (Eo = +2,8V), chỉ đứng sau flo (Eo = +2,87 V). Điện thế oxy hóa của các chất sử dụng phổ biến trong môi trường lỏng được giới thiệu trên bảng 1.3.
Đặc tính của các gốc tự do là trung hòa về điện. Mặt khác, các gốc này không tồn tại sẵn trong môi trường như những tác nhân oxy hóa thông thường, mà được sản sinh ngay trong quá trình phản ứng, có thời gian sống rất ngắn, khoảng vài nghìn giây nhưng liên tục được sinh ra trong suốt quá trình phản ứng.
Bảng 1.3. Điện thế oxy hóa của một số tác nhân oxy hóa mạnh trong môi trường lỏng [24]
Điện thế oxy hóa V SH | |
OHO3 H2O2 HO2 ClO2 Cl2 O2 | 2,80 2,07 1,77 1,70 1,50 1,36 1,23 |
Có thể bạn quan tâm!
-
 Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 1
Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 1 -
 Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 2
Nghiên cứu đặc điểm của quá trình khoáng hóa một số hợp chất hữu cơ họ AZO trong nước thải dệt nhuộm bằng phương pháp Fenton điện hóa - 2 -
![Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40]
Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40] -
 Sự Chuyển Động Của Các Sóng Âm Liên Quan Đến Sự Phát Triển Và Nổ Của Các Bọt Khí.
Sự Chuyển Động Của Các Sóng Âm Liên Quan Đến Sự Phát Triển Và Nổ Của Các Bọt Khí. -
![Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]
Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]
Xem toàn bộ 165 trang tài liệu này.
Đặc điểm nổi trội của phương pháp oxy hóa tiên tiến là các gốc hydroxyl tạo ra có khả năng phản ứng nhanh và không chọn lọc với hầu hết các hợp chất hữu cơ (hằng số tốc độ phản ứng trong khoảng 107 và 1010 mol-1.l.s-1). Đặc tính oxy hóa không chọn lọc này vô cùng quan trọng, cho phép mở rộng phạm vi áp dụng của phương pháp với các nước thải không đồng nhất, chứa các hợp chất ô nhiễm khác nhau. Khả năng hoạt hóa nhanh phù hợp với thời gian sống ngắn và nồng độ tức thời thấp của các gốc tự do hydroxyl. Đặc biệt, phản ứng của gốc hydroxyl với các anken và các hợp chất thơm rất nhanh, hằng số tốc độ phản ứng trong khoảng 108-1010 mol-1.l.s-1 [24,25], do đó các gốc hydroxyl này cho phép khoáng hóa các chất hữu cơ ô nhiễm, khó phân hủy sinh học trong thời gian từ vài phút đến vài giờ. Các gốc hydroxyl có thể được hình thành bằng các phương pháp khác nhau như được mô tả trên hình 1.1.
Các quá trình oxy hóa tiên tiến được phân loại dựa vào trạng thái pha (đồng thể hoặc dị thể) hoặc dựa vào phương pháp tạo gốc hydroxyl (phương pháp hóa học, quang hóa, điện hóa…).
Hiệu quả của quá trình xử lý các chất ô nhiễm phụ thuộc vào rất nhiều thông số như nồng độ tác nhân oxy hóa, cường độ ánh sáng UV, pH, nhiệt độ… cũng như thành phần của môi trường cần xử lý. Ngoài ra, hiệu quả của quá trình oxy hóa có thể bị ảnh hưởng do sự tiêu thụ gốc hydroxyl của các hợp chất vô cơ hoặc hữu cơ có mặt trong môi trường. Hằng số tốc độ phản ứng giữa gốc hydroxyl với cacbonat và bicacbonat lần lượt là 1,5.107 và 4,2.108 mol-1.l.s-1 [26].
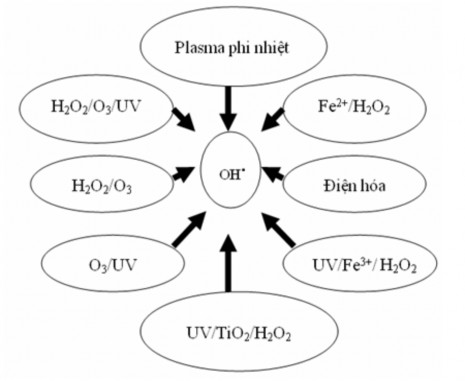
Hình 1.1. Các quá trình hình thành gốc hydroxyl
Nhìn chung các phản ứng của các quá trình oxy hóa tiên tiến tương tự nhau, tuy nhiên hiệu quả xử lý và hiệu quả kinh tế của quá trình phụ thuộc vào phương pháp hình thành gốc OH và các điều kiện vận hành của hệ thống.
1.2.2.3. Một số quá trình oxy hoá tiên tiến thường gặp
a. Quá trình ozon hóa
* Ozôn hóa đơn giản
Ozôn được phát hiện vào năm 1839 bởi C. F. Schombein. Đây là một chất khí không ổn định trong không khí và bị phân hủy dần thành phân tử oxy, thời gian bán hủy của nó trong khí quyển khoảng 12 giờ [27]. Tuy nhiên,
sự phân hủy của nó tăng khi nhiệt độ tăng và kéo theo tăng tỷ lệ pha loãng của ozôn trong không khí [28]. Ozôn có khả năng oxy hóa các hợp chất hữu cơ nên thường được dùng trong xử lý nước. Do tính không ổn định, dễ phân hủy nên ozôn cần phải được tạo ra tại chỗ, tức thời ngay trước khi sử dụng. Phản ứng tổng quát hình thành ozôn được mô tả như sau:
3O2 → 2O3 (ΔH = 68 kcal) (1.1)
Do đó, chỉ cần cung cấp một năng lượng 34 kcal cho phép tạo ra 1 mol ozon. Phương pháp tạo ozôn phổ biến nhất bằng cách phóng điện plasma nguội [29]. Phản ứng có thể được mô tả như sau:
O2 + 2e → O- + O- (1.2)
O2 + O- → O3- (1.3)
Ozôn có thể được sản xuất từ oxy nguyên chất hoặc không khí nhưng với hiệu suất thấp hơn khoảng hai lần.
Trong nước, ozôn không bền và bị phân hủy tương đối nhanh. Ở 20oC,
thời gian bán hủy của ozôn khoảng 20 - 30 phút [27]. Phản ứng phân hủy ozôn trong môi trường nước đã được Peleg [30] đề xuất như sau:
O3 + H2O → O2 + OH (1.4)
Do đó, quá trình oxy hóa các hợp chất hữu cơ bằng ozôn có thể được tiến hành theo hai cách [31]:
Cách 1: Oxy hóa trực tiếp bởi các phân tử ozôn hòa tan trong nước bằng cách tấn công vào các nguyên tố ưa điện tử tại các liên kết chưa bão hòa của anken hoặc các hợp chất thơm;
Cách 2: Oxy hóa gián tiếp bởi các gốc hydroxyl, hình thành trong quá trình phân hủy phân tử ozôn theo phản ứng 1.4.
Phản ứng oxy hóa trực tiếp bằng phân tử ozôn có tính chọn lọc cao và tương đối chậm (diễn ra khoảng một vài phút), trong khi các phản ứng oxy hóa gián tiếp bằng các gốc tự do là không chọn lọc và diễn ra rất nhanh (trong một vài micro giây). Các sản phẩm phụ được hình thành có thể khác nhau tùy thuộc vào cách thức phản ứng oxy hóa trực tiếp bởi ozôn hay oxy hóa gián
tiếp nhờ các gốc tự do. Nhìn chung, do các gốc tự do hydroxyl có khả năng oxy hóa cao, nên quá trình oxy hóa tiên tiến được thực hiện theo cơ chế gốc.
Việc sử dụng ozôn nhằm xử lý các hợp chất hữu cơ độc hại nói chung, các thuốc nhuộm và chất màu nói riêng cho thấy: Chi phí cho việc xử lý rất khác nhau tùy thuộc vào thành phần của nước thải [32,33]. Mặc dù khả năng oxy hóa cao, nhưng việc áp dụng phản ứng ozôn hóa nhằm khoáng hóa hoàn toàn các hợp chất hữu cơ độc hại khó phân hủy vẫn gặp nhiều khó khăn [34]. Hạn chế chính của việc áp dụng hệ thống này là do chi phí đầu tư, chi phí vận hành sử dụng năng lượng điện và chi phí bảo dưỡng rất lớn, ngoài ra các sản phẩm phụ tạo ra có thể gây ô nhiễm thứ cấp [32,33]. Hơn nữa, quá trình ozôn
hóa còn bị hạn chế do độ hòa tan rất thấp của ozôn trong nước (khoảng 10-4 mol/l ở 20°C [35]) và quá trình chuyển khối tương đối chậm.
* uá trình peroxon (O3/H2O2)
Nhiều nghiên cứu đã chỉ ra rằng sự phân hủy của ozôn trong nước được tăng tốc khi có mặt HO2-, bazơ liên hợp của hydro peoxit H2O2. Thực tế, sự phân hủy O3 khi có mặt H2O2 cho phép hình thành các gốc hoạt động như phương trình (1.5). Do đó, sự ghép đôi O3/H2O2 - quá trình peroxon, được sử dụng rất thường xuyên trong xử lý nước.
O3 + H2O2 → OH + HO2+ O2 [26] (1.5)
Năm 2005, Trần Mạnh Trí và cộng sự [36] đã nghiên cứu nhằm áp dụng hệ O3/H2O2 để xử lý nước thải sản xuất bột giấy từ gỗ cây keo lai và cho hiệu quả xử lý màu đạt 98 - 99 %. Gần đây, nhóm nghiên cứu Nguyễn Ngọc Lân và cộng sự - Viện Khoa học và Công nghệ môi trường - trường đại học Bách khoa Hà Nội đã thử nghiệm xử lý nước thải dệt nhuộm khu công nghiệp dệt may Phố Nối (Hưng Yên) bằng phương pháp peroxon trên hệ thống pilot cho các kết quả xử lý độ màu đạt 90 - 99 % và COD đạt 39 - 80 %. Mặc dù quá trình này hiệu quả hơn so với quá trình ozôn hóa do hình thành gốc hydroxyl nhưng hiệu quả của quá trình vẫn bị giới hạn bởi tốc độ phản ứng giữa O3 và H2O2 [37]. Hệ phản ứng này cũng bị ảnh hưởng do các hạn chế
tương tự như quá trình ozôn hóa, đó là độ hòa tan thấp của O3, sự tiêu thụ năng lượng lớn và quá trình phụ thuộc vào nhiều thông số như pH, nhiệt độ, sự có mặt của các phản ứng phụ tiêu thụ OH và phụ thuộc vào loại chất gây ô nhiễm [38].
b. Hiệu ứng Fenton (Fe2+/H2O2)
Khả năng oxy hóa của H2O2 khi có mặt của ion Fe2+ (phản ứng Fenton) đã được nghiên cứu năm 1894 khi J.H. Fenton thực hiện quá trình oxy hóa axit tartaric bằng hydroperoxit với sự có mặt của Fe2+ [5]. Bốn mươi năm sau, Haber và Weiss [6] đã xác định gốc hydroxyl là tác nhân oxy hóa được hình thành từ phản ứng (1.6) và phản ứng được gọi chung là phản ứng Fenton:
H2O2 + Fe2+ → Fe3+ + OH− + OH (1.6)
Ion Fe3+ hình thành có thể tiếp tục phản ứng với hydro peoxit để hình thành ion Fe2+ theo phản ứng:
Fe3+ + H2O2 → Fe2+ + HO2+ H+ (1.7)
Về mặt động học, phản ứng thứ hai (1.7) không nhanh bằng phản ứng thứ nhất (1.6), đặc biệt là trong môi trường axit. Hạn chế này là do sự hình thành hợp chất phức hydro peoxit của ion sắt(III) (Fe(OOH)2+) trong môi trường axit mạnh. Trong môi trường trung tính hoặc axit yếu, ion sắt(III) có xu hướng hình thành hydroxit. Trong nghiên cứu về sự phân hủy hydro peoxit khi có mặt muối sắt, Haber và Weiss [6] đã chỉ ra rằng khi hydroperoxit tương đối dư so với sắt, chúng bị phân hủy tạo ra phân tử oxy nhiều hơn so với sự hình thành ion sắt(III). Hệ phản ứng Fenton được duy trì bởi hai phản
ứng trung gian giúp duy trì phản ứng dây chuyền trong môi trường axit:
OH + H2O2 → H2O + HO2(1.8)
HO2+ H2O → OH + H2O2 (1.9)
Tuy nhiên, một số nghiên cứu đã cho thấy có thể xảy ra phản ứng trung gian khác, hình thành ion FeO2+ như phản ứng 1.10 [39]:
H2O2 + Fe2+ → FeO2+ + H2O (1.10)


![Các Phản Ứng Chính Ảnh Hưởng Đến Hệ Phản Ứng Fenton Và Các Hằng Số Nhiệt Động Tương Ứng [40]](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-dac-diem-cua-qua-trinh-khoang-hoa-mot-so-hop-chat-huu-co-ho-4-1-120x90.jpg)

![Dự Đoán Cơ Chế Của Phản Ứng Khoáng Hóa Azobenzen Bằng Hiệu Ứng Fenton Điện Hóa [83]](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-dac-diem-cua-qua-trinh-khoang-hoa-mot-so-hop-chat-huu-co-ho-6-1-120x90.jpg)