chế giảm cholesterol bởi EPS đã được đề xuất dựa trên các thử nghiệm in-vitro trên động vật. Những giả thuyết này bao gồm tác dụng loại bỏ acid mật, đồng hóa và chuyển đổi cholesterol, tác dụng đồng kết tủa (giữa muối mật thủy phân và cholesterol) và thúc đẩy tạo acid béo mạch ngắn để giảm cholesterol [78,79].
Hoạt tính chống đông máu mạnh của các EPS ở dạng dẫn xuất với sulphate đã được kiểm chứng. Heparin Cofactor II là một yếu tố ức chế mạnh đối với thrombin trong con đường đông máu, và các dẫn xuất EPS này có thể tương tác với Heparin Cofactor II để thực hiện hoạt động chống đông máu [80,81]. Các EPS được sulphate hóa cung cấp môi trường acid và tạo điều kiện thuận lợi cho tác dụng ức chế của Heparin Cofactor II đối với thrombin. Các vị trí sulphate hóa và cấu trúc lập thể của EPS có thể kích hoạt Heparin Cofactor II theo cơ chế allosteric [72].
EPS có nguồn gốc từ LAB còn thể hiện hoạt tính chống oxy hóa rất tốt. EPS của L. gasseri FR4 cho thấy hoạt động bắt gốc 2,2-Diphenyl-1-picrylhydrazyl (DPPH) tốt, trong khi hoạt động bắt gốc hydroxyl và superoxide phụ thuộc vào nồng độ EPS [82]. EPS từ L. plantarum cũng thể hiện hoạt hoạt tính chống oxy hóa mạnh [83]. Cơ chế chống oxy hóa của EPS là do quá trình thủy phân các phân tử sinh học này khi tiếp xúc với môi trường acid tạo ra các hydroxyl hemiacet hoạt động. Các hydroxyl hemiacet hoạt động này cho electron đến các gốc tự do, kết quả chuyển đổi các gốc tự do thành dạng ổn định [72]. Ngoài ra, trong thử nghiệm in- vivo, EPS của LAB được chứng minh làm tăng hoạt động của superoxide effutase, catalase trong huyết thanh và glutathione S-transferase ở gan, giảm nồng độ malondialdehyde trong huyết thanh và gan, giảm hoạt tính của monoamin oxydase. Đây là các bằng chứng cho thấy khả năng chống oxy hóa và chống lão hóa tuyệt vời của EPS. Tương tự, EPS-1 của L. helveticus KLDS1.8701 làm giảm đáng kể tình trạng oxy hóa như giảm chỉ số hữu cơ, tổn thương gan và stress oxy hóa gan [84].
Một số EPS có nguồn gốc từ LAB thể hiện đặc trưng phản ứng miễn dịch mạnh mẽ và cho thấy tiềm năng lớn để ứng dụng chống viêm và chống các khối u. Cả HoPS và HePS đều được tìm thấy có đặc điểm điều chỉnh các phản ứng miễn dịch. Đối với HoPS, dextran từ L. sakei MN1 có thể điều chỉnh tăng biểu hiện của interferon-1 và interferon-γ ở thận cá hồi [85]. Liên quan đến HePS, một liều cao của EPS333 được phân lập từ S. thermophilus được chứng minh kích thích đại thực bào RAW 264.7 giải phóng oxit nitric (NO) giúp tăng đáp ứng miễn dịch tế bào
[86]. Hoạt tính chống khối u của EPS có liên quan đến hoạt động điều hòa miễn dịch, nó không chỉ gián tiếp mà còn trực tiếp tiêu diệt các tế bào khối u. Một số EPS có thể gián tiếp kích hoạt các đại thực bào để tăng cường khả năng thực bào của nó, tạo điều kiện thuận lợi cho việc tổng hợp các yếu tố tiền viêm (ví dụ như IL-1, IL-6 và IL-12) cũng như interferon (INF-) và ức chế sản xuất các yếu tố chống viêm (ví dụ IL-10), cuối cùng kích thích sự tương tác giữa tế bào miễn dịch và tế bào khối u [87]. Đối với hiệu quả tiêu diệt trực tiếp, một EPS từ L. plantarum 70810 có thể ức chế đáng kể sự tăng sinh của các tế bào khối u HepG-2, BGC-823, đặc biệt là tế bào HT-29 [88]. EPS được sản xuất bởi L. plantarum YW32 cũng thể hiện hoạt động ức chế mạnh chống lại các tế bào khối u HT-29 [89].
Hoạt tính chống virus của EPS có nguồn gốc từ LAB cũng đã được kiểm chứng. EPS được sản xuất bởi L. plantarum LRCC5310 có thể kiểm soát hiệu quả nhiễm virus rota [90]. Bằng cách này hay cách khác, hiệu quả hoạt động chống virus của dẫn xuất EPS với sulphate có liên quan đến cấu trúc (tương tác với hệ thống nhận tín hiệu, các thụ thể nhận hoặc enzyme) và đặc tính tích điện âm của các polymer này [72]. Heparin Sulfated, là một thụ thể liên quan đến nhiễm virus, tồn tại rất nhiều trên bề mặt của các tế bào. Trong khi đó, EPS trong dẫn xuất với sulphate tương đồng với cấu trúc của Heparin Sulfated. Do đó, nó có thể ức chế cạnh tranh trong quá trình kết hợp giữa Heparin Sulfated với virus [91].
1.5. Sinh tổng hợp EPS ở LAB
LAB có thể sản xuất EPS với thành phần và cấu trúc khác nhau tùy thuộc vào bản chất của các enzyme chuyên biệt chịu trách nhiệm tổng hợp các đơn vị lặp lại của EPS. Tuy nhiên, về cơ bản, cơ chế sinh tổng hợp EPS được bảo tồn cao trong LAB [92].
Sinh tổng hợp HePS ở LAB là một quá trình phức tạp mà trong đó có liên quan đến vai trò đặc biệt của một số enzyme được mã hóa bởi cụm gen eps. Ngoài ra, quá trình này cũng đòi hỏi chức năng của một số enzyme được mã hoá bởi gen housekeeping (là gen cần thiết để duy trì chức năng cơ bản của tế bào và được biểu hiện trong tất cả các tế bào của một sinh vật). Các enzyme được mã hoá bởi gen housekeeping trong tế bào chất khởi đầu cho quá trình tổng hợp HePS nhưng chỉ có một enzyme chuyên biệt và duy nhất chịu trách nhiệm cho quá trình này. Yếu tố quan trọng đầu tiên cho quá trình sinh tổng hợp EPS là glucose-6-phosphate, nó là
sản phẩm cuối cùng của quá trình dị hóa đường trong chuyển hóa của tế bào (Hình 1.6) [93].
Một sản phẩm khác của gen housekeeping là enzyme phosphoglucomutase thực hiện quá trình chuyển đổi glucose-6-phosphate thành glucose-1-phosphate [94]. Bên cạnh sản xuất glucose-1-phosphate, việc sinh tổng hợp lipid vận chuyển (hay là undecaprenyl phosphate (C55-P), cần thiết cho sinh tổng hợp HePS) là một điển hình khác cho vai trò của các enzyme được mã hóa bởi gen housekeeping trong sản xuất EPS. C55-P cũng liên quan đến việc lắp ráp cấu trúc vỏ tế bào như peptidoglycan, acid teichoic và acid lipoteichoic [1,26].
Bên ngoài tế bào
Bên trong tế bào
Hình 1.6. Sơ đồ chi tiết về sản xuất EPS của LAB thông qua việc chuyển đổi đường lactose, galactose và glucose trong tế bào chất [93]
Tiếp theo, sự hình thành các nucleotide-đường từ glucose-1-phosphate là một quá trình cần thiết cho sản xuất HePS mà ở đó các enzyme được mã hoá bởi gen housekeeping cũng có liên quan [94]. Cụ thể là UDP-glucose pyrophosphorylase và dTDP-glucose pyrophosphorylase lần lượt chuyển đổi glucose-1-phosphate thành
các nucleotide-đường như Uridine diphosphate glucose (UDP-glucose) và
Thymidine diphosphate glucose (dTDP-glucose) (Hình 1.7) [93]. Một số gen khác mã hóa cho các enzyme sản xuất nucleotide-đường cũng được tìm thấy ở các chủng LAB khác nhau. Ví dụ, cụm gen eps của L. rhamnosus có chứa các gen chịu trách nhiệm cho sinh tổng hợp tiền chất dTDP-rhamnose [95]. Những nucleotide-đường này cần thiết cho quá tổng hợp đơn vị lặp lại và cả sự thay đổi xen kẽ giữa các đường cho quá trình sinh tổng hợp HePS [96].
dTDP-glucose | |
UDP-galactose | dTDP-Rhamnose |
Có thể bạn quan tâm!
-
 Nghiên cứu các điều kiện stress môi trường đến khả năng tổng hợp exopolysaccharides của vi khuẩn Lactobacillus plantarum - 2
Nghiên cứu các điều kiện stress môi trường đến khả năng tổng hợp exopolysaccharides của vi khuẩn Lactobacillus plantarum - 2 -
![Vị Trí Phát Sinh Loài Của L. Plantarum So Với Một Số Lab Liên Quan Khác Dựa Trên Trình Tự 16S Rrna [22]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Vị Trí Phát Sinh Loài Của L. Plantarum So Với Một Số Lab Liên Quan Khác Dựa Trên Trình Tự 16S Rrna [22]
Vị Trí Phát Sinh Loài Của L. Plantarum So Với Một Số Lab Liên Quan Khác Dựa Trên Trình Tự 16S Rrna [22] -
 Cấu Trúc Đơn Vị Lặp Lại Của Eps Ở Một Số Lab
Cấu Trúc Đơn Vị Lặp Lại Của Eps Ở Một Số Lab -
 Sơ Đồ Tổ Chức Di Truyền Của Cụm Gen Eps Trong L. Plantarum. Pb: Sinh Tổng Hợp Tiền Chất, Of: Chức Năng Khác Liên Quan Đến Eps, Dec: Nhóm Khác, Otr: Điều
Sơ Đồ Tổ Chức Di Truyền Của Cụm Gen Eps Trong L. Plantarum. Pb: Sinh Tổng Hợp Tiền Chất, Of: Chức Năng Khác Liên Quan Đến Eps, Dec: Nhóm Khác, Otr: Điều -
 Stress Môi Trường Và Đáp Ứng Sinh Tổng Hợp Eps Ở Lab
Stress Môi Trường Và Đáp Ứng Sinh Tổng Hợp Eps Ở Lab -
 Các Phương Pháp Phân Lập Và Tuyển Chọn Vi Khuẩn L. Platarum
Các Phương Pháp Phân Lập Và Tuyển Chọn Vi Khuẩn L. Platarum
Xem toàn bộ 169 trang tài liệu này.
Hình 1.7. Cấu tạo của nucleotide-đường [97]
Sau khi tổng hợp các nucleotide-đường, việc lắp ráp các tiểu đơn vị monosaccharide vào đơn vị lặp lại từ các nucleotide-đường hoạt hóa và các bước sản xuất EPS tiếp theo xảy ra lần lượt do hoạt động xúc tác của các glycosyltransferase và các enzyme chuyên biệt [96]. Ngoài các glycosyltransferase, các cụm eps này còn chứa một số gen quan trọng khác mã hóa cho các enzyme liên quan đến điều hòa sinh tổng hợp nucleotide-đường, xác định độ dài chuỗi, trùng hợp và xuất các đơn vị lặp lại ra ngoài [30].
Bước đầu tiên trong quá trình tổng hợp HePS là gắn nucleotide-đường đầu tiên với C55-P nằm trên màng tế bào chất. Quá trình này được thực hiện bởi priming glycosyltransferase. Tiếp theo là sự bổ sung tuần tự các nucleotide-đường bởi các glycosyltransferase liên quan được mã hóa trong cụm eps để tạo thành các đơn vị lặp lại của EPS (Hình 1.8).
Bước tiếp theo là trùng hợp và xuất các đơn vị lặp lại qua màng tế bào. Về cơ bản, có ba loại protein khác nhau được mã hóa bởi các gen trong cụm eps thực hiện quá trình trùng hợp và xuất này: đầu tiên, một flippase hoặc translocase di chuyển phức hợp (đơn vị lặp lại + C55-P) từ màng tế bào chất sang periplasmic (chu chất) của màng tế bào; Kế tiếp, một polymerase xúc tác sự lắp ghép các đơn vị lặp lại này, và cuối cùng một protein xác định độ dài chuỗi sẽ tách phức hợp (đơn vị lặp lại
+ C55-P) để ngăn chặn quá trình trùng hợp cũng như xác định độ dài chuỗi EPS cuối cùng [94].
Trùng hợp và xuất ra ngoài
Đơn vị lặp lại
Chất mang lipid
Hình 1.8. Sơ đồ sinh tổng hợp EPS trong L. lactis NIZO [96]
Một số sản phẩm gen khác như tyrosine kinase cũng đóng vai trò quan trọng trong việc xác định độ dài chuỗi EPS cuối cùng. Sau đó, các EPS này được phóng thích trực tiếp ra môi trường dưới dạng EPS ngoại bào hoặc vẫn được gắn vào bề mặt tế bào tạo thành EPS dạng nang [96]. Ở vi khuẩn Gram dương, phần lớn EPS dạng nang vẫn gắn vào PG hoặc các thành phần của màng tế bào thông qua liên kết cộng hóa trị nhưng một số EPS vẫn có thể được giải phóng khỏi bề mặt tế bào [98]. Mặc dù chưa xác định được cơ chế của sự gắn kết EPS với bề mặt tế bào hoặc sự phóng thích trực tiếp của nó vào môi trường, nhưng một protein màng ngoài là Wzi trong E. coli được chứng minh là có liên quan đến sự gắn kết này để hình thành EPS dạng nang và không có protein này dẫn đến sự gia tăng số lượng EPS được giải phóng ra môi trường bên ngoài [99].
Quá trình sản xuất HoPS thì đơn giản hơn. LAB có thể sản xuất các loại HoPS khác nhau như dextran, levan, pullulan và reuteran. Cấu trúc HoPS của LAB bao gồm các đơn vị glucose hoặc fructose với các liên kết glycoside khác nhau, có thể tuyến tính hoặc phân nhánh. Các chuỗi monosaccharide có độ dài, khối lượng phân tử và cấu tạo khác nhau tùy thuộc vào vai trò của glycosyltransferase cụ thể chịu trách nhiệm cho quá trình này [100]. HoPS được tổng hợp bên ngoài tế bào bởi xúc tác của glucosyltransferase hoặc fructosyltransferase (thường được đặt tên là glucansucrase hoặc fructansucrase). LAB cũng sử dụng glycosyltransferase ngoại bào để tổng hợp α-glucan từ saccharose. Quá trình này sử dụng saccharose như cơ chất đặc biệt và năng lượng cần thiết cho quá trình tổng hợp đến từ việc thủy phân saccharose. Yêu cầu năng lượng cho sản xuất HoPS ít hơn so với sinh tổng hợp enzyme vì tổng hợp HoPS không liên quan đến quá trình vận chuyển tích cực hoặc sử dụng tiền chất đường hoạt hoá. Do đó, một lượng lớn saccharose có thể dễ dàng được chuyển đổi thành EPS. Các glycosyltransferase liên kết với mặt trong của thành tế bào có thể kết hợp hai hoạt động: hoạt động glycosyltransferase và hoạt động vận chuyển.
Phản ứng sinh tổng hợp glucan dưới sự xúc tác của glycosyltransferase được mô tả theo sơ đồ hình 1.9.
Saccharose + H2O → glucose + fructose
Saccharose + yếu tố nhận carbohydrate → oligosaccharide + fructose Saccharose + glucan (n) → glucan (n+1) + fructose
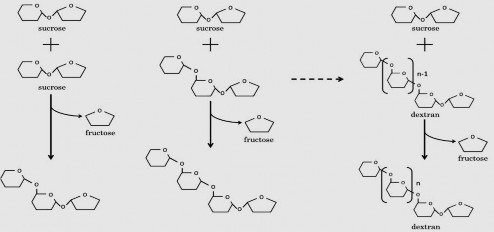
Hình 1.9. Tổng hợp dextran bởi glycosyltransferase (dextran sucrase)
Mặc dù các enzyme glycosyltransferase có mức độ tương đồng cao, nhưng
Lactobacillus tạo ra phổ glucan rất rộng, bao gồm các polymer với liên kết α-1,6
(dextran), liên kết α-1,3 (mutan), và cả liên kết α-1,6 và α-1,4 (alternan). Trọng lượng phân tử tương đối của các glucan từ vi khuẩn Lactobacillus nằm trong khoảng từ 1×106 đến 5×107 Da [101].
1.6. Di truyền liên quan đến sản xuất EPS ở Lactobacillus
Các cụm gen eps thường nằm trên plasmid đối với các chi LAB ưa nhiệt vừa phải như Lactococcus và trên nhiễm sắc thể đối với các chi ưa nhiệt như Streptococcus và Lactobacillus [94]. Chỉ có một gen duy nhất liên quan đến sản xuất HoPS, trong khi đối với HePS thì cụm gen eps chịu trách nhiệm cho quá trình này.
Một vài LAB có các gen gtf hoặc ftf mã hóa cho các enzyme tham gia tổng hợp glucan hoặc fructan. Một số LAB có thể chứa nhiều hơn một gen gtf trong bộ gen của chúng. Dựa trên phân tích trình tự acid amin của các enzyme glucosyltransferase và fructosyltransferase, kết quả cho thấy fructosyltransferase có độ tương đồng cao trong khi độ tương đồng giữa các glucosyltransferase thì thấp hơn [102]. Điều này giải thích cho sự đa dạng trong cấu trúc của glucan ở các LAB khác nhau trong khi cấu trúc của fructan thì khá nhất quán.
Trái ngược với sản xuất HoPS, sản xuất HePS đòi hỏi sự kết hợp của một số gen nằm trong cụm eps. Đến nay, tổ chức cụm gen eps ở LAB đã được xác định. Các nghiên cứu đều nhấn mạnh đặc điểm chung của cụm eps trong Lactobacillus bao gồm bốn khu vực chính: thứ nhất là vùng trung tâm bao gồm các gen gt mã hóa cho các enzyme glycosyltransferase chịu trách nhiệm sinh tổng hợp đơn vị lặp lại của EPS; thứ hai là khu vực có các gen mã hóa cho các protein có liên quan đến xác định độ dài chuỗi EPS, thường nằm ở upstream của khu vực trung tâm; khu vực thứ ba được hình thành bởi các gen qui định protein trùng hợp và xuất, nằm ở downstream của khu vực trung tâm và khu vực cuối cùng chịu trách nhiệm điều hòa phiên mã cho quá trình sinh tổng hợp EPS nằm ở đầu cụm eps [103-105].
Các cụm eps thường bắt đầu với gen epsA (wzg hay cpsA). Gen này được chứng minh là bộ điều hòa tích cực cho quá trình sinh tổng hợp EPS. Sự hiện diện của epsA cần thiết cho sản xuất EPS ở L. Johnsonii [106]. Tuy nhiên, không tìm thấy sự xuất hiện epsA trong cụm gen eps của L. plantarum. Trong L. plantarum WCFS1, một ORF (open reading frame) có liên quan là lp_1000, tương tự như epsA có mặt ở vị trí xa so với cụm eps được chứng minh có liên quan đến sự hình
thành màng sinh học. Có thể protein được mã hóa bởi ORF này hoạt động như protein được mã hóa bởi epsA trong L. Johnsonii. Do ít được bảo tồn trong cụm eps của LAB nên không có nhiều nghiên cứu làm sáng tỏ chức năng của epsA. Các nghiên cứu gần đây trên vi khuẩn Gram dương gây bệnh cho thấy protein được mã hóa bởi epsA cần thiết cho việc gắn các EPS dạng nang vào thành tế bào bằng cách hình thành các liên kết phosphodiester [107,108].
Gen epsA được theo sau bởi ba gen hoạt động như một phức hợp và được gọi tên là epsB (wzh hay cpsB), epsC (wzd hay cpsC) và epsD (wze hay cpsD), chịu trách nhiệm xác định độ dài chuỗi của EPS cuối cùng [1]. Bộ ba gen này cho thấy có sự tương đồng cao giữa các loài khác nhau và các gen epsB, epsC và epsD lần lượt mã hóa cho protein xác định độ dài chuỗi, tyrosine kinase và phosphotyrosine phosphatase [50,92]. Không có nhiều thông tin về cách thức epsB, epsC và epsD phối hợp với nhau để xác định độ dài chuỗi EPS cuối cùng trong Lactobacillus. Tuy nhiên, một nghiên cứu chứng minh rằng quá trình tự phosphoryl hóa tyrosine của CpsD (sản phẩm gen của cpsD) làm suy giảm hoạt động của nó và làm giảm mức độ sản xuất EPS. CpsC (sản phẩm gen của cpsC) cần thiết cho quá trình phosphoryl hóa tyrosine của CpsD và trong quá trình này thì CpsB (sản phẩm gen của cpsB) có ảnh hưởng đến quá trình khử phospho của CpsD. CpsC và CpsD (tương đồng với EpsB và EpsC trong Lactobacillus) tương tác với nhau tạo ra một phức hợp, khi ATP liên kết với phức hợp và phosphoryl hóa tyrosine CpsD (EpsC), và sau đó CpsB (EpsD) khử phospho của phức hợp này để điều chỉnh sản xuất EPS và xác định độ dài chuỗi của sản phẩm cuối cùng. Mặc dù các gen này hoạt động như một phức hợp điều hòa phospho nhưng thứ tự của ba gen này trong cụm eps hoặc cps có thể khác nhau giữa các loài khác nhau. Mặt khác, phức hợp gen điều hòa phospho này và epsA cũng có liên quan với nhau. CpsA (protein được mã hóa bởi cpsA) và các protein điều hòa phospho phối hợp với nhau để điều chỉnh các hoạt động khác của nhau. Ở S. agalactiae, CpsC (tương đồng với EpsB trong Lactobacillus) được chứng minh tương tác vật lý với CpsA (tương đồng EpsA trong Lactobacillus) và điều hòa hoạt động gắn EPS vào thành tế bào [109]. Hơn nữa, ở S. pneumoniae, việc giảm mức độ phosphoryl hoá tyrosine của CpsD (tương đồng EpsC trong Lactobacillus) cũng được quan sát thấy khi xóa cpsA [110].


![Vị Trí Phát Sinh Loài Của L. Plantarum So Với Một Số Lab Liên Quan Khác Dựa Trên Trình Tự 16S Rrna [22]](https://tailieuthamkhao.com/uploads/2023/02/19/nghien-cuu-cac-dieu-kien-stress-moi-truong-den-kha-nang-tong-hop-3-1-120x90.jpg)



