Vùng trung tâm trong của cụm eps là các gen gt mã hóa cho các enzyme glycosyltransferase chịu trách nhiệm cho quá trình sinh tổng hợp các đơn vị lặp lại EPS. Cụm gt thường bắt đầu bằng gen epsE (cpsE), nằm ở upstream của cụm, mã hóa cho priming glycosyltransferase chịu trách nhiệm bổ sung monomer đường đầu tiên từ một nucleotide-đường hoạt hóa vào C55-P [92,103]. Phân tích chức năng của các sản phẩm gen epsE trong một số LAB cũng xác nhận vai trò của epsE là mã hóa cho enzyme priming glycosyltransferase khởi đầu quá trình tổng hợp EPS bằng cách thêm galactosyl-1-phosphate hoặc glucosyl-1-phosphate vào C55-P. Việc cắt bỏ gen epsE dẫn đến mất khả năng sản xuất EPS ở một số loài vi khuẩn [104,111]. Protein được mã hóa bởi epsE trong L. johnsonii FI9785 đặc trưng như một galactosyltransferase [44]. Ngoài ra, người ta đã chứng minh rằng việc xóa gen epsE trong L. rhamnosus GG dẫn đến mất khả năng sản xuất EPS giàu galactose nhưng một loại EPS giàu glucose vẫn còn tồn tại trên bề mặt tế bào, kết quả này cho thấy L. rhamnosus GG có thể tạo ra hai loại EPS và gen epsE có thể mã hóa priming glycosyltransferase cho EPS giàu galactose nhưng không phải cho EPS giàu glucose [103].
Glycosyltransferase là một nhóm các enzyme rất đa dạng có thể nhận ra một loạt các phân tử chất cho và chất nhận, và thường được mô tả là hỗn tạp. Hiện tại, hơn 101 họ glycosyltransferase được mô tả trong cơ sở dữ liệu trực tuyến Carbohydrate-Active enZymes (CAZy) [112]. Sự đa dạng của các gen gt mã hóa cho enzyme glycosyltransferase trong LAB là rất lớn. Vùng gen gt của S. thermophilus Sfi6 bao gồm các gen epsEFGHI, với epsE mã hóa cho enzyme chuyển galactosyl-1-P (priming glycosyltransferase). epsF mã hóa một galactosyltransferase gắn thêm α-1,6-galactose tạo phân nhánh, epsG là α-1,3-N- acetylgalactosaminyltransferase thực hiện phản ứng thứ hai trong quá trình xây dựng đơn vị lặp lại, epsI qui định cho β-1,3-glucosyltransferase. Do đó, thứ tự sinh tổng hợp của đơn vị lặp lại polysaccharide của S. thermophilus Sfi6 là Gal, GalNAc, Glc và Gal chuỗi bên. Một phân tích chức năng tương tự đã được thực hiện đối với các gen gt trong cụm eps của L. lactis NIZO B40. Kết quả cho thấy epsD (mã hoá cho priming glycosyltransferase) có vai trò gắn glucose từ UDP-glucose với C55-P; epsE (glucosyl-1P) và epsF (glucosyltransferase) gắn glucose từ UDP-glucose với phân tử glucose khác được liên kết với C55-P; epsG (galactosyltransferase) gắn
galactose từ UDP-galactose với cellobiose được liên kết với C55-P. Qua đó cho thấy vai trò giả định của các protein được mã hóa bởi các gen gt ở các loài khác nhau là không giống nhau.
Ở downstream của khu vực trung tâm cụm eps là các gen mã hóa cho protein chịu trách nhiệm cho quá trình trùng hợp và xuất EPS ra ngoài. Flippase, một enzyme được mã hóa bởi gen wzx (cpsJ) trong vùng trùng hợp và xuất của cụm eps ở LAB, có vai trò chuyển phức hợp C55-P - đơn vị lặp lại từ mặt trong của màng tế bào sang lớp chu chất. Vùng này còn chứa một gen quan trọng khác chịu trách nhiệm trùng hợp các đơn vị lặp lại của EPS là wzy (cpsH), mã hóa cho polymerase gắn các đơn vị lặp lại với nhau để tạo thành chuỗi polysaccharide [92]. Hơn 90% protein được mã hóa bởi wzx và wzy, có đầu N-xác định nằm ở mặt trong của màng, nơi tiếp xúc với tế bào chất. Trong số này, phần lớn protein được mã hóa bởi wzx có đầu C-xác định nằm ở mặt trong của màng, nơi tiếp xúc với tế bào chất trong khi protein được mã hóa bởi wzy có đầu C-xác định nằm ở mặt ngoài của màng tế bào chất [113]. Mặc dù các gen này cho thấy có độ tương đồng cao trong các cụm eps nhưng chức năng của protein được mã hóa bởi những gen này vẫn chưa được sáng tỏ đối với LAB. Cũng giống như epsA, đặc tính của các protein vận chuyển và lắp ráp các đơn vị lặp lại được mã hóa bởi wzx và wzy đã không được nhiều nghiên cứu theo đuổi.
Gen cuối cùng được xác định trong cụm eps của LAB là glf, được dự đoán mã hóa enzyme mutase xúc tác sự chuyển đổi qua lại giữa các nucleotide-đường (liên quan đến cấu trúc đơn vị lặp lại của EPS) [114]. Chẳng hạn như cụm eps của
L. rhamnosus được chứng minh có chứa các gen liên quan đến sinh tổng hợp tiền chất dTDP-rhamnose, quyết định hàm lượng rhamnose trong EPS thu được [95,103].
Bên cạnh bốn khu vực chính trong cụm gen eps, một số cụm eps còn chứa các gen liên quan đến sinh tổng hợp tiền chất nucleotide-đường. Trong Lactobacillus, gen mã hóa cho UDP-galactopyranose mutase được tìm thấy phổ biến nhất trên cụm gen eps [113]. Điều này phù hợp với sự xuất hiện của galactofuranose trong nhiều EPS của Lactobacillus [115]. galE, qui định UDP- glucose 4-epimerase (galE), là gen sinh tổng hợp tiền chất nucleotide-đường phổ biến tiếp theo được tìm thấy trên cụm eps [113]. galE được chứng minh tạo ra sự
xen kẽ giữa đường hexose (glucose/galactose) và N-acetylhexosamine (N- acetylglucosamine/N-acetylgalactosamine). Ngoài ra, cụm eps đôi khi còn chứa một tập hợp của của bốn gen được gọi là rmlA, rmlB, rmlC và rmlD cần thiết cho quá trình sinh tổng hợp dTDP-L-rhamnose [116]. Những gen này lần lượt mã hóa cho glucose-1-phosphate thymidylyltransferase, dTDP-glucose 4,6-dehydratase, dTDP- 4-dehydrorhamnose 3,5-epimerase và dTDP-4-dehydrorhamnose reductase. Trong một số trường hợp, operon rmlABCD không có trong cụm eps mà nằm ở downstream của cụm, sau khoảng cách của một vài gen không liên quan [113]. Thật ra, người ta biết rằng các gen bên ngoài cụm eps cũng góp phần vào quá trình sinh tổng hợp các tiền chất nucleotide-đường hoạt hóa. Sáu trong số khoảng 11 loại đường (bao gồm N-acetylgalactosamine, galactose và rhamnose) được tìm thấy trong EPS của LAB có liên quan đến các enzyme được mã hóa bởi các gen housekeeping. Các gen mã hóa UDP-N-acetylglucosamine-2-epimerase, chịu trách nhiệm cho sự hiện diện của N-acetyl-mannosamine hoặc N-acetyl- mannosaminuronic trong EPS cũng được tìm thấy trên cụm eps [113]. Đây là một phát hiện bất ngờ, vì rất ít chủng Lactobacillus cho đến nay được ghi nhận có các loại đường này như là một thành phần của EPS [115,117].
Nhìn chung, có nhiều gen liên quan đến sinh tổng hợp EPS nhưng trong quá trình điều hòa, tổng hợp và vận chuyển EPS ở LAB đôi khi chỉ cần một vài gen thiết yếu, thường xuất hiện trong các cụm eps [50,118]. Các gen thiết yếu trong cụm eps bao gồm epsE (mã hoá cho priming glycosyltransferase), các gen gt (mã hoá cho các glycosyltransferase), wzx (mã hoá cho flippase), wzy (cpsH) (mã hoá cho các polymerase), epsC (mã hoá cho tyrosine kinase) và epsB (mã hoá cho nhân tố điều hoà tyrosine kinase).
Ngoài các gen thiết yếu còn có các gen khác thường xuất hiện như một phần của cụm eps nhưng chúng có thể phân tán hoặc có mặt ở nơi khác trong bộ gen bao gồm: bộ điều hòa phiên mã LytR (epsA); epsD (mã hoá cho các phosphotyrosine phosphatase); các gen liên quan đến việc tạo ra tiền chất đường hoạt hóa; acetyl transferase và pyruvyl transferase liên quan đến sự đa dạng trong cấu trúc hóa học của EPS [50].
Một điều khá thú vị là không phải tất cả các cụm eps đều chứa tất cả các gen cần cho quá trình sinh tổng hợp EPS. Trong các cụm không hoàn chỉnh như vậy,
wzy là gen bị thiếu phổ biến nhất, tiếp theo là mô đun điều hoà phospho (epsB và epsC hoặc cả hai), wzx và epsE [119]. Tính không đồng nhất về số lượng và thứ tự các gen trong cụm eps không chỉ ở các loài LAB khác nhau (Hình 1.11) mà còn tìm thấy trong cùng một loài (Hình 1.10).
B C D PB E gt gt wzy gt wzx
L. plantarum ST- III_c(-)
gt gt PB OF OF wzy OF Dec gt ORT UF ORT wzx E
Có thể bạn quan tâm!
-
![Vị Trí Phát Sinh Loài Của L. Plantarum So Với Một Số Lab Liên Quan Khác Dựa Trên Trình Tự 16S Rrna [22]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Vị Trí Phát Sinh Loài Của L. Plantarum So Với Một Số Lab Liên Quan Khác Dựa Trên Trình Tự 16S Rrna [22]
Vị Trí Phát Sinh Loài Của L. Plantarum So Với Một Số Lab Liên Quan Khác Dựa Trên Trình Tự 16S Rrna [22] -
 Cấu Trúc Đơn Vị Lặp Lại Của Eps Ở Một Số Lab
Cấu Trúc Đơn Vị Lặp Lại Của Eps Ở Một Số Lab -
![Sơ Đồ Chi Tiết Về Sản Xuất Eps Của Lab Thông Qua Việc Chuyển Đổi Đường Lactose, Galactose Và Glucose Trong Tế Bào Chất [93]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Sơ Đồ Chi Tiết Về Sản Xuất Eps Của Lab Thông Qua Việc Chuyển Đổi Đường Lactose, Galactose Và Glucose Trong Tế Bào Chất [93]
Sơ Đồ Chi Tiết Về Sản Xuất Eps Của Lab Thông Qua Việc Chuyển Đổi Đường Lactose, Galactose Và Glucose Trong Tế Bào Chất [93] -
 Stress Môi Trường Và Đáp Ứng Sinh Tổng Hợp Eps Ở Lab
Stress Môi Trường Và Đáp Ứng Sinh Tổng Hợp Eps Ở Lab -
 Các Phương Pháp Phân Lập Và Tuyển Chọn Vi Khuẩn L. Platarum
Các Phương Pháp Phân Lập Và Tuyển Chọn Vi Khuẩn L. Platarum -
 Phân Lập Và Định Danh Chủng Vi Khuẩn Lactobacillus
Phân Lập Và Định Danh Chủng Vi Khuẩn Lactobacillus
Xem toàn bộ 169 trang tài liệu này.
L. plantarum ST- III_b
Hình 1.10. Sơ đồ tổ chức di truyền của cụm gen eps trong L. plantarum. PB: Sinh tổng hợp tiền chất, OF: Chức năng khác liên quan đến EPS, Dec: Nhóm khác, OTR: Điều hòa phiên mã khác
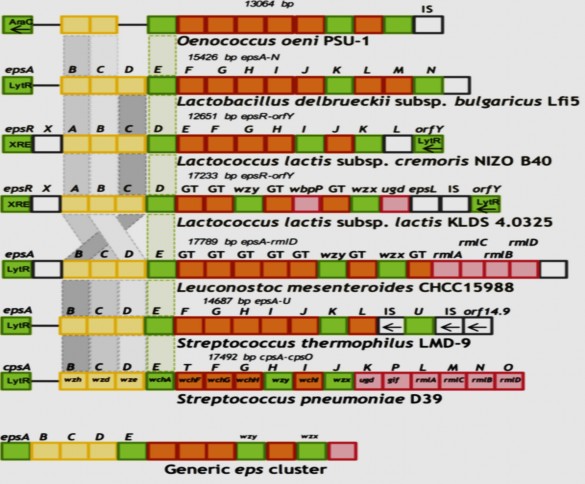
Hình 1.11. Sơ đồ tổ chức di truyền của cụm gen eps trong các LAB khác nhau. Các gen chưa biết chức năng hoặc không liên quan đến sinh tổng hợp EPS có màu trắng, GT: glycosyltransferase, IS: transasease [50]
Danh pháp hiện được sử dụng để chỉ định các gen trong cụm eps cũng khác nhau giữa các loài. Thông thường, các gen eps được gọi theo thứ tự abc dựa trên thứ tự xuất hiện trong một locus nhất định. Kết quả là các gen eps có cùng tên có thể mã hóa cho các protein với các chức năng khác nhau. Chẳng hạn như epsB mã hóa cho tyrosine kinase (nằm trong tế bào chất) ở L. lactis, cho phosphotyrosine phosphatase ở S. thermophilus và tyrosine kinase (nằm ở vùng giới hạn màng) trong L. bulgaricus. Ngay cả đối với cùng một loài, các gen cũng có thể được đặt tên khác nhau. Như ở chủng L. lactis NIZO B40, epsI và epsK tương đồng với wzy và wzx lần lượt mã hóa cho polymerase (enzyme trùng hợp các đơn vị lặp lại) và flippase (enzyme vận chuyển và xuất EPS), trong khi ở L. lactis SMQ-461, các gen có các chức năng tương ứng được đặt tên lần lượt là epsH và epsM.
1.7. Các yếu tố ảnh hưởng đến sinh tổng hợp EPS ở LAB
EPS của LAB là các polymer sinh học tự nhiên có vai trò quan trọng trong y học và thực phẩm. Tuy nhiên, mức độ sản xuất của các biopolymer này ở vi khuẩn tương đối thấp và rất khác nhau. Một số điều kiện như thành phần môi trường nuôi cấy [120], các thông số hóa lý và động học ảnh hưởng đến sản xuất EPS ở LAB [121]. Chẳng hạn, người ta chứng minh rằng năng suất EPS cuối cùng ở bốn chủng
L. rhamnosus có sự khác biệt đáng kể từ 61 mg/L đến 1611 mg/L, mặc dù chúng có tổ chức di truyền giống nhau cho sinh tổng hợp EPS [95].
Một số yếu tố nội bào và ngoại bào cũng ảnh hưởng đến mức độ sản xuất EPS bao gồm môi trường và điều kiện tăng trưởng (nhiệt độ, thời gian nuôi cấy, tỷ lệ carbon: nitơ, pH, các chất dinh dưỡng khác như vitamin và muối khoáng) [122], sự có sẵn của các nucleotide-đường trong chuyển hóa cơ bản của tế bào, mức độ biểu hiện của các gen trong con đường dị hóa đường và nguồn carbon được sử dụng bởi vi khuẩn cũng như mức độ phiên mã của các gen chịu trách nhiệm sản xuất EPS [123]. Sản xuất EPS cũng được tăng cường trong điều kiện đồng nuôi cấy với nấm men Saccharomyces cerevisiae và sự biểu hiện của các gen liên quan đến tổng hợp EPS [124]. Ngoài ra, sự suy giảm của EPS trong thời gian nuôi cấy cũng đã được báo cáo ở một số vi khuẩn. Sự suy giảm của EPS trong suốt thời gian nuôi cấy là do sự hiện diện của glycohydrolase (được sản xuất bởi vi khuẩn) trong môi trường đã xúc tác cho sự thoái biến của các polysaccharide này [125,126].
Cần phải hiểu rằng có mối tương quan giữa các yếu tố bên ngoài và sự biểu hiện của các gen bên trong liên quan đến sinh tổng hợp EPS, bao gồm quá trình xúc tác sinh tổng hợp các đơn vị lặp lại, xác định độ dài chuỗi cuối cùng của EPS. Một vài nghiên cứu về tổng hợp EPS ở cấp độ di truyền đã được báo cáo. Sự biểu hiện quá mức của các gen có liên quan đến quá trình tổng hợp EPS như glucose-1- phosphatethymidyltranseferase (LC2W_2179) làm tăng mức độ tổng hợp EPS từ 10 đến 18% [127]. Một báo cáo khác cho rằng sự biểu hiện quá mức của plasmid chứa cụm gen eps trong L. lactis NIZO B40 dẫn đến sự gia tăng gấp ba lần mức độ biểu hiện của cụm này và tăng gấp bốn lần sản xuất EPS, nhưng tỷ lệ tăng trưởng của chủng đột biến (biểu hiện quá mức) thấp hơn so với chủng dại [128]. Ngoài ra, cũng có báo cáo cho rằng sản xuất EPS tăng mà không có bất kỳ thay đổi nào về sự tăng trưởng của L. casei CG11 và các tác giả cho rằng điều này có thể là do sự sẵn có của các lipid vận chuyển, cần thiết cho quá trình sinh tổng hợp EPS [129]. Hơn nữa, vai trò và tầm quan trọng của quá trình chuyển hóa đường đối với năng suất EPS cuối cùng đã được báo cáo trong S. thermophilus LY03, trong đó sự biểu hiện quá mức của gen galU, mã hóa cho UDP-pyrophosphorylase (GalU), cùng với gen pgmA mã hóa cho phosphoglucomutase dẫn đến tăng sản lượng EPS cuối cùng gấp hai lần [130].
Sự biểu hiện quá mức của gen mã hóa cho priming glycosyltransferase cũng làm tăng sản xuất EPS [131]. Trong một nghiên cứu trước đây, mức độ phiên mã cao hơn của priming glycosyltransferase dẫn đến tăng sản xuất EPS ở B. longum subsp. longum dòng CRC 002 [123]. Một nghiên cứu khác cũng báo cáo rằng việc giảm mức độ phiên mã của gen WelE, mã hóa cho priming glycosyltransferase ở L. rhamnosus, dẫn đến tổng hợp EPS có khối lượng phân tử thấp, có lẽ là do sự thay đổi trong quá trình xác định độ dài chuỗi EPS [132].
1.8. Phản ứng của LAB dưới tác động của stress môi trường
Stress là kết quả của sự tương tác giữa đối tượng và môi trường vượt quá khả năng thích ứng. Stress đã thúc đẩy những thay đổi về mặt tiến hóa (sự phát triển và chọn lọc tự nhiên của các loài theo thời gian). Trên thực tế ở vi khuẩn, bất kể môi trường sống tự nhiên, đều phải chịu những biến động liên tục trong điều kiện sinh trưởng của chúng [133]. Do đó, chúng đã phát triển các phản ứng tinh vi để thích nghi và tồn tại dưới các tác động của yếu tố môi trường. Những phản ứng này rất
khác nhau phụ thuộc vào bản chất vi sinh vật cũng như loại stress và được thực hiện bằng những thay đổi trong sự biểu hiện của những gen mà sản phẩm của chúng được yêu cầu để chống lại các tác nhân gây hại. Đặc biệt, các con đường trao đổi chất của tế bào có liên quan chặt chẽ đến phản ứng stress và sự tăng sản xuất của các chất chuyển hóa đã được nghiên cứu ở LAB.
LAB đã phát triển các cơ chế cụ thể để phản ứng và tồn tại dưới tác động của stress và những thay đổi của môi trường (hệ thống cảm ứng stress và hệ thống phòng thủ). Trên thực tế, vi khuẩn có các cơ chế điều hòa được qui định bởi các gen và sự biểu hiện của các gen này tùy thuộc vào điều kiện môi trường cụ thể. Phòng thủ stress là ví dụ điển hình về hệ thống điều tiết tích hợp như vậy. Các đáp ứng stress của vi khuẩn dựa trên sự biểu hiện phối hợp của các gen làm thay đổi các quá trình tế bào khác nhau (phân chia tế bào, chuyển hóa DNA, thành phần màng, vận chuyển, v.v.) nhằm hoạt động phối hợp để cải thiện khả năng chịu stress của vi khuẩn. Hiện nay, các stress được nghiên cứu nhiều nhất là stress acid, stress nhiệt, stress lạnh. Mặc dù đối với phần lớn các nghiên cứu tập trung vào một nhóm protein cụ thể thay vì phân tích toàn bộ phản ứng.
Trong đáp ứng stress nhiệt, LAB có nhiều cơ chế thích ứng khác nhau bao gồm tăng sản xuất các protein được bảo tồn theo tiến hóa cụ thể. Các protein này bao gồm các protein shock nhiệt (DnaK, GroEL, GroES) và các enzyme đóng vai trò thiết yếu trong việc thúc đẩy việc gấp chính xác và sự chuyển vị của các polypeptit mới tổng hợp. Ngoài ra, LAB phát triển dưới stress nhiệt sở hữu các acid béo bão hòa mạch thẳng, cung cấp tính lưu biến cần thiết cho chức năng của màng tế bào. Một cách khác để bảo vệ các phân tử sinh học như DNA là thông qua sự biểu hiện của các protein liên kết DNA [134].
Khi tế bào LAB tiếp xúc với môi trường lạnh, những thay đổi sinh lý quan trọng xảy ra, chẳng hạn như giảm tính lưu biến của màng và giảm sự ổn định cấu trúc bậc hai của RNA và DNA, dẫn đến giảm hiệu quả dịch mã, phiên mã và sao chép DNA. Phản ứng của vi sinh vật đối với những tác động này được gọi là phản ứng stress lạnh trong đó một số protein shock lạnh được tổng hợp như CspA, CspB and CspC [135]. Ngoài ra, nghiên cứu trên L. helveticus và L. sanfranciscensis cho thấy có sự tăng thành phần acid béo lactobacillic (cần thiết cho sự duy trì màng tế
bào) dưới ảnh hưởng của stress acid và stress lạnh, gợi ý sự bảo vệ và phản ứng của màng tế bào LAB đối với các stress hóa lý [136].
Ở LAB, một trong những cơ chế hiệu quả nhất để kháng với môi trường stress acid là tổng hợp glutamate decarboxylase (GAD). Trên thực tế, GDA có chức năng kiểm soát độ pH của môi trường trong vi khuẩn bằng cách tiêu thụ các ion H+ như một phần của phản ứng carboxyl hóa. Một phân tử bảo vệ khác cũng được tổng hợp bởi LAB trong quá trình lên men là ATPase chuyển vị proton, giúp ổn định pH nội bào để đáp ứng với pH thấp bên ngoài [137]. Phản ứng ở cấp độ acid béo màng đối với stress acid cũng đã được nghiên cứu. Sự rút ngắn chuỗi carbon là chiến lược chính của L. sanfranciscensis để điều chỉnh tính lưu biến hoặc các đặc tính lý hóa của màng tế bào dưới stress acid. Ngoài ra, quá trình dị hóa leucine thành các acid 3-metylbutanoic và 2-metylbutanoic cho thấy rằng việc chuyển đổi từ đường thành quá trình dị hóa acid amin hỗ trợ cho sự phát triển của L. sanfranciscensis trong các môi trường hạn chế như bột chua, đặc trưng bởi stress acid.
Nghiên cứu sự khác biệt giữa stress thẩm thấu được tạo ra bởi muối và đường cho thấy điều kiện thẩm thấu do đường gây ra ít bất lợi hơn và chỉ thoáng qua (stress thẩm thấu thoáng qua), bởi vì các tế bào có thể cân bằng nồng độ lactose và sucrose bên ngoài và bên trong tế bào. Vi khuẩn cần thích nghi với sự thay đổi này trong môi trường để tồn tại và chúng có thể làm điều đó bằng cách tích lũy (hấp thụ hoặc tổng hợp) các chất hòa tan tương thích với thẩm thấu, thường có nguồn gốc hữu cơ, trong các điều kiện thẩm thấu. Các chất hòa tan tương thích được định nghĩa là chất bảo vệ thẩm thấu. Hơn nữa, chất bảo vệ thẩm thấu cũng có thể ổn định các enzyme và cung cấp sự bảo vệ không chỉ chống lại stress thẩm thấu mà còn chống lại các loại stress khác (nhiệt độ cao, đóng băng và làm khô).
Sự tích tụ nội bào của các chất hòa tan tương thích ngăn ngừa sự mất nước do độ thẩm thấu bên ngoài cao. Sự tích tụ carnitin, betain và proline được xác định trong LAB được nuôi cấy trong môi trường MRS. Một số vi khuẩn, chẳng hạn như
L. acidophilus và L. casei, sả xuất ra các phân tử bảo vệ (chủ yếu là protein), chẳng hạn như protein DnaK và HtrS bảo vệ tế bào khỏi tổn thương do muối gây ra [138].

![Vị Trí Phát Sinh Loài Của L. Plantarum So Với Một Số Lab Liên Quan Khác Dựa Trên Trình Tự 16S Rrna [22]](https://tailieuthamkhao.com/uploads/2023/02/19/nghien-cuu-cac-dieu-kien-stress-moi-truong-den-kha-nang-tong-hop-3-1-120x90.jpg)

![Sơ Đồ Chi Tiết Về Sản Xuất Eps Của Lab Thông Qua Việc Chuyển Đổi Đường Lactose, Galactose Và Glucose Trong Tế Bào Chất [93]](https://tailieuthamkhao.com/uploads/2023/02/19/nghien-cuu-cac-dieu-kien-stress-moi-truong-den-kha-nang-tong-hop-5-1-120x90.jpg)